丙型肝炎病毒NS5A蛋白功能的研究进展
- 格式:doc
- 大小:20.66 KB
- 文档页数:15


·综述与讲座·JAK-STAT信号通路及其在肝损伤中的作用李烨,邓存良(泸州医学院附属医院,四川泸州646000)关键词:JAK激酶;STAT;信号转导;肝损伤中图分类号:R392;R575文献标志码:A文章编号:1002-266X(2011)07-0109-03细胞内存在着多种信号转导方式和途径,各种方式和途径间又有多个层次的交叉调控,是一个十分复杂的网络系统。
1994年Darnell[1]等在研究干扰素(IFN-α和IFN-γ)如何诱导基因转录激活时发现了细胞因子信号传导途径JAK-STAT(Janus kinase/signal transducer and activator of transcrip-tion)通路。
该通路能将信号快速从膜传导到核,广泛参与细胞增殖分化、凋亡、炎症、肿瘤等多种生理、病理生理过程,对机体有重要影响[2]。
肝脏是机体合成免疫效应分子的主要部位之一,JAK-STAT信号通路的许多成员在肝组织中表达,不正常的JAK-STAT信号转导可导致多种肝损伤。
现就JAK-STAT信号通路的组成、结构、传导过程及其在肝损伤中的作用作一综述。
1JAK-STAT通路组成、信号传导及调控1.1通路组成JAK-STAT信号通路主要由酪氨酸激酶相关受体、酪氨酸激酶JAK和信号传递与转录激活因子STAT 组成。
1.1.1酪氨酸激酶相关受体许多细胞因子(IFN、IL-2、IL-4、IL-6、CNKT、瘦素等)和生长因子(ECF,PDGF,CSF,EPO 等)通过JAK-STAT信号通路来传导信号,它们在细胞膜上有相应的受体,受体的共同特点是受体本身不具有激酶活性,但胞内段具有酪氨酸激酶JAK的结合位点。
受体与配体结合后,通过与之相结合的JAK活化,磷酸化各种靶蛋白的酪氨酸残基以实现信号从胞外到胞内的传递。
1.1.2JAK JAKs是一类非跨膜型的胞质内可溶性酪氨酸激酶,分子量为120 130KD。
Questions 1对HCV的初步理解1、其基因结构:HCV是正链RNA 病毒,传播的途径为血液传播。
基因全长为9.6kb包括5'-NCR、一个长的开放阅读框(0RF),编码组成约3000个氨基酸的多蛋白前体,和3'-NCR.2、目前hcv研究的现状:患者多,治疗方法不彻底,再感染几率大,潜伏期长,大部分患者会造成慢性肝炎,肝硬化,肝癌等疾病。
研究其感染机制,病毒与宿主细胞的相互作用,一方面能够为制出特异性药物提供思路,另一方面是研发有效疫苗的必经之路。
目前病毒性肝炎的治疗多以聚二乙醇干扰素和利巴韦林,蛋白酶抑制剂联合用药,但是机体对干扰素应答的副作用大,再感染几率高。
在研究方面HCV感染后血清中病毒含量极低,同时目前缺乏有效的体外培养系统及合适的动物模型繁殖病毒,无法获得大量的天然病毒抗原,目前只能通过合成肽或基因重组的方法,获得HCV包膜蛋白抗原。
同时还缺乏有效的疫苗。
3、感染后缺乏有效的免疫的可能原因(1)HCV高度变异,逃避机体的免疫清除;(2)HCV在肝组织及血液中含量低及诱导机体产生保护性的抗原性弱;(3)病毒颗粒与低密度脂蛋白或免疫球蛋白紧密联接,导致抗原决定簇被掩盖;(4)外周血淋巴细胞可能有HCV储存库的作用。
4、研究点:对于以上问题决定我们研究HCV的方向为编码蛋白和宿主因子在HCV复制、组装过程中相互作用,治病机制、疫苗的开发等。
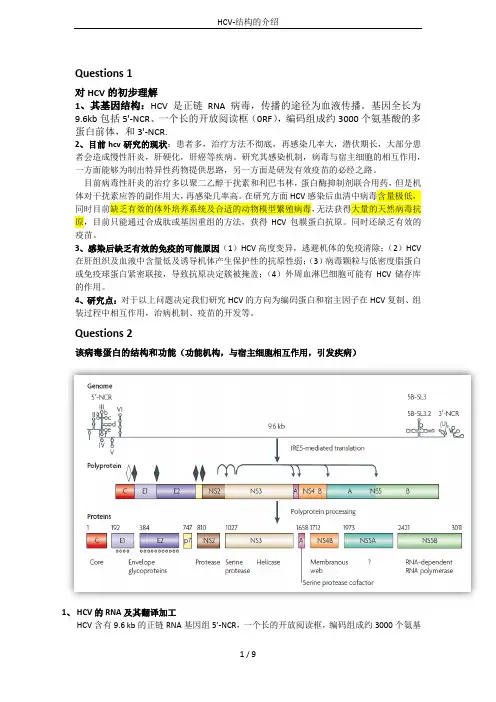
Questions 2该病毒蛋白的结构和功能(功能机构,与宿主细胞相互作用,引发疾病)1、HCV的RNA及其翻译加工HCV含有9.6 kb的正链RNA基因组5'-NCR,一个长的开放阅读框,编码组成约3000个氨基酸的多蛋白前体,和3'-NCR..5'-NCR高度保守,有1-4个域,域一不是IERS起始必须的,但是域一和二是RNA复制所必须的。
每一个HCV都有一个IERS序列,是翻译起始必须的序列。
3'-NCR由一个80个核苷酸序列组成的多聚U的可变区和一个由98个核苷酸组成的X-尾巴的不变区组成。

中国免疫学杂志2021年第37卷Cyclophilin A 在病毒感染中的作用研究进展①岳岩磊张稳稳②张梦豪刘薇(河南农业大学生命科学学院,郑州450002)中图分类号R392文献标志码A文章编号1000-484X (2021)08-1012-06[摘要]Cyclophilin A (CypA )为Cyclophilin (Cyp )家族成员,该家族成员具有顺反异构酶活性。
CypA 是免疫抑制剂环孢素A (CsA )的宿主细胞受体,且CypA 在蛋白质的折叠、免疫应答及炎症调控过程中发挥重要作用。
近年来,越来越多的研究证实,多种病毒感染宿主细胞后,CypA 的表达会发生显著变化,并在病毒复制的不同阶段扮演重要角色,表明CypA 与病毒感染密切相关,但CypA 在病毒感染中的机制尚不明确。
本文主要阐述病毒感染宿主后,CypA 通过与病毒蛋白相互作用或调控干扰素形成等过程发挥其在病毒感染中的作用,提示深入研究CypA 在病毒感染中的分子机制具有重要意义。
[关键词]亲环素A ;病毒感染;环孢素AProgress in Cyclophilin A research on virus infectionYUE Yan -Lei ,ZHANG Wen -Wen ,ZHANG Meng -Hao ,LIU Wei.College of Life Sciences of Henan Agricultural University ,Zhengzhou 450002,China[Abstract ]Cyclophilin A (CypA )is a member of immunophilin superfamily which has peptidyl -prolyl cis -trans isomerase activi‑ty.CypA is the major cellular target for immunosuppressive drug Cyclosporin A (CsA )and is involved in protein folding ,immune re‑sponse and inflammation.In recent years ,an increasing number of studies have confirmed that CypA changes remarkably after differ‑ent viruses infect host cells and plays an important role in different stages of viral replication ,which indicates that there are close ties between CypA and viral infection.However ,the mechanism of CypA in viral infection remains unclear.This article mainly elaborates the role of CypA in viral infection through interaction with viral proteins or regulation of interferon production ,which reminds us it isimportant to study the molecular mechanism of CypA in viral infection.[Key words ]Cyclophilin A ;Virus infection ;Cyclosporin ACyclophilin A (CypA )为Cyclophilin 家族成员,具有顺反异构酶活性,是一个高度保守并广泛存在的蛋白质。


组成hcv的主要成分HCV,即丙型肝炎病毒(Hepatitis C virus),是一种病毒性肝炎的主要原因,它属于RNA病毒,可以分为6个不同的血清型:1a、1b、2a、2b、3a和4。
这些血清型的致病性有所不同,其中1a和1b的传播最为广泛。
HCV由五种结构蛋白组成,包括外壳蛋白(envelope proteins)、内膜蛋白(membrane proteins)、核心蛋白(core proteins)、非结构蛋白(nonstructural proteins)和转录因子(transcription factors)。
外壳蛋白(envelope proteins)由两个结构单位E1和E2组成,它们在病毒膜上形成“锥形”结构,可以抑制宿主免疫系统对病毒的识别,从而使病毒能够感染宿主细胞。
它们可以帮助病毒进入宿主细胞,从而实现繁殖。
内膜蛋白(membrane proteins)由三个结构单位M1、M2和M3组成,它们与外壳蛋白相互作用,以促进病毒的复制。
M1蛋白结构单位可以抑制宿主的抗病毒免疫应答,并参与病毒的繁殖。
M2蛋白结构单位可以抑制宿主细胞的凋亡,M3蛋白结构单位能够增加病毒的传播速度。
核心蛋白(core proteins)由C和NS5A结构单位组成,它们主要负责病毒的繁殖,并参与病毒的复制和传播。
C蛋白结构单位可以帮助病毒进入宿主细胞,并参与病毒的复制。
NS5A结构单位可以抑制宿主细胞的凋亡,参与病毒的繁殖。
非结构蛋白(nonstructural proteins)是病毒的转录因子,可以调节病毒的繁殖和传播。
病毒的非结构蛋白有NS3、NS4A、NS4B、NS5B和NS5C等,它们可以调节病毒的繁殖和传播,从而实现病毒感染和复制。
转录因子(transcription factors)是病毒的转录因子,可以调节病毒的繁殖。
转录因子可以调节病毒的转录和复制,从而促进病毒的繁殖。
总之,HCV由外壳蛋白、内膜蛋白、核心蛋白、非结构蛋白和转录因子等五种结构蛋白组成,它们可以帮助病毒进入宿主细胞,从而实现繁殖。

索磷布韦/维帕他韦在丙型肝炎抗病毒治疗中的作用你了解吗发布时间:2022-02-15T02:03:04.724Z 来源:《中国医学人文》(学术版)2021年11月11期作者:夏玲玲[导读] 肝炎——这个词想必大家都不陌生,何为肝炎病毒呢,就是造成病毒性肝炎的病原体,有多个类型,如甲型、乙型、丙型、丁型、戊型、庚型,其中甲型肝炎病毒是单链RNA核酸,乙型肝炎病毒核酸也是双链DNA,除了这两个类型,其他肝炎病毒类型都是单链RNA。
抛开这些不谈,今天我们重点讲解丙型肝炎及其抗病毒治疗。
朝阳市第四医院肝病二科辽宁朝阳 122000肝炎——这个词想必大家都不陌生,何为肝炎病毒呢,就是造成病毒性肝炎的病原体,有多个类型,如甲型、乙型、丙型、丁型、戊型、庚型,其中甲型肝炎病毒是单链RNA核酸,乙型肝炎病毒核酸也是双链DNA,除了这两个类型,其他肝炎病毒类型都是单链RNA。
抛开这些不谈,今天我们重点讲解丙型肝炎及其抗病毒治疗。
丙型病毒性肝炎的简称就是丙肝、丙型肝炎,是因丙型肝炎病毒感染所致的一种病毒性肝炎疾病。
我们看一下数据,据世界卫生组织的统计[1]:全球丙型病毒性肝炎的感染率可达3%,预估出感染丙型病毒性肝炎的患者大概有1.8亿人次,每年新患病的人数也有3.5万。
可见,丙型肝炎在全球范围内大肆流行,控制不及时会引起患者肝脏慢性炎症坏死与纤维化,部分患者也会演变成肝硬化或者肝细胞癌,对患者的身心健康及其生命安全产生巨大威胁,是严重的社会公共卫生问题。
既然发病率这么高,那人们都是如何感染与传播的呢?其实,丙型肝炎病毒感染的外界因素有很多,比如说饮酒、劳累、长期服用肝毒性药物,而相比其他传染疾病不同,接吻、拥抱、喷嚏、咳嗽、食物、饮水、共用餐具与水杯、不见皮肤破损与血液暴露的人群一般不会传播丙型肝炎病毒,血液、母婴、性传播是丙型肝炎病毒传播的重要途径。
对于丙型病毒性肝炎疾病来说,隐蔽性高,也具有可持续发展的特点,所以临床常常对此类患者进行抗病毒治疗。



肝硬化合理用药在我们身边,有的朋友因乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)感染、酒精性肝病、非酒精性脂肪性肝病等原因导致肝功能减退、食管胃静脉曲张、腹水。
这时候,要当心肝硬化。
肝硬化是各种慢性肝病进展至以肝脏弥漫性纤维化、假小叶形成、肝内外血管增殖为特征的病理阶段,代偿期无明显临床症状,失代偿期以门静脉高压和肝功能严重损伤为特征。
那么,得了肝硬化怎么治疗呢?肝硬化的药物治疗包括病因治疗、抗炎抗肝纤维化治疗等。
一、肝硬化药物治疗方法肝硬化诊断明确后,应尽早开始综合治疗。
重视病因治疗,必要时抗炎抗肝纤维化,积极防治并发症。
▎病因治疗病因治疗是肝硬化治疗的关键,只要存在可控制的病因,均应尽快开始病因治疗。
HBV所致的肝硬化抗病毒治疗参考《慢性乙型肝炎防治指南(2019更新版)》。
若存在肝硬化的客观依据,不论丙氨酸氨基转移酶和HBeAg 的状态如何,只要可检测到HBV DNA,均建议进行积极的抗病毒治疗。
对于失代偿期肝硬化患者,HBV DNA检测不到但HBsAg阳性,建议采用抗病毒治疗。
推荐应用强效低耐药的抗乙肝病毒药物恩替卡韦、富马酸替诺福韦酯、富马酸丙酚替诺福韦和干扰素。
HCV所致的肝硬化抗病毒治疗参考《丙型肝炎防治指南(2019更新版)》。
所有HCV RNA阳性患者均应接受抗病毒治疗。
慢性HCV感染的抗病毒治疗已经进入直接抗病毒药物的泛基因型时代,其在已知主要基因型和亚型的HCV感染者中都能达到90%以上的持续病毒学应答,并且在多个不同临床特点的人群中方案统一,药物相互作用较少,除了失代偿期肝硬化、直接抗病毒药物治疗失败等少数特殊人群以外,也不需要联合利巴韦林治疗,因此,泛基因型方案的应用可减少治疗前和治疗中的监测,也更加适合于在基层对慢性HCV感染者实施治疗和管理。
但需要明确的是,泛基因型方案不是全基因型方案,对于少数未经过直接抗病毒药物临床试验,或者已有的临床试验未获得90%以上持续病毒学应答的基因亚型和耐药相关替代突变的感染者中,还需要规范的临床试验来确定合适的治疗方案。

2015年8月,达卡他韦(daclatasvir)这款口服小分子直接抗病毒药,再次成为丙肝治疗领域的焦点.
蒙特利尔,8月20日,加拿大卫生部正式批准施贵宝生产的(daclatasvir)用于治疗慢性丙型肝炎感染。
批准包括用于治疗成人患者的丙型肝炎基因1型和2型的代偿期肝病包括肝硬化和符合条件的代偿期肝病包括肝硬化3型患者的治疗,为加拿大医生治疗这些患者提供新的选择。
作为丙肝DAAs界的宠儿,达卡他韦和另一款DAAs药物索菲布韦(sofosbuvir),被誉为丙肝治疗领域的双星。
这两款药物的联合使用方案,在2015年7月24日,被美国食品药品监督管理局(FDA)正式批准适用于慢性丙型肝炎治疗,尤其对难治疗基因3型适用。
daclatasvir达卡他韦是第一个已经证明安全性和有效性,治疗基因3型丙型肝炎病毒感染的口服型药物,不需要干扰素和利巴韦林联合。
因为达卡他韦分子结构简单,手性位点较少,分子空间结构具有一定的灵活性,在丙肝病毒NS5A
蛋白氨基酸序列产生变异时,达卡他韦更有可能保持NS5A蛋白抑制剂作用。
在2015年4月的欧洲肝病大会上,达卡他韦联合索菲布韦的治疗方案就已经被EASL认定对特别难治疗的丙肝3型有良好疗效,并推出了权威的丙肝的推荐治疗方案”欧盟组合(daclatasvir+sofosbuvir)“。
老挝卫生部也在2015年5
月份批准了索菲尼(sofosbuvir)+达可汀纳(daclatasvir)在老挝上市。
如今达卡他韦已经被世界众多权威的卫生部们公认为丙肝治疗领域的最安全有效的DAAs药物,达卡他韦联合索菲布韦的治疗方案也将逐步在全球推广,人类战胜丙肝的日子即将到来!。
2020年水果湖二中高三生物上学期期末考试试题及答案解析一、选择题:本题共15小题,每小题2分,共30分。
每小题只有一个选项符合题目要求。
1. 果蝇有突变型和野生型,纯合野生型果蝇表现为灰体、长翅、红眼。
现有甲(黑体)、乙(残翅)、丙(白眼雄果蝇)三种单基因隐性突变体果蝇,这3种隐性突变基因在染色体上的位置如下图所示。
下列说法正确的是()A.将甲、乙杂交得F1,F1雌雄相互交配,可用于验证基因的自由组合定律B.将乙、丙杂交得F1,F1雌雄相互交配,可用于验证白眼基因位于X染色体上C.将甲、丙杂交得F1,F1雌雄相互交配得到F2,F2中灰体红眼的基因型有4种D.将甲与野生型杂交,某性状在后代雌雄个体中所占比例相同,则控制该性状的基因一定位于常染色体上2. 科学家对单细胞伞藻的幼体嫁接,将甲的伞柄嫁接到乙的假根上,长出了乙的伞帽。
如图所示,下列有关评价合理的是()①该实验证明了假根能控制伞帽的形状①该实验证明了细胞核是代谢的调控中心①欲证明细胞核的功能,需同时进行对照实验①该实验证明了细胞质是遗传的控制中心A. ①①B. ①①C. ①①D. ①①3. 下列关于检测生物组织中物质的实验,叙述正确的是()A.西瓜汁中含有较多的葡萄糖,可用斐林试剂进行检测B.用苏丹III检测花生油中的脂肪,颜色变化为橘黄色C.对斐林试剂乙液进行适当稀释后,利用斐林试剂甲、乙液可检测蛋白质D.检测脂肪实验中,需用体积分数为90%的酒精洗去浮色4. 核酸是遗传信息的携带者,下列有关核酸的叙述正确的是()A. 核酸只分布在细胞生物中B.RNA只存在于细胞质中C. 细菌的遗传物质是DNAD. 组成核酸的碱基只有4种5. 弃耕农田发生了一系列的演替,形成森林,关于该过程的叙述错误的是()A.在演替过程中不断进化形成新物种,并取代原有的物种B.随着时间的推移,群落的垂直结构变得复杂C.群落演替使生物群落对光能的利用率提高D.与草本植物阶段相比,木本植物阶段的演替比较缓慢6. 下图为一个人类白化病遗传的家族系谱图。
丙型肝炎病毒NS5A蛋白功能的研究进展丙型肝炎病毒NS5A蛋白功能的研究进展首席医学网2009年08月21日14:11:04 Friday作者:周友乾,尹凤鸣* 综述; 冯经华审校作者单位:解放军第一六九医院感染内科,湖南衡阳421002加入收藏夹【关键词】丙型肝炎病毒NS5A 蛋白丙型肝炎病毒(HCV)可引起肝炎、肝硬化和肝癌等一系列肝脏疾病,且慢性化几率较高。
目前全世界HCV感染人数仍呈增加趋势,因此科学家对HCV的研究高度重视。
HCV 有一个大的开放阅读框编码约三千多个氨基酸的多聚蛋白,经蛋白酶裂解为十个多肽片段;氨基末端为结构蛋白包括有核心蛋白、包膜蛋白E1和E2、P7蛋白;羧基末端为非结构蛋白包括有NS2、NS3、NS4A、NS4B、NS5A和NS5B蛋白。
基中NS5A蛋白位于HCV多聚蛋白前体的1973-2419氨基酸区域,由447个氨基酸组成,氨基末端为双亲性α螺旋可与内质网膜结合。
NS5A还包含有3个同样的ProXaaXaaPro基序,这些基序存在于许多信号蛋白中形成伸展的α螺旋,并与Src同源3(SH3)功能区结合。
根据NS5A 上丝氨酸残基磷酸化程度的不同有p56和p58两种成熟形式。
越来越多的科学家推测NS5A蛋白可能在HCV干扰宿主细胞内信号和免疫逃避方面有一定的作用,发表了不少论文。
本文就NS5A蛋白功能和作用机制的研究进展作一综述。
1 与病毒复制的关系Lohmann等[1]最早运用亚基因组复制子系统研究提出NS5A与RNA复制有关。
随后研究进一步发现NS5A的双亲性膜靶标螺旋的变异与复制子有关,导入三个螺旋分裂的突变可完全终止复制子建立G418耐药的克隆,意味着NS5A 的膜结合是HCVRNA复制不可缺少的一步[2]。
体外临时转染细胞研究显示NS5A和NS5B结合是由NS5A的105-162和277-334残基[3]与NS5B上的四个不连续的区域[4]相结合。
奇怪的是当他们的比例为0.1或更低时,NS5A可适度刺激NS5B的聚合酶活性,而更高的比例时NS5A抑制NS5B的聚合酶活性。
具体机制目前还不清楚,分析认为有可能是体外纯化的NS5A和NS5B融合蛋白的作用结果并不能准确地反映他们在体内的情况。
Shimakami等[5]删除NS5A中与NS5B结合的部分导致亚基因组复制子无功能,而如果删除部分不影响NS5A与NS5B结合则复制子仍能复制,因此推测NS5A与NS5B之间的相互作用是HCV RNA复制所必需的。
用人类肝细胞cDNA文库的酵母双杂交筛选法研究细胞蛋白与NS5A蛋白的相互作用鉴定出33kD人类囊相关膜蛋白(hVAP-33)。
体外连接及体内联合免疫沉淀作用研究,证实NS5A与hVAP-33之间有相互作用,病毒RNA 依赖的RNA聚合酶NS5B也与hVAP-33作用,它俩分别结合到hVAP-33的羧基末端和氨基末端,NS5A和NS5B同时与hVAP独立作用。
免疫荧光显示,hVAP-33主要与ER、高尔基复合体、以及前溶酶体结合。
hVAP可以作为HCV 复制复合物的膜受体,介导HCV复制复合物与膜结合,NS5A及NS5B与hVAP-33的相互作用可能会影响宿主细胞的囊泡转运功能。
研究还发现在一些HCV分离株中有一被称为干扰素敏感决定区(ISDR)内的突变率与病毒RNA滴度成负相关[6],在人肝细胞内NS5A的表达可活化内部核糖体进入位点(internal ribosome entry site, IRES)活性,而ISDR突变则破坏IRES活性[7],这也预示着NS5A蛋白可能在调节HCV复制中起作用。
最近Okamoto等[8]发现NS5A在细胞质中与FK506结合蛋白8的相互作用也在HCV复制中发挥重要作用。
2 与干扰素抗病毒治疗的关系Enomoto等[9]通过分子流行病学调查发现NS5A与干扰素(IFN)治疗的疗效相关,并鉴定出NS5A中一个约40个氨基酸的序列在IFN耐药种株中相对保守,而在IFN敏感种株中变异率较高,因此,推测NS5A在IFN耐药中发挥一定的作用,并把这个氨基酸序列区称为ISDR。
随后科学家[10]还发现:表达有IFN耐药的HCV1b种株的NS5A蛋白的细胞对IFN部分耐药,并允许脑心肌炎病毒和口腔炎小疱疹病毒生长;而在同样的实验中表达IFN敏感的HCV1a或HCV2a基因型或者删除了ISDR的HCV1b型的NS5A蛋白并不能抑制IFN的活性。
Nousbaum等[11]认为NS5A羧基末端ISDR以外的一段序列也与IFN活性有关。
IFN是由宿主不同类型的细胞为应对病毒感染和某些刺激而分泌的细胞因子,分为Ⅰ型和Ⅱ型。
Ⅰ型IF N(α,β,ω,τ)是由各类细胞针对病毒感染分泌的抗病毒活性多肽,表现出非特异性免疫应答特点;Ⅱ型IFN也称为IFNγ是由促有丝分裂素或抗原刺激激活的T细胞和巨噬细胞分泌的抗病毒多肽,充当特异性抗原免疫应答的任务。
Ⅰ型IFN信号途径的传递始于IFN与特异性细胞表面IFN受体的结合。
IFNα与细胞膜上受体结合,引起受体二聚体化,受体胞内区的酪氨酸残基在Janus 激酶作用下磷酸化,而后信号传递体和转录激活剂(STATS)也被Janus激酶磷酸化。
两种Janus激酶酶家族成员JAK1和Tyk2,参与了Ⅱ型IFN信号传导。
磷酸化的STAT1和STAT2结合成异二聚体,转移到细胞核内与DNA结合蛋白p48结合,形成三聚体的干扰素激活基因因子3(ISGF3)。
ISGF3在许多IFN激活基因启动区与IFN激活顺式作用元件(ISRE)结合促进转录。
除了ISGF3外,不同的STAT和二聚体以及不同的IFN转录调节因子,在IFN信号传递途径中也起重要作用。
大量IFN激活基因表达,其蛋白产物介导IFN 多效性抗病毒作用。
目前认为IFN抗RNA病毒的主要机制是其能够诱导产生的一种dsRNA依赖的蛋白激酶(PKR),这种PKR在RNA病毒基因复制时与dsRNA结合而激活,激活后能够磷酸化翻译启始因子eIF-2a亚单位的51位丝氨酸残基,使磷酸化的eIF-2a无法参与蛋白多肽链的翻译过程,从而抑制病毒或细胞蛋白的合成,达到抗病毒的效果[12]。
而研究发现NS5A中ISDR及与其相临的羧基末端的26个残基与PKR的一个二聚作用区域结合后能够抑制PKR自身的磷酸化和对其他外来物质的磷酸化从而抑制PKR活性。
不过也有科学家[13,14]报道未能发现ISDR与IFN疗效的关系。
Podevin等[15]虽然证实NS5A能够抑制IFN抗脑心肌炎病毒和口腔炎小疱疹病毒的活性,但不管是IFN敏感的还是不敏感的NS5A在Huh7或HeLa细胞中都未观察到对PKR活性的影响,用共免疫沉淀和共免疫荧光方法也未检测到NS5A和PKR的相互作用。
这提示NS5A可能还通过其他机制抑制IFN的抗病毒活性。
Khabar等[16]发现白介素8(IL8)能够减弱IFN的抗病毒活性,提示内源性的IL8的产生有助于病毒的感染。
Polyak等[17]也发现HCV感染的患者血清中IL8的水平高于对照组,IFN无应答组高于应答组,并提出NS5A能够促进IL8的产生并减弱IFN的抗病毒活性。
随后Girard等[18]用芯片分析法观察到了同样的现象。
Blindenbacher等[19]发现表达有HCV全基因组的转基因小鼠IFNα刺激转录因子ISGF3的DNA结合活性降低,而淋巴细胞性脉络丛脑膜炎病毒易感性增加。
Shuai等[20]认为Stats的丝氨酸磷酸化在IFN信号的调节方面起着关键性的作用。
Macdonald等[21]推测NS5A可能通过与连接蛋白Grb2相互作用抑制细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)MAPK的活性;这样,NS5A可降低Stat1丝氨酸的磷酸化并减弱细胞对IFNα的反应。
然而,他们[22]随后发现对IFN敏感和耐药的HCV不同基因型的NS5A都能与Grb2结合,似乎并不支持这个假说。
3 与促进宿主细胞有丝分裂的关系HCV能够通过调节宿主细胞的有丝分裂信号途径来调节宿主细胞的生长和活性,从而维持其慢性感染状态。
目前认为主要有三种途径:ERK途径、SAPK/JNK途径和p38MAPK途径[23]。
他们都是基于一个包含有MAPK的三重激酶信号组件,NS5A能够调节这三种MAPK信号途径。
NS5A能够抑制ERK MAPK途径:体外研究显示NS5A能够与Grb2结合。
Grb2能够通过一个SH2区与活化的EGF 受体上磷酸化的酪氨酸残基结合使鸟嘌呤核苷酸交换因子Sos迁移到细胞膜,然后催化Ras GDP-GTP转换,并激活ERK途径[22]。
Tan等[24]报道NS5A并不阻止Grb2-Sos 复合体的形成,而后Hanafusa等进一步证实NS5A能与Grb2 SH2区结合抑制Grb2-Sos与生长因子受体结合,并未抑制Grb2-Sos的结合。
NS5A能够活化JNK MAPK信号途径:NS5A与连接蛋白TRAF2结合,再与配体上的TNF 受体结合,参与JNK的活化[25]。
Park等[26]认为NS5A不是直接活化JNK,仅仅是通过TNFα增强其活性。
NS5A还可通过与TRAF2相互作用调节JNK的活性,在缺乏TNFα时,NS5A也能够通过足够表达TRAF2调节JNK的活性。
NS5A也能够抑制EGF刺激的p38MAPK的活性:这条途径在通过下游靶标控制蛋白翻译方面起着关键性的作用,主要是磷酸化翻译启始因子eIF4E和调节其活性。
NS5A的表达能够降低eIF4E的磷酸化[27]。
4 与细胞凋亡的关系NS5A能够利用多种机制抑制外源性和内源性凋亡刺激因子减少宿主细胞的凋亡。
TNFα是一种主要的外源性凋亡刺激因子,研究表明[28,29]表达NS5A蛋白的细胞能够抵挡TNFα的作用,与对照组相比细胞凋亡明显减少。
生物化学分析显示NS5A与TNFα应答连接蛋白TRADD相互作用调节抑制TNF-α信号。
TRADD与配体上活化的TNF受体结合并形成一个复合体,这个复合体再向多个下游的效应器(胱门蛋白酶、NF-Bβ等)传达信号;NS5A与TRADD结合能够阻断这些信号。
内源性的凋亡主要通过促凋亡和抗凋亡信号的平衡来调节,例如Bcl2蛋白家族包含有促凋亡和抗凋亡成分,他们在线粒体和细胞核膜上受Bcl-2相似区域(BH)间相互作用的驱动形成异二聚体。
这家族中不同成分之间的平衡指导着凋亡反应[30]。
Chung等[31]发现Bcl2家族抗凋亡成分的BH区域与ISDR序列具有相似性。
NS5A内的BH 区域能够和促凋亡的Bcl2蛋白(Bax)结合促进细胞凋亡,这需要NS5A和Bax都存在于细胞核内;然而,完整的NS5A 只存在于细胞质内。