酯的合成方法研究样本
- 格式:doc
- 大小:506.50 KB
- 文档页数:24
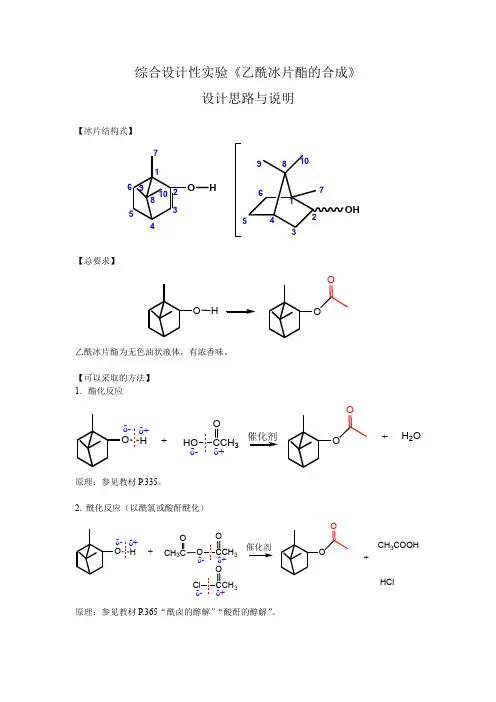
综合设计性实验《乙酰冰片酯的合成》设计思路与说明【冰片结构式】O HOH1234567891012345678910【总要求】OOOH乙酰冰片酯为无色油状液体,有浓香味。
【可以采取的方法】 1.酯化反应O OOHO CCH 3Oδ-δ+Hδ-δ++H 2O+催化剂原理:参见教材P.335。
2. 酰化反应(以酰氯或酸酐酰化)O OOCH 3OO CCH 3O Cl 3O δ-δ+δ-δ+Hδ-δ+++CH 3COOHHCl 原理:参见教材P.365“酰卤的醇解”“酸酐的醇解”。
具体方法:参见以下扫描的内容。
【可提供选择的试剂与仪器】1.仪器:自己实验柜内的仪器;整个实验室可用:移液管(0.2、0.5、1、5ml)各一支2.试剂冰片每组3克乙酰氯整个实验室1瓶醋酐整个实验室1瓶3.溶剂石油醚Ⅱ(60-90)整个实验室1瓶二氯甲烷整个实验室1瓶乙酸乙酯整个实验室1瓶环己烷整个实验室1瓶4.催化剂浓硫酸整个实验室1瓶硫酸氢钠整个实验室1瓶三氯化铁整个实验室1瓶对甲苯磺酸整个实验室1瓶4-二甲氨基吡啶DMAP整个实验室1瓶强酸阳离子交换树脂5. 干燥剂饱和碳酸钠无水硫酸镁6. 检测方法外观性状测折光率【实验方案格式】《乙酸冰片酯合成》实验方案[实验目的] 综合运用有机化学(实验)的知识、技能,设计乙酸冰片酯的合成方案,并完成乙酸冰片酯的合成。
[实验原理]主反应:可能的副反应及采取的措施:[实验装置](作图)[实验步骤](流程图)[实验结果]。

制取乙酸乙酯实验报告制取乙酸乙酯实验报告实验目的:本实验的目的是通过酯化反应制取乙酸乙酯,并了解酯化反应的原理和条件。
实验原理:乙酸乙酯是一种常见的酯类化合物,其制备主要通过酯化反应来实现。
酯化反应是一种醇和酸反应生成酯的过程。
在本实验中,我们采用乙酸和乙醇作为反应物,硫酸作为催化剂。
乙酸和乙醇在催化剂的作用下发生酯化反应,生成乙酸乙酯和水。
实验步骤:1. 准备实验器材和试剂。
将乙酸和乙醇分别倒入两个干净的试剂瓶中,并称取所需的量。
准备好硫酸作为催化剂,并取适量的冷却水备用。
2. 在反应瓶中加入一定量的乙酸和乙醇,按照化学计量比例加入。
一般情况下,乙酸和乙醇的摩尔比为1:1。
3. 加入少量的硫酸作为催化剂,并轻轻摇晃反应瓶,使反应物充分混合。
4. 将反应瓶放入水浴中进行加热。
加热的温度一般控制在50-60摄氏度之间,以加速反应速率。
5. 在反应过程中,可以观察到反应液逐渐变浑浊,并产生乙酸乙酯的香味。
同时,反应瓶外壁也会有水珠生成。
6. 反应持续进行一段时间后,关闭加热装置,取出反应瓶。
将反应液倒入分液漏斗中,并加入适量的冷却水进行冷却。
7. 冷却后,分液漏斗中会分为两层,上层为乙酸乙酯,下层为水。
打开分液漏斗的塞子,将底层水分离出来。
8. 将上层乙酸乙酯倒入干净的干燥瓶中,并加入少量的干燥剂,如无水氯化钙,以去除残留的水分。
9. 最后,用胶塞封好瓶口,标明实验名称、日期等信息,保存在干燥处。
实验结果:通过本实验,我们成功制取了乙酸乙酯。
制取的乙酸乙酯呈无色液体,具有特殊的香味。
实验过程中,我们观察到乙酸和乙醇在加热过程中发生了酯化反应,生成了乙酸乙酯和水。
通过分液漏斗的分离,我们成功地得到了纯净的乙酸乙酯。
实验讨论:在本实验中,酯化反应的进行需要硫酸作为催化剂。
硫酸的加入可以加速反应速率,促进乙酸和乙醇的酯化反应。
同时,加热也是酯化反应进行的关键条件,通过加热可以提高反应物的活性,使反应更加迅速进行。

乙酸丁酯的合成与精制实验报告.实验目的:本实验旨在掌握乙酸丁酯的合成及精制技术,并通过实验加深对乙酸丁酯的化学性质及应用的认识。
实验原理:乙酸丁酯是一种常用的酯类化合物,化学式为CH3COO(CH2)3CH3。
它是一种无色透明液体,具有水分解性能和较好的挥发性。
乙酸丁酯具有广泛的应用领域,如合成醋酸纤维素、涂料、染料、塑料等。
本实验采用乙酸和丁醇为原料,经过酯化反应合成乙酸丁酯。
所采用的反应方程式如下:CH3COOH + CH3(CH2)3OH → CH3COO(CH2)3CH3 + H2O实验过程:1.取250mL圆底烧瓶,加入被称量好的20g丁醇和20mL无水乙酸,在搅拌下加入少量的硫酸催化剂。
2.按提取法将硫酸和废酸分离。
3.过滤并洗涤沉淀,干燥得到粗品乙酸丁酯,约为25g。
4.将粗品乙酸丁酯加入精馏装置中,在适当的真空和适当的温度下进行精馏。
收集目标产物,得到85-90%的收率。
实验结果与分析:通过反应方程式可知,乙酸和丁醇可以通过酯化反应合成乙酸丁酯。
在实验中,我们选择了适量的硫酸催化剂,以提高反应速率和产物收率。
反应完成后,通过提取法将硫酸催化剂和废酸分离,得到了粗品乙酸丁酯。
通过热力学原理,我们知道,乙酸丁酯的沸点比较低,可以通过精馏来获得高纯度的乙酸丁酯。
在实验中,我们可以通过适当的真空和温度条件来进行精馏,以提高产物纯度和收率。
本实验通过乙酸和丁醇的酯化反应,成功合成了乙酸丁酯,并通过精馏技术获得了高纯度的乙酸丁酯。
通过实验,我们进一步了解了乙酸丁酯的化学性质及应用,同时也掌握了合成及精制技术,为今后的学习和工作打下基础。


甲酯类化合物的合成方法研究甲酯类化合物是一类广泛应用于化学工业和生物医药领域的有机化合物。
甲酯具有低毒性、挥发性好、溶解性强等特点,被广泛用作溶剂、香料、冷冻剂和精细化学品的原料。
本文将对甲酯类化合物的合成方法进行研究,探讨不同的合成途径和优化方法。
一、酯化反应法酯化反应是制备甲酯类化合物的常用方法之一。
该方法通过酸催化下,醇与酸酐或酰氯反应生成酯。
酯化反应的优势在于反应条件温和、反应速度快、产率高。
常见的酯化反应有酸酐酯化法和酰氯酯化法。
酸酐酯化法适用于含有羧基的酸酐和醇反应的情况。
以乙酸酐和甲醇为例,两者在催化剂存在下,经酯化反应生成甲酸甲酯。
该方法具有高选择性和较好的适应性,可用于合成不同类型的甲酯类化合物。
酰氯酯化法适用于含有酰氯基的酸和醇反应的情况。
以醋酸和氯化亚砜为例,两者在碱催化下,通过酯化反应生成乙酸乙酯。
该方法适用于含有醛基、羧基等不适合进行酯化反应的物质合成。
二、缩醛缩酮法缩醛缩酮法是一种通过醛、酮与醇反应生成甲酯类化合物的方法。
该方法主要包括缩醛反应和缩酮反应两种类型。
以乙醛和甲醇为例,两者在催化剂存在下,经缩醛反应生成乙醇甲酸甲酯。
该方法具有原料易得、产物纯度高的特点,适用于合成高纯度的甲酯类化合物。
缩醛缩酮法的反应条件可以通过优化来提高反应效率和产物纯度。
例如,通过选择合适的溶剂、控制反应温度和反应时间,可以避免副反应的发生,提高产物收率。
三、物理气相转化法物理气相转化法是一种通过气体相反应生成甲酯类化合物的方法。
该方法主要包括脱氢甲硅烷法和脱氧甲硅烷法两种类型。
以甲硅烷和甲醇为例,两者在合适的反应条件下,经物理气相转化反应生成甲醇甲酸甲酯。
该方法具有反应条件温和、操作简单等特点,适用于合成大规模甲酯类化合物。
物理气相转化法的反应效率可以通过调控反应条件和催化剂改善。
例如,适当提高反应温度和增加催化剂的用量,可以加速反应速率,提高产物收率。
综上所述,甲酯类化合物的合成方法包括酯化反应法、缩醛缩酮法和物理气相转化法等多种途径。

化学实验报告——乙酸乙酯的合成乙酸乙酯的合成一、实验目的和要求1、通过乙酸乙酯的制备,加深对酯化反应的理解;2、了解提高可逆反应转化率的实验方法;3、熟练蒸馏、回流、干燥、气相色谱、液态样品折光率测定等技术。
二、实验内容和原理本实验用乙酸与乙醇在少量浓硫酸催化下反应生成乙酸乙酯:243323252H SO CH COOH CH CH OH CH COOC H H O ++副反应:2432322322H SO CH CH OH CH CH OCH CH H O →+由于酯化反应为可逆反应,达到平衡时只有2/3的物料转变为酯。
为了提高酯的产率,通常都让某一原料过量,或采用不断将反应产物酯或水蒸出等措施,使平衡不断向右移动。
因为乙醇便宜、易得,本实验中乙醇过量。
但在工业生产中一般使乙酸过量,以便使乙醇转化完全,避免由于乙醇和水及乙酸乙酯形成二元或三元共沸物给分离带来困难,而乙酸通过洗涤、分液很容易除去。
由于反应中有水生成,而水和过量的乙醇均可与乙酸乙酯形成共沸物,如表一表示。
这些共沸物的沸点都很低,不超过72 ℃,较乙醇的沸点和乙酸的沸点都低,因此很容易被蒸馏出来。
蒸出的粗馏液可用洗涤、分液除去溶于其中的乙酸、乙醇等,然后用干燥剂去除共沸物中的水分,再进行精馏便可以得到纯的乙酸乙酯产品。
表一、乙酸乙酯共沸物的组成与沸点三、主要物料及产物的物理常数表二、主要物料及产物的物理常数四、主要仪器设备仪器100mL三口烧瓶;滴液漏斗;蒸馏弯头;温度计;直形冷凝管;250mL分液漏斗;50mL锥形瓶3个;25mL梨形烧瓶;蒸馏头;阿贝(Abbe)折光仪;气相色谱仪。
试剂冰醋酸;无水乙醇;浓硫酸;Na2CO3饱和溶液;CaCl2饱和溶液;NaCl饱和溶液。
五、实验步骤及现象表三、实验步骤及现象实验装置图:六、实验结果与分析由粗产品洗涤、蒸馏后得三瓶分馏产物,均为无色果香味液体,其质量如下:1. 前馏分(温度稳定以前):43.38g-35.15g(1号锥形瓶质量)=8.13g ; 2. 中馏分(温度稳定在76℃时):39.72g-32.67g(2号锥形瓶质量)=7.05g ; 3. 后馏分(温度迅速下降后):34.28g-31.25g(3号锥形瓶质量)=3.08g 。


乙酸乙酯的制备实验报告_实验报告_一、实验目的1.了解酯化反应的原理和基本操作方法;2.学习苯酚乙酸酯合成乙酸乙酯的基本方法;3.进一步巩固实验操作技能。
二、实验原理酯化反应是有机化学中一类非常重要的反应。
它是一种醇与酸发生缩合反应的化学过程,产生酯和水。
反应只有在酸催化剂的作用下才能进行。
酸催化剂可以是无机化合物中的酸,如硫酸、氢氯酸等,也可以是有机分子中的酸,如三氯乙酸等。
对于醇与羧酸的酯化反应,实验生产中经常用的是硫酸作为催化剂。
在进行酯化反应时,需要注意反应条件的选择。
一般情况下,缩醛反应可以在常温下进行,但是若要得到较好的产率,加热反应速率会变快。
同时,反应中生成的水需要不断地从反应体系中去除,这样反应才能继续进行。
因此,通常添加一些吸水剂,如分子筛等,以帮助反应中水的去除。
本实验采用苯酚(C_6H_5OH)和乙酸酐((CH_3CO)_2O)作为原料,在硫酸催化下进行酯化反应,生成乙酸乙酯(CH_3COOC_2H_5)。
三、实验步骤1.取一定量的苯酚放入容量瓶中,用蒸馏水将其体积调整到一定值;2.将一定量的乙酸酐滴入2~5滴浓硫酸中,与之混合均匀;3.向1中所调整好的苯酚中加入2中产生的混合液滴加,然后放置一段时间进行反应;4.将反应液从容量瓶中倒入连球瓶中,加入30ml的水淘洗,之后取出水份;5.将淘洗后的液体倒入分液漏斗中,去除其中由于乙酸酐过量产生的乙酸;6.对上述液体加入半饱和氯化钠溶液,进行混匀后留置;7.离心分离,取出乙酸乙酯层;8.在干燥的蒸馏烧瓶中,与少量的干燥的钙氧化混合,放入蒸馏水浴中蒸馏,收集所得的乙酸乙酯。
四、实验结果1.计算苯酚和乙酸酐的摩尔量,按1:1比例进行计算,计算出两者的化学计量比;2.实验操作时,苯酚的体积应如何调整,苯酚和乙酸酐的摩尔量应如何搭配,计算出苯酚的摩尔量和所需的乙酸酐摩尔量,根据计算结果进行操作;3.将制得的乙酸乙酯的轻油层用氢氧化钠溶液洗涤去掉杂质即可。

诚信申明本人申明:我所呈交的本科毕业论文是本人在导师指导下对四年专业知识而进行的研究工作及全面的总结。
尽我所知,除了文中特别加以标注和致谢中所罗列的内容以外,论文中创新处不包含其他人已经发表或撰写过的研究成果,也不包含为获得北京化工大学或其它教育机构的学位或证书而已经使用过的材料。
与我一同完成毕业论文的同学对本课题所做的任何贡献均已在文中做了明确的说明并表示了谢意,若有不实之处,本人承担一切相关责任。
本人签名:年月日酯类液晶单体合成方法的工艺研究摘要酯类液晶是近年来广泛应用于高端电子产品的液晶材料。
由于其具有合成方法简单,种类繁多,相变区间较宽,因此在化学工业和电子工业中有着极为重要的应用。
综述了几种合成酯类液晶的方法,酰氯法和DCC催化法由于具有反应条件温和、反应时间较短、产率较高等优点,是目前国内外最常用的两种方法,所以详细讨论了这两种方法在酯类液晶的合成应用。
关键词:酯类液晶合成综述Synthesis of ester liquid crystal monomer process researchqualityAbstractThe esters of the liquid crystal material of the liquid crystal is widely used in recent years, high-end electronic products.Which has a simple synthetic method, variety, and a wide range of phase transition, has a very important applications in the chemical and electronic industries. In this paper, several synthetic ester liquid crystal method, chloride method and DCC catalysis due to the mild reaction conditions, shorter reaction time, higher yield, at home and abroad the two most commonly used method, discussed in detail these two methods in the synthesis of esters LCD.Key words: e ster liquid crystal synthesis summarize目录第1章绪论 (1)第1.1节液晶的简介 (1)第1.2节液晶研究的发展历史 (2)第1.3节液晶的分类 (3)第1.4节液晶的各向异性及性质表征方法 (9)第1.5节国内外液晶现状及技术发展趋势 (11)第1.6节研究的目的与意义 (15)第2章丁基苯甲酸3-氟-4-氰基苯酚酯的合成与表征 (18)第 2.1节实验试剂与溶剂 (18)第2.2节测试表征方法及条件 (19)第2.3节实验部分 (19)第2.4节表征 (21)第2.5节结果与讨论 (25)第2.6节总结 (27)第3章乙基双环己基甲酸丙基双环己基醇酯的合成与表征 (28)第3.1节实验试剂与溶剂 (28)第3.2节测试表征方法及条件 (28)第3.3节实验部分 (29)第3.4节表征 (31)第3.5节结果与讨论 (32)第3.6节总结 (33)结论 (35)参考文献 (36)致谢..................................... 错误!未定义书签。

乙酸乙酯合成的实验报告以下是一份乙酸乙酯合成的实验报告:实验目的:本次实验的目的是通过酯化反应合成乙酸乙酯,了解由醇和羧酸制备羧酸酯的原理和方法,学习液体有机物的蒸馏、洗涤和干燥等基本操作。
实验原理:本次实验的主反应为酯化反应,方程式为 CH3COOHCH3CH2OH→CH3COOC2H5H2O,催化剂为浓硫酸,加热至反应开始。
在反应过程中,乙酸和乙醇反应生成乙酸乙酯,同时还会有乙酸和乙醇的混合物生成。
副反应主要包括CH3CH2COOCH2CH3H2OCH3CH2OHCH3CH2OCH2CH3CH3CH2OH 等。
实验步骤:1. 在 50mL 圆底烧瓶中加入 9.5mL 无水乙醇和 6mL 冰醋酸,再小心加入 2.5mL 浓硫酸,摇匀,投入 1~2 粒沸石,然后装上冷凝管。
2. 以石棉网覆盖电炉为热源,小火加热,保持缓慢回流 0.5h。
3. 待反应瓶冷却后,将回流装置改为蒸馏装置,接受瓶用冷水冷却,加热蒸出生成的乙酸乙酯,直到馏出液体积约为反应物总体积的 1/2 为止。
4. 在馏出液中慢慢加入饱和碳酸钠溶液,不断振荡,直至不再有二氧化碳气体放出。
5. 然后将混合液转入分液漏斗,依次用 5mL 饱和食盐水、5mL 饱和氯化钙溶液和 5mL 水洗涤。
分去水层,有机层用无水硫酸镁干燥。
6. 将干燥好的产物移至小蒸馏瓶中,在石棉网上加热蒸馏,收集 73-78°C 的馏分。
实验结果:在实验中,我们成功地合成了乙酸乙酯,含量约为 5mL。
实验注意事项:1. 在实验过程中,要注意安全,浓硫酸要使用棕色瓶,避免与金属接触。
2. 加热时要控制温度,避免过高或过低,否则可能导致反应不完全或变质。
3. 在蒸出乙酸乙酯时,要不断振荡,避免气体积累导致爆炸。
4. 洗涤粗产物时,要使用饱和溶液,避免溶解出其他组分。
5. 收集产物时,要使用干燥的蒸馏装置,避免水汽凝结导致馏分不准确。

乙酰乙酸乙酯的合成及其波谱分析一、乙酰乙酸乙酯的合成㈠ 实验目的1.了解酯缩合反应制备β-酮酸酯的原理及方法。
2.掌握无水反应的操作要点。
3.掌握蒸馏、减压蒸馏等基本操作。
㈡ 实验原理(半微量实验)含有α-氢的酯在碱性催化剂存在下,能与另一分子的酯发生克莱森酯缩合反应,生成β-酮酸酯,乙酰乙酸乙酯就是通过这个反应来制备的。
本实验是用无水乙酸乙酯和金属钠为原料,以过量的乙酸乙酯为溶剂,通过酯缩合反应制得乙酰乙酸乙酯。
反应机理为,利用乙酸乙酯中含有的少量乙醇与钠作用生成乙醇钠。
↑+→+25252222H ON H C N OH H C a a随着反应的进行不断地生成乙醇,反应就不断地进行,直至钠消耗完。
在乙醇钠作用下,具有α-氢原子的乙酸乙酯自身缩合,生成烯醇型钠盐,再经醋酸酸化即得乙酰乙酸乙酯。
金属钠极易与水反应,并放出氢气和大量热,易导致燃烧和爆炸,故反应所用仪器必须是干燥的,试剂必须是无水的。
㈢ 实验装置乙酰乙酸乙酯合成的实验装置包括反应装置和减压蒸馏装置。
反应装置如图3-1所示,其回流冷凝管上须加干燥管。
减压蒸馏装置图3-2所示。
包括蒸馏、抽气、测压和保护四部分。
蒸馏部分由圆底烧瓶、克氏蒸馏头、冷凝管、接引管和接受器组成。
在克氏蒸馏头带有支管一侧的上口插温度计,另一口则插一根末端拉成毛细管的厚壁玻璃管。
毛细管下端离瓶底约1~2mm ,在减压蒸馏中,毛细管主要起到沸腾中心和搅动作用,防止爆沸,保持沸腾平稳。
在减压蒸馏装置中,接引管一定要带有支管。
该支管与抽气系统连接。
在蒸馏过程中若要收集不同馏分,则可用带支管的多头接引管。
根据馏程范围可转动多头接引管集取不同馏分。
接受器可用圆底烧瓶。
吸滤瓶等耐压容器,但不可用锥形瓶。
实验室里常用的抽气减压设备是水泵或油泵。
水泵常因其结构、水压和水温等因素,不易得到较高的真空度。
油泵可获得较高的真空度,好的油泵可达到13.3Pa 的真空度。
油泵的结构较为精密,如果有挥发性有机溶剂。
实验室制乙酸乙酯
在化学实验室中,制备乙酸乙酯是一个常见的实验项目。
乙酸乙酯,也称为乙二酸乙酯,是一种常用的酯类化合物,具有水果味。
本文将介绍在实验室中制备乙酸乙酯的步骤和反应过程。
材料准备
•乙酸
•乙醇
•硫酸
•水浴锅
•分液漏斗
•玻璃棒
•漏斗
•烧杯
实验步骤
1.在烧杯中取一定量的乙醇,并加入适量的乙酸,混合均匀。
2.将混合溶液转移到有分液漏斗的水浴锅中,加入少量的硫酸作为催化
剂。
3.将水浴锅中的混合溶液进行加热,使其保持在适当的温度下反应,同
时用玻璃棒搅拌。
4.反应完成后,待溶液冷却至室温,然后用分液漏斗分离两相液体,收
集有机相的乙酸乙酯。
反应机理
乙酸乙酯的制备反应为乙醇和乙酸在硫酸的催化下发生酯化反应,具体反应机理为:
CH3CH2OH+CH3COOH→CH3COOCH2CH3+H2O
乙醇和乙酸在硫酸的作用下生成乙酸乙酯和水。
实验注意事项
•在操作过程中需注意安全,避免接触皮肤和呼吸气体,必要时佩戴手套和口罩。
•在反应过程中要控制好温度,不宜加热过高,以免发生危险。
•严格按照操作步骤进行,避免操作失误造成事故发生。
制备乙酸乙酯是一个简单而重要的实验,通过本实验的学习,可以加深对酯类化合物的认识,并掌握实验室中有机化合物合成方法的基本原理。
第1篇一、实验目的1. 了解磷酸酯的结构、性质及其应用。
2. 掌握磷酸酯的合成方法。
3. 探究磷酸酯在不同溶剂中的溶解性。
二、实验原理磷酸酯是一种含有磷酸基团的有机化合物,其结构特点为磷酸基团与有机基团相连。
磷酸酯具有多种性质,如:水解性、亲水性、亲油性等。
磷酸酯的合成方法主要有酯化反应、酰氯法、醇解法等。
本实验采用醇解法合成磷酸酯。
三、实验材料与仪器1. 实验材料:- 磷酸- 有机醇(如甲醇、乙醇、丙醇等)- 醋酸- 醋酸酐- 碱性催化剂(如碳酸钠、氢氧化钠等)- 饱和碳酸钠溶液- 水浴锅- 冷却器- 分液漏斗- 烧杯- 试管- 玻璃棒- 酒精灯- 量筒- 紫外-可见分光光度计2. 实验仪器:- 磷酸酯合成装置- 磷酸酯溶解性测试装置四、实验步骤1. 磷酸酯合成a. 在烧杯中加入一定量的磷酸和醋酸,搅拌均匀。
b. 将烧杯置于水浴锅中加热至50℃。
c. 在另一个烧杯中加入一定量的有机醇和醋酸酐,搅拌均匀。
d. 将有机醇和醋酸酐溶液缓慢滴加到加热的磷酸和醋酸溶液中,边滴加边搅拌。
e. 继续加热反应30分钟。
f. 停止加热,待反应混合物冷却至室温。
g. 将反应混合物倒入分液漏斗中,加入饱和碳酸钠溶液,振荡、静置。
h. 分离出有机层,用无水硫酸钠干燥。
i. 将干燥后的有机层进行蒸馏,收集磷酸酯产品。
2. 磷酸酯溶解性测试a. 将磷酸酯产品溶解于不同溶剂中(如水、乙醇、乙醚等)。
b. 使用紫外-可见分光光度计测定溶液的吸光度。
c. 记录磷酸酯在不同溶剂中的溶解度。
五、实验结果与分析1. 磷酸酯合成通过实验,成功合成了磷酸酯产品,反应过程中观察到溶液逐渐变为深色,说明反应进行良好。
2. 磷酸酯溶解性测试a. 磷酸酯在水中的溶解度为:X1(g/100mL)b. 磷酸酯在乙醇中的溶解度为:X2(g/100mL)c. 磷酸酯在乙醚中的溶解度为:X3(g/100mL)通过实验结果可知,磷酸酯在不同溶剂中的溶解度不同,其中在水中的溶解度最大,在乙醚中的溶解度最小。
资料内容仅供您学习参考,如有不当或者侵权,请联系改正或者删除。
酯的合成方法研究
刘 聪
东北大学理学院高分子化学与物理
羧酸酯是一类重要的化工原料 ,它的用途相当广泛 ,可用作香料、 溶剂、
增塑剂及有机合成的中间体; 同时在涂料、 医药等工业中也具有重要的使用价
值[1]。作为液晶化合物最基本和最重要的中心桥键之一, 酯基的合成具有十分重
要的意义。在过去很长一段时间里, 酯的合成主要是采用一些经典的方法, 如酸
催化、 酰氯法、 酯交化法等; 随着对各种新的催化剂和有机反应机理的研究,
出现了一些新颖的合成方法, 如Mitsunobu反应、 Steglich酯化法、 CAN催化
法、 Me3SiCl催化法、 DBU催化法等等[2]。对这些新的合成方法进行研究, 有助
于在实验室推广采用更简单、 更有效、 更温和的方法合成羧酸酯, 并进一步实
用于工业化生产。
一、经典酯化反应
1、酯化反应机理:
羧酸与醇在催化剂作用下生成酯。例如:
CH3COOH + HOC2H5
CH3COOC2H5 + H2O
H
酯化反应是可逆反应。为了提高酯的产率, 可采取使一种原料过量(应从易
得、
价廉、 易回收等方面考虑), 或反应过程中除去一种产物(如水或酯)。工业上生
产乙酸乙酯采用乙酸过量, 不断蒸出生成的乙酸乙酯和水的恒沸混合物(水
6.1%, 乙酸乙酯93.9%, 恒沸点70.4℃), 使平衡右移。同时不断加入乙酸和乙
醇, 实现连续化生产[3]。
羧酸的酯化反应随着羧酸和醇的结构以及反应条件的不同, 能够按照不同
的机理进行。酯化时, 羧酸和醇之间脱水能够有两种不同的方式:
RCOOH HOR'RCOH HOOR'
资料内容仅供您学习参考,如有不当或者侵权,请联系改正或者删除。
R, R’分别是烷基。(Ⅰ)是由羧酸中的羟基和醇中的氢结合成水分子, 剩余
部分结合成酯。由于羧酸分子去掉羟基后剩余的是酰基, 故方式(Ⅰ)称为酰氧键
断裂。(Ⅱ)是由羧酸中的氢和醇中的羟基结合成水, 剩余部分结合成酯。由于醇
去掉羟基后剩下烷基, 故方式(Ⅱ)称为烷氧键断裂。
当用含有标记氧原子的醇(R18OH)在酸催化作用下与羧酸进行酯化反应时,
发现生成的水分子中不含18O, 标记氧原子保留在酯中, 这说明酸催化酯化反应
是按方式(Ⅰ)进行的。其反应机理能够表示如下:
RCOOHHRCOHOHRCOHOH
RCOHOH
OH
R'
R'OH
RCOHOH
2
R'O
-H2O
RC
OH
R'O
RCOHR'ORCOOR'
-H
这个机理能够概括如下:
RCOOHR'OH+-HRCOHOH
R'O
RCOOR' H2O
+
叔醇的酯化反应经实验证明是按方式(Ⅱ)进行的:
RCOOH+HOCR'
3
RCOOCR'
3
+
H2O
2、质子酸催化合成酯
在传统的酯化反应中一般采用浓硫酸作催化剂, 这是由于浓硫酸价格低廉,
催化活性高, 易于工业化、 连续化生产; 但浓硫酸易使有机物炭化、 氧化, 且
选择性差, 在二级醇和三级醇的酯化反应中产率低, 副反应多, 工艺流程长,
对设备腐蚀严重, 三废处理麻烦。另外, 干燥的氯化氢、 对甲苯磺酸作为催化
剂也被运用到酯的催化合成中[4]。如水杨酸甲酸的合成[5]:
(Ⅰ) (Ⅱ
资料内容仅供您学习参考,如有不当或者侵权,请联系改正或者删除。
OHCOOH+CH3OHH2SO4OH
COOCH
3
+H2O
由于浓硫酸作为催化剂存在许多缺点, 自1981年黄化民等报道用无机硫酸
盐作催化剂以来, 不少研究者对催化剂进行了许多研究和报道[1],开发出了一类
新型酯化反应催化剂 —固体酸型催化剂, 它具有以下优点: 催化剂易分离和回
收 ,不怕水, 易再生可重复使用, 它包括无机盐超强酸、 分子筛、 杂多酸、 氧
化物、 高分子载体催化剂等。
3、酰氯酯化法
酰氯酯化法是合成羧酸酯应用最多的方法之一。该方法主要是先将有机酸转
变为酰氯, 酰氯再醇解得到相应的酯。酰化试剂有新制的二氯亚砜( SOCl2) 、
草酰氯(C2O2Cl2)、 光气(COCl2)等。在实验室中, 比较常见的是采用SOCl2作为
酰化试剂。SOCl2酰氯酯法的优点是生成酰氯时的副产物是HCl和SO2, 均为气体,
有利于分离, 且酰氯的产率较高, 这将提高下一步反应的活性和产率。其缺点是
制备酰氯时需对反应条件进行较严格的控制, 如时间、 温度等, 不易除尽过量
的SOCl2, 对设备的腐蚀较严重; 而且酰氯需要现制现用, 整体合成路线长[6]。
酰化和醇解过程中都生成大量氯化氢, 因此在反应中加入氯化氢的去除剂,
称为缚酸剂, 如吡啶、 三乙胺(TEA)、 DMAP、 N,N’-二甲苯胺等。酰氯遇水易
发生分解, 因此反应必须在无水条件下完成。
如10-十一烯酸(a)是合成不饱和酸胆甾醇酯常见的原料。李佩瑾等[7]以
SOCl2为酰化试剂, N,N’-二甲苯胺作为醇解反应的缚酸剂, 75℃下回流8 h得
到了10-十一烯酸胆甾醇酯(b)。(b)是一种介晶单体, 可与非介晶手性单体十一
烯酸薄荷醇酯经过接枝共聚引入聚甲基含氢硅氧烷中, 得到具有光化学活性的
胆甾相液晶聚合物[8]。
资料内容仅供您学习参考,如有不当或者侵权,请联系改正或者删除。
CH2=CH(CH2)8COCl+ HO
Chol
*
CH2=CH(CH2)8COO
Chol
*
(a)
(b)
CH2=CH(CH2)8COOH SOCl
2
CH2=CH(CH2)8COCl
+
4、酸酐酯化法
该方法一般用于双羧酸官能团物质与单羟基的醇或酚反应, 制得单羧酸酯,
且保留一个羧酸, 可进一步酯化或酰胺化。但由于酸酐化合物种类较少, 限制了
它的更进一步应用。
利用酸酐的反应特点, 引入带羧酸官能团的柔性链, 在合成氢键自组装超
分子聚合体中具有特殊的应用。如沈永涛等[9] 以胆甾醇和丁二酸酐为原料合成
了丁二酸单胆甾醇酯(AC), 研究探讨了AC自组装液晶特性。
O
O
O
+
HO
HOOCCH2CH2COO
(AC)
5、低级酯交换法
酯交换反应的实质是酯的醇解。将羧酸与低级醇(如甲醇或乙醇)制备成低级
酯(如甲酯或乙酯), 然后与高级醇在酸性条件下进行醇解。该方法在某些特殊的
反应中有着独特的作用, 如羧酸的保护与脱保护。但由于该法合成路线较长, 成
本较高, 使得其应用范围较小。在手性中心的合成中, 需进行羧酸的保护, 设想
了下列方案:
资料内容仅供您学习参考,如有不当或者侵权,请联系改正或者删除。
OH
*
*
*
OCH2CH2COOCH
3
*
*
*
H2SO
4
ClCH2CH2COOH
+CH3OHClCH2CH2COOCH
3
(1) Na/甲苯
ClCH2CH2COOCH
3
(2)
OCH2CH2COOCH
3
*
*
*
HOCOOH
+
OCH2CH2COO
*
*
*
COOH
在该反应中, 设想对羟基苯甲酸既作为反应物, 又提供质子, 促进反应的
发生(该方案第三步未验证)。
二、酯的合成新方法
1、Mitsunobu反应
官能团的转化在有机合成化学中占了极其重要的地位, 我们在合成中经常
需要进行官能团转化, 构建新的化学键, 如 C—O, C—N, C—S, C—C等化学键。
而Mitsunobu反应[9]是在偶氮二碳酸二乙酯(DEAD)或者偶氮二碳酸二异丙酯
(DIAD)和三苯基膦作用下, 醇类化合物和酸性化合物发生分子内或分子间脱水
反应, 形成C—O, C—N, C—S, C—C等键的反应。它最早是在1967年由
Mitsunobu 等[10]发现。Mitsunobu 反应一般是在温和的中性条件下进行的, 同时,
如果是手性醇参加反应, 醇羟基所连碳原子的绝对构型一般会发生翻转, 因此,
Mitsunobu反应广泛应用于各类天然产物的全合成或化合物的官能团转化, 是
一个应用范围较为广泛的反应。在这里我们仅仅把它作为一种羧酸缩合成酯的方
法进行介绍。
ROOH+R'OHDEAD or DIADPh3PROOR'