小鼠实验胚胎技术知识分享
- 格式:ppt
- 大小:6.21 MB
- 文档页数:55

小鼠胚胎早期发育过程中OCT4作用的研究进展引言小鼠胚胎早期发育是一个复杂的过程,其中涉及到许多基因的调控和表达。
其中一个关键基因是OCT4,是一种转录因子,对于胚胎干细胞的自我更新和分化具有重要作用。
在过去的几十年里,科学家们对OCT4在小鼠胚胎早期发育中的作用展开了大量研究,取得了一系列重要的进展。
本文将综述这些研究成果,探讨OCT4在小鼠胚胎早期发育过程中的作用及其潜在机制。
OCT4的功能和表达调控OCT4是一个关键的转录因子,它在胚胎干细胞中的作用被广泛研究。
OCT4对于维持胚胎干细胞的干性、自我更新和多能性具有重要作用。
在小鼠早期胚胎发育中,OCT4的表达模式也备受关注。
研究显示,OCT4在小鼠受精卵后期的囊胚阶段开始表达,并且在早期内细胞(ICM)中高度表达。
随着胚胎发育的进展,OCT4的表达范围逐渐限制在胚胎内细胞中,而在外细胞中逐渐减少。
这种表达模式的调控与胚胎干细胞的定向分化密切相关。
OCT4调控基因表达的机制OCT4通过调控多个基因的表达来维持胚胎干细胞的干性和多能性。
在早期的研究中发现,OCT4可以与其他转录因子(如SOX2、NANOG等)形成复合物,共同调控多个靶基因的表达。
近期的研究进展显示,OCT4还可以通过与表观遗传修饰因子相互作用,影响染色质结构和可及性,从而调控基因的表达。
OCT4还可以通过miRNA的调控网络影响胚胎干细胞的功能。
这些新的研究成果为我们深入理解OCT4的作用机制提供了新的思路。
OCT4在转基因技术中的应用随着对OCT4功能的深入研究,人们发现OCT4在胚胎干细胞和再生医学领域具有广阔的应用前景。
利用OCT4转基因技术可以实现胚胎干细胞的高效自我更新和多能性维持,并且为再生医学提供了丰富的细胞来源。
OCT4还可以通过调控其下游的基因网络,促进器官再生和损伤修复。
OCT4在转基因技术中的应用潜力巨大,将为再生医学领域带来革命性的进展。
结论OCT4在小鼠胚胎早期发育过程中发挥着重要作用。

《动物胚胎工程实验教程》王子玉自编南京农业大学动科院2005年8月实验一小鼠卵母细胞的体外成熟实验一、实验目的熟悉雌鼠的生殖器官的结构特点;掌握小鼠的超数排卵方案;掌握从卵巢上扎取未成熟卵母细胞的方法、卵母细胞的分类方法、体外成熟培养方法及核成熟情况和卵丘扩展程度的观察。
二、实验器材和材料1. 器材及药品体视显微镜,手术器械(眼科剪,眼科镊),1mL注射器,胶头滴管,口吸管,CO2培养箱,水浴锅,移液器,枪头,塑料培养皿,记号笔。
操作液(M2),成熟培养液(M-199),激素(PMSG和HCG),石蜡油。
2.实验动物:3-4周龄昆明系雌性小白鼠,自由采食饮水。
三、实验内容1.小鼠的超数排卵注射剂量皮下或腹腔注射PMSG 10 IU/只小鼠。
注射方法皮下注射:用手指捏住小鼠的头及尾部固定(图1-1),以酒精棉球消毒其背部,提起皮肤,将注射针头平插刺入皮下,将针头微向上挑起不露出针尖时,再注入药物。
随着药物的推入,在皮下可看到鼓起一个小泡,即证实药物确已注入皮下部位。
皮下注射时防止药液从针孔处逸出。
腹腔注射:针头刚进入腹腔后向上挑,防止损伤小鼠腹腔内器官。
注射针头宜选用小号细针头。
注射药物后的小鼠自由饮水、采饲,自然光照。
2.卵巢的采集方法在注射PMSG后46h利用颈椎脱臼法处死小鼠(将供体鼠置于饲养笼上,鼠爪自然抓紧笼上铁支架,此时一只手拉紧鼠尾,另一只手食指与拇指压紧鼠颈部,或用镊子压紧颈部即可致死,此为引颈法。
用75%酒精喷湿鼠全身以消毒并防止毛发飞扬)。
将小鼠头部固定,用力牵拉鼠尾,可感到颈椎部位脱臼的振动;也可用食指和拇指直接掐断颈椎致死。
然后用图钉将小鼠呈仰卧姿势固定于小木板上或鼠解剖台上。
图1-1 小鼠的固定将处死并固定好的小鼠,在下腹部中间剪开1个小口,一只手抓住鼠尾,另一只手抓住切开的皮肤向头部牵拉直至充分暴露腹部(图1-2)。
剪开腹膜,向前方揭去肠胃内脏,即暴露出生殖器官,可在肾脏后方看到两侧呈乳白色的卵巢及与输尿管相平行的两子宫角(图1-3)。
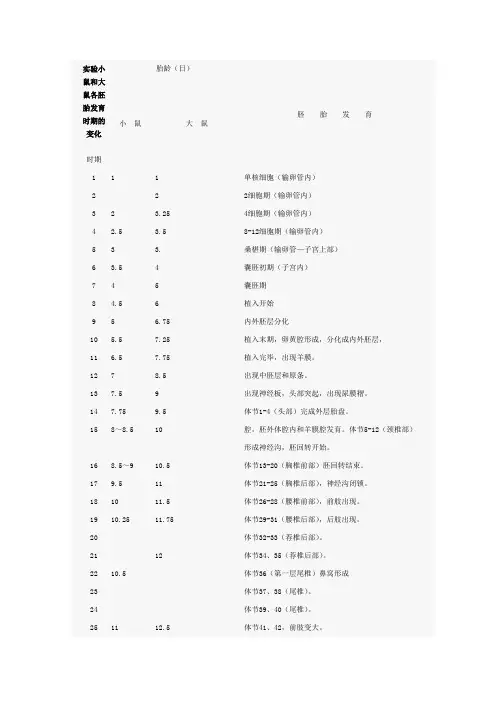
实验小鼠和大鼠各胚胎发育时期的变化时期胎龄(日)胚胎发育小鼠大鼠1 1 1 单核细胞(输卵管内)2 2 2细胞期(输卵管内)3 2 3.25 4细胞期(输卵管内)4 2.5 3.5 8-12细胞期(输卵管内)5 3 3. 桑椹期(输卵管—子宫上部)6 3.5 4 囊胚初期(子宫内)7 4 5 囊胚期8 4.5 6 植入开始9 5 6.75 内外胚层分化10 5.5 7.25 植入末期,卵黄腔形成,分化成内外胚层,11 6.5 7.75 植入完毕,出现羊膜。
12 7 8.5 出现中胚层和原条。
13 7.5 9 出现神经板,头部突起,出现尿膜褶。
14 7.75 9.5 体节1-4(头部)完成外层胎盘。
15 8~8.5 10 腔,胚外体腔内和羊膜腔发育。
体节5-12(颈椎部)形成神经沟,胚回转开始。
16 8.5~9 10.5 体节13-20(胸椎前部)胚回转结束。
17 9.5 11 体节21-25(胸椎后部),神经沟闭锁。
18 10 11.5 体节26-28(腰椎前部),前肢出现。
19 10.25 11.75 体节29-31(腰椎后部),后肢出现。
20 体节32-33(荐椎后部)。
21 12 体节34、35(荐椎后部)。
22 10.5 体节36(第一层尾椎)鼻窝形成23 体节37、38(尾椎)。
24 体节39、40(尾椎)。
25 11 12.5 体节41、42,前肢变大。
26 体节43-45(尾椎)手指分化。
27 12 13 体节46-48(尾椎)脐疝明显。
28 12.5 13.5 体节49-51(尾椎),鼻上颌闭锁。
29 14 体节52-55(尾椎)。
30 13 14.5 体节56-60(尾椎),耳孔开,耳壳形成31 13.5~14 15 体节61-63(尾椎),口盖板闭锁32 14.5 15.5 体节64(尾椎)、体表出现毛囊。
33 15 16 体节65(最终尾椎)34 16-16.5 17-18 脐疝消失,眼脸、耳壳闭锁。

动物胚胎培育技术的操作指南随着科学技术的不断发展,动物胚胎培育技术在畜牧业和生物医学领域扮演着重要的角色。
胚胎培育技术可以帮助我们研究生殖生物学、改良家畜品种,甚至是克隆动物。
在这篇文章中,我们将介绍动物胚胎培育技术的操作指南,以帮助读者更好地理解和掌握这一技术。
胚胎培育技术主要包括体外受精(IVF)和胚胎移植两个步骤。
在体外受精阶段,首先需要从母体动物中收集卵子和精子。
对于较大的动物,如牛、猪和马,可以通过超声波引导下的卵巢穿刺采集卵子。
对于较小的动物,如小鼠或小鸟,可以通过解剖手术或通过特殊仪器采集卵子。
精子可以通过自然排出或通过人工方式采集。
采集到卵子和精子后,需要进行体外受精。
首先,将卵子和精子放入含有适当培养液的离心管中。
然后,通过离心或通过特殊仪器的帮助,使卵子和精子接触,促进受精的发生。
接下来,将受精卵转移到培养皿中,并将其置于恒温灭菌的培养箱中。
培养皿中的培养液需要定期更换,以提供所需的营养物质和生长因子。
胚胎培养的下一步是胚胎移植。
胚胎移植是将成熟的胚胎植入到母体动物的子宫内,使其继续发育。
在进行胚胎移植前,需要将母体动物的子宫内膜准备好,以提供适宜的环境供胚胎着床。
这可以通过激素治疗或手术操作来实现。
在胚胎移植过程中,需要将培养的胚胎转移到母体动物的子宫内。
这可以通过经阴道插管或腹腔手术来完成。
移植后,需要密切观察胚胎在母体内的发育情况。
一些胚胎可能无法成功着床或在早期发展阶段产生问题,这是正常现象。
但一旦胚胎着床成功并进一步发育,将会带来新生仔动物。
动物胚胎培育技术的操作需要具备一定的专业知识和技能。
操作时,需要注意保持手术场所的清洁和无菌,以避免感染。
培养液的配制和保存也需要严格按照制定的方案进行。
此外,在胚胎移植过程中,要小心处理胚胎,以防止对其造成损伤。
动物胚胎培育技术的应用十分广泛。
不仅可以帮助畜牧业提高品种质量和数量,还可以为生物医学领域提供重要的研究工具和资源。

小鼠早期胚胎发育的研究(实验方案)基础生物学课程设计所在学院生物科学与工程学院专业班级生物科学学生姓名学生学号指导教师XXXX年XX月XX日小鼠早期胚胎发育的研究一、引言胚胎发育一词通常是指从受精卵起到胚胎出离卵膜的一段过程。
而无脊椎动物胚胎学家则常把其概念扩展到胎后发育直到性成熟,甚至整个生活史。
动物胚胎的发育过程虽然动物的种类繁多,但是胚胎的发育依然拥有相似的过程,能够分成受精、卵裂、桑葚胚、囊胚、原肠胚与器官形成等阶段。
此外脊椎动物的胚胎发育过程中,各种动物共同拥有的特征会首先出现(如皮肤),之后才逐渐发展出特化的构造(如鱼鳞),而且较复杂的物种与较原始的物种之间一开始相当类似,之后才随着发育的时间而慢慢增加变异。
受精:卵子和精子融合为一个合子的过程。
它是有性生殖的基本特征,普遍存在于动植物界,卵裂:精子与卵子结合之后会形成受精卵,由于卵黄的分布具有不对称的特性,因此受精卵可以分为动物极(会发展成外胚层)和植物极(会发展成中胚层与内胚层)。
在卵裂时期,卵子会先分裂成两个细胞,之后细胞通常会逐次倍增,但是对哺乳类而言,有时候会有不同时分裂并造成只有奇数个细胞的现象。
在这个阶段,胚胎的总体积大致不变。
不同的物种具有不同的卵裂方式,可以分为完全卵裂(holoblastic cleavege)和不完全卵裂(meroblastic cleavage),分别又可以细分成许多不同方式。
如无脊椎动物的辐射卵裂与螺旋卵裂、哺乳动物的旋转式分裂等。
原肠胚:当细胞分裂成为囊胚之后,会经过一段称为原肠形成的型态发生过程,之后形成原肠胚。
原肠形成过程有许多不同方式,能够大致分成5种:内陷式(Invagination)、衰退式(Involution)、进入式(Ingression)、脱层式(Delamination)、包覆式(Epiboly),动物的胚胎利用这5种方式形成了外胚层、中胚层与内胚层的组合,而这三种胚层在之后会形成各种细胞。

鼠胚试验标准1.试验目的和原理鼠胚试验是一种用于研究哺乳动物胚胎发育和评估环境因素对胚胎发育影响的实验方法。
该试验旨在评估受试物质对胚胎的毒性、致畸作用以及胚胎生长发育的影响。
通过该试验,可以了解受试物质对胚胎的损害程度,为安全性评估和风险评估提供依据。
2.试验动物和胚胎选择鼠胚试验通常使用大鼠和小鼠作为试验动物,因为它们的生殖系统、胚胎发育和生理特征与人类较为接近。
在选择试验动物时,应选择健康、品系明确、年龄和体重适宜的动物。
胚胎选择应遵循随机原则,确保不同受试物质处理下的胚胎具有可比性。
一般选择妊娠早期(如妊娠第1-3天)的胚胎进行试验。
3.胚胎培养条件胚胎培养条件对胚胎的生长发育和形态结构具有重要影响。
在鼠胚试验中,胚胎培养条件应尽可能模拟母体子宫内的环境,包括温度、湿度、氧气和二氧化碳浓度等。
同时,还应根据试验目的和要求,设置适当的培养基和营养物质,以保证胚胎的正常发育。
4.胚胎操作及干预措施在鼠胚试验中,需要进行一系列的胚胎操作,包括胚胎收集、培养、处理、观察和记录等。
这些操作应根据试验方案和操作规范进行,确保实验结果的准确性和可重复性。
根据试验目的和要求,可以对胚胎进行不同的干预措施,如受试物质处理、基因转染、药物干预等。
这些干预措施应根据前期研究和实验条件进行设计和实施,以确保其对胚胎发育的影响具有科学性和可控性。
5.胚胎形态学评估对胚胎进行形态学评估是鼠胚试验的重要环节之一。
通过对胚胎的外观、结构、器官发育等进行观察和评估,可以了解受试物质对胚胎的毒性作用和致畸作用。
形态学评估应遵循标准化程序,包括观察时间、拍照记录、测量指标等。
同时,应使用专业软件进行分析和评估,以提高评估结果的准确性和客观性。
6.分子生物学和生物化学评估除了形态学评估外,鼠胚试验还可以结合分子生物学和生物化学方法进行深入分析。
通过对胚胎细胞的基因表达、蛋白质合成、细胞凋亡等方面进行检测,可以更准确地了解受试物质对胚胎的生物学效应。

雌性昆明白小鼠(合肥安徽医科大学实验动物中心), 4-5周龄。
饲养温度24±2 ℃, 光照时间14 h (8:00–22:00), 自由采食, 饮水。
适应3周后, 选取体重30±2 g的小鼠备用。
当天17:00腹腔注射10 IU PMSG,48h后腹腔注射10 IU hCG。
将注射过hCG的雌鼠不与雄鼠合笼,15h后直接扎破壶腹部获取MII期卵子。
超排处理过的雌鼠按照1:1与成年健康的雄鼠合笼(假定受精时间是当晚12:00)。
次日早上8:00检查阴道见栓情况,若见栓则假定该雌鼠受精。
A.体内组采用体内冲胚法分别在胚胎发育不同时期在输卵管和子宫的不同部位收集
受精卵、2-细胞、4-细胞、8-细胞、桑葚胚、囊胚各期胚胎(在腹腔注射hCG后
22、41、60、67、76、101 h在输卵管的不同部位收集受精卵、2-细胞胚胎、4-细
胞胚胎、8-细胞胚胎、桑葚胚、囊胚)。
B.体外培养组在合笼见栓后, 在腹腔注射hCG后22h直接扎破壶腹部获取受精卵,取
出受精卵,用无糖CZB培养液清洗后,转移至无糖CZB培养液中,37℃,5% CO2的培
养箱中进行培养。
56 h后, 4-细胞胚胎转移至有糖CZB培养液中,37℃,5% CO2的培
养箱中进行培养,收集体外2-细胞、4-细胞、8-细胞、桑葚胚、囊胚(在腹腔注射
hCG后22、41、63、71、77、101 h体外直接收集)。

小鼠胚胎干细胞培养实验步骤以下是小鼠胚胎干细胞的培养实验步骤:1.准备培养基和细胞培养器材:-将培养基预热至37摄氏度。
-准备含有培养基的无菌试管、离心管和细胞培养板。
-洗手并戴上合适的培养操作手套。
2.预处理培养皿:-用无菌PBS(磷酸盐缓冲液)将细胞培养板彻底洗涤,去除残留的培养基和细胞残留物。
-用0.1%胰蛋白酶溶液或0.25%胰蛋白酶-EDTA溶液将细胞培养板上的细胞进行脱落。
-将细胞均匀地分布在预处理的培养皿中,使其形成单层细胞。
3.检查细胞数目和品质:-用显微镜检查细胞的形态和活力。
-用细胞计数计算细胞的数目。
-计算细胞的分裂倍增时间。
4.细胞传代:-按照需要的细胞密度将细胞从一个培养皿转移到另一个培养皿。
-用0.05%胰蛋白酶-EDTA将细胞从培养皿上脱落。
-投入适当比例的培养基到新的培养皿中,使其形成单层细胞。
5.制备小鼠胚胎纤维母细胞:-从小鼠胚胎体内收集纤维母细胞。
- 将纤维母细胞转移到含有DMEM(Dulbecco's Modified Eagle Medium)和10%胎牛血清的细胞培养皿中。
-培养纤维母细胞在37摄氏度、5%二氧化碳的培养箱中直至细胞接触起离皿表面。
6.制备和维持小鼠胚胎干细胞:-转接分裂期的小鼠胚胎干细胞到新的培养皿中。
-用无菌吸管或离心管的尖端轻轻挑取细胞克隆。
-将细胞克隆转移到含有mESC培养基(如DMEM、15%胎牛血清、2mML-谷氨酰胺和1×LIF(小鼠白细胞介素-6)的细胞培养板中。
-在体外细胞培养中维持小鼠胚胎干细胞的自我更新和增殖。
7.细胞培养的常规维护:-定期更换新鲜的培养基。
-检查细胞的形态和活力。
-定期传代细胞,以保持其细胞数目和活力。
-控制培养基和细胞的污染。
以上是小鼠胚胎干细胞培养的一般步骤,实验过程可能因研究目的和实验室的要求而有所不同。
为了保证实验的准确性和可重复性,建议在实验过程中随时记录和保留实验数据,并使用正确的实验操作和生物安全规范。

第1篇一、实验目的1. 了解动物组织胚胎学的基本概念和实验技术。
2. 掌握动物细胞和胚胎的基本结构及其发育过程。
3. 学习显微镜操作技术,观察细胞和胚胎的结构特征。
二、实验原理动物组织胚胎学是研究动物机体的微观形态结构、生理机能及其发生、发展规律的科学。
通过观察动物细胞和胚胎的结构,了解其生长发育过程,为后续相关课程的学习打下基础。
三、实验材料与仪器1. 实验材料:小白鼠胚胎、小白鼠肝组织、小白鼠肾组织、小白鼠皮肤组织。
2. 仪器设备:显微镜、切片机、切片架、载玻片、盖玻片、酒精灯、火柴、解剖刀、镊子、剪刀、滴管、显微镜载物台、显微镜光源等。
四、实验步骤1. 小白鼠胚胎观察- 将小白鼠胚胎放入解剖盘中,用解剖刀小心切开,取出胚胎。
- 将胚胎放入装有生理盐水的培养皿中,用解剖针轻轻拨开胚胎,观察其外部形态。
- 将胚胎放入载玻片中,盖上盖玻片,置于显微镜下观察胚胎的结构,如卵黄囊、胚盘、滋养层等。
2. 小白鼠肝组织观察- 将小白鼠肝组织取出,放入生理盐水中,用解剖刀切成薄片。
- 将肝组织薄片放入载玻片中,盖上盖玻片,置于显微镜下观察肝组织的结构,如肝小叶、中央静脉、肝细胞等。
3. 小白鼠肾组织观察- 将小白鼠肾组织取出,放入生理盐水中,用解剖刀切成薄片。
- 将肾组织薄片放入载玻片中,盖上盖玻片,置于显微镜下观察肾组织的结构,如肾小球、肾小管、肾小球囊等。
4. 小白鼠皮肤组织观察- 将小白鼠皮肤组织取出,放入生理盐水中,用解剖刀切成薄片。
- 将皮肤组织薄片放入载玻片中,盖上盖玻片,置于显微镜下观察皮肤组织的结构,如表皮、真皮、毛囊、汗腺等。
五、实验结果与分析1. 小白鼠胚胎观察- 胚胎呈椭圆形,卵黄囊位于胚胎一端,胚盘位于胚胎的另一端,滋养层位于胚盘周围。
2. 小白鼠肝组织观察- 肝小叶呈三角形,中央静脉位于肝小叶中央,肝细胞呈多边形,排列整齐。
3. 小白鼠肾组织观察- 肾小球呈圆形,肾小球囊包裹着肾小球,肾小管呈细长管状,与肾小球相连。

小鼠胚胎干细胞培养实验具体步骤及方法胚胎干细胞在体内外可以分化为各种类型的细胞。
我们的体外分化方法有利于神经前体细胞通过在最少量的培养基内选择(第3步),在有bFGF存在的情况下扩增(第4步)并最终分化在第5步。
细胞全程培养在37℃,5%CO2,100%湿度条件下。
一般体外诱导向神经细胞方向分化,也可以采用低浓度的RA进行诱导。
具体步骤一、ES培养基在LIF存在的条件下维持细胞培养。
二、EB培养基使用细菌培养皿去除LIF后胚状体的形成需要4天。
1. 分散纯化细胞(参见上面的细胞传代部分)。
2. 纯化2小时后将细胞转入含有ES培养基的50 ml Falcon管中,计数细胞取适量体积放入15 ml管中离心3分钟。
3. 用2mlEB培养基重悬细胞,吹打至少10次制成单细胞悬液4. 一个15 cm的细菌培养皿接种4~5x106个细胞(1个完全融合的组织培养皿通常足以接种4个同样规格的细菌培养皿)。
5. 2天后更换培养基,将胚状体转入锥形管中放置3~5分钟使细胞沉降。
弃去上清,将细胞重悬于新鲜培养基并接种在新的细菌培养皿中。
6. 用EB培养基培养的第4天将细胞转入没有包被的组织培养皿中(这即是细胞的移植步骤)。
1个组织培养皿之中放置1个细菌培养皿,在进行第3步之前一天将胚状体黏附在同样规格的培养板上。
7. 形成胚状体需要4天时间。
在EB培养基中再培养1天使胚状体粘附在组织培养皿的表面。
这一天被认为是第2步和第3步的分界。
三、ITSFn培养基在最少量培养基中选择神经前体细胞1. 胚状体接种在组织培养皿一天后将培养基换成ITSFn培养基。
2. 并非所有胚状体在这一时期都已经发生粘附,因此在移除培养基时要小心谨慎以使大部分胚状体留在培养皿内。
3. 保持细胞在ITSFn中培养大约10天,根据需要更换培养基--大约每隔一天。
4. 观察细胞形态,神经样细胞大约出现在第4到第7天。
当神经样细胞能够被鉴别时,转入到第4步。

小鼠解剖取胚胎步骤
小鼠解剖取胚胎的步骤如下:
1. 抓取小鼠,右手抓住小鼠尾巴,左手从小鼠身体后部向前抓,抓住小鼠颈部。
固定住小鼠后,将小鼠皮肤往上抓,尽可能将小鼠背部皮肤抓住。
左手将小鼠腹部朝向自己,把小鼠尾巴用左手无名指和小指夹住,这时小鼠腹部皮肤紧绷,不能动弹。
2. 利用固定器进行固定。
将固定器拧开后,抓住小鼠尾巴,使其钻入固定器中,再将拧下的固定器部分装好,使小鼠尾部露出,再将可旋转的铁片固定住即可进行后续实验。
3. 于隔膜附近的腹中线位置横向撕开皮肤,向两侧翻开皮肤,显露未接触的腹壁。
4. 用无菌剪刀沿腹中线纵行剖开,显露腹腔脏器,此时可见充满胚胎的子宫位于后腹腔。
5. 解剖孕鼠取出小鼠胚胎。
6. 将未处理的子宫移入培养室,转入新的培养皿中,内含无菌的DBSS。
7. 分离胚胎。
小鼠胚胎成纤维细胞的原代培养一、实验材料1.主要仪器设备倒置显微镜、培养箱、离心机、25ml玻璃培养瓶、吸管;10ml尖底离心管、Ф80mm玻璃培养皿、青霉素小瓶、小鼠用解剖器械(包括眼科剪和眼科镊)2.试剂RPMI 1640培养液、平衡缓冲生理盐水(PBS, pH7.2-7.4)、0.25%胰蛋白酶3.实验动物孕14~15天(E14~16)昆白母鼠,领自福建医科大学实验动物中心。
二、实验步骤1. 获取小鼠胚胎(1) 取孕14~15天的母鼠,断颈处死,置于蜡盘上(2) 75%酒精消毒后,用剪刀和镊子剪开下腹皮肤,用两把弯头止血钳夹住切口处的皮肤向头尾两侧牵拉即剥皮,用眼科弯镊和眼科弯剪打开腹腔,暴露出子宫。
(3) 用眼科弯镊夹住一侧子宫,分离子宫系膜,眼科弯剪剪断子宫角和子宫颈,将整个子宫分离下来(注意勿使子宫滑落到腹腔外,避免污染)。
将子宫置于无菌滤纸上去除血迹。
(4) 在超净台内将子宫移入预先盛有PBS的培养皿中,洗涤数次。
(5) 将子宫移入另一盛有PBS的培养皿中,用眼科弯剪沿子宫系膜打开子宫,取出带有胎膜的胎鼠,并用两把眼科镊子剔除胎膜,取出胎鼠(一般有12只)。
(6) 将胎鼠移入另一盛有PBS的培养皿中,用眼科剪和眼科镊去除胎鼠的头、四肢和内脏,得鼠胚躯干。
(7) 将鼠胚躯干移至另一盛有PBS的培养皿中,用PBS洗涤两次至无肉眼可见的血色。
2. 小鼠胚胎成纤维细胞的原代培养(组织块半消化法)(1) 将干净的鼠胚躯干移至青霉素小瓶内(每6个鼠胚躯干装1瓶),用眼科直剪剪成约1 mm3以下的碎块。
(2) 用5ml的刻度吸管每瓶加入约3ml的PBS,混匀后连同鼠胚碎块一起移至一尖底离心管中。
(3) 室温下静置5min,用刻度吸管吸去上清液,留下鼠胚组织碎块。
(4) 向装有鼠胚碎块的离心管内加入1ml 0.25%胰蛋白酶消化液,轻轻吹吸30秒(可见组织块变得较为粘稠)。
(5) 加入1 ml 1640培养液终止消化,室温下静置5min,吸去上清液,留下鼠胚组织碎块沉淀。
小鼠发育生物学实验内容实验一:小鼠卵母细胞和精子的形态观察一、实验目的:掌握胚胎体外操作工具的制备、小鼠超数排卵方法以及小鼠精子和不同发育阶段观卵母细胞的收集方法,观察精子结构和运动状态,评估精子活力,观察卵母细胞结构,了解体外授精操作过程。
二、操作过程:1 胚胎体外操作工具制备在酒精喷灯上将玻璃管拉成直径1mm的细管,连上乳胶管即可。
2 小鼠的抓去与保定3 收集精子断颈处死公鼠,打开腹腔,找到睾丸和附睾,剪取附睾尾,剪碎,置1.5ml离心管底部,加0.5ml 生理盐水,置37度水浴锅20分钟,用吸管从离心管上部取50微升液体,置细胞计数板,观察精子结构、密度和活力。
精子活力计算公式:精子活力=视野中直线运动的精子数/视野中总精子数4 收集卵母细胞成熟卵母细胞的收集:母鼠腹腔注射孕马血清促性腺激素PMSG(每只10单位),48小时后再注射人类绒毛膜促性腺HCG(每只10单位),18小时后断颈处死母鼠,打开腹腔,剪下输卵管,用镊子刺破输卵管壶腹部,释放卵母细胞,用透明质酸酶溶液(10毫克/毫升生理盐水)处理卵母细胞以除去颗粒细胞,在实体显微镜下观察卵母细胞的结构。
未成熟卵母细胞的收集:断颈处死性成熟前母鼠,打开腹腔,剪取卵巢,加入1毫升盐水,用刀片或镊子捣碎卵巢,寻找生发泡状态的卵母细胞,观察卵母细胞结构。
5 体外授精将卵母细胞与精子共培养(微滴培养法)(演示)三、实验结果各种精子和卵子的形态绘图;精子活力;精子密度四、实验收获与体会,存在问题和改进意见。
实验二:小鼠早期不同发育阶段胚胎的收集、观察以及胚胎移植一、实验目的:掌握小鼠附植前胚胎收集方法,观察不同发育阶段小鼠胚胎的结构,认识小鼠早期胚胎形态学,并了解体内发育阶段与所处生殖器官位置的关系,了解小鼠胚胎移植的基本原理和操作过程。
二、操作过程:1 小鼠超数排卵程序中午12时腹腔注射PMSG,48小时后腹腔注射HCG并与公鼠合笼交配,次日清晨检查阴道栓,如果发现阴道栓则妊娠0.5天。