实验五、GUS染色检测基因瞬时表达
- 格式:pptx
- 大小:1003.73 KB
- 文档页数:6


gus染色原理
Gus染色原理。
Gus染色是一种用于检测β-葡萄糖苷酶活性的方法,它是以β-葡萄糖苷酶的
底物5-氯-4-溴-3-吲哚基葡萄糖(X-葡萄糖)为基础的染色方法。
在染色过程中,
X-葡萄糖会被β-葡萄糖苷酶水解,产生游离的5-氯-4-溴-3-吲哚基(X-吲哚),然后X-吲哚会与染色底物中的氧化剂氧化反应,生成可见的蓝色产物,从而实现对
β-葡萄糖苷酶活性的检测。
Gus染色的原理可以分为以下几个步骤:
1. 底物水解,X-葡萄糖是β-葡萄糖苷酶的底物,当β-葡萄糖苷酶存在时,它
会催化X-葡萄糖的水解反应,将其分解为X-吲哚和葡萄糖。
2. 氧化反应,X-吲哚与染色底物中的氧化剂(如溴化4-溴-3-吲哚苯)发生氧
化反应,生成可见的蓝色产物。
3. 结果观察,通过观察样品的颜色变化,可以判断β-葡萄糖苷酶的活性水平。
活性高的样品会呈现深蓝色,活性低的样品则会呈现浅蓝色或无色。
Gus染色方法具有操作简便、结果直观、灵敏度高的特点,因此被广泛应用于
细菌、植物和动物细胞等生物体系中对β-葡萄糖苷酶活性的检测。
同时,Gus染
色还可以在组织学研究中用于检测β-葡萄糖苷酶的表达情况,为研究者提供重要
的实验数据。
总的来说,Gus染色是一种简单而有效的β-葡萄糖苷酶活性检测方法,其原理清晰,操作方便,结果可靠。
在生物学研究中具有重要的应用价值,为科研工作者提供了有力的实验手段。
通过对Gus染色原理的深入了解,可以更好地应用和优
化这一方法,为科学研究提供更加可靠的数据支持。

gus染色原理Gus染色原理。
Gus染色是一种用于研究植物组织中β-葡萄糖苷酶活性的常用方法。
这种染色方法利用了β-葡萄糖苷酶对X-葡萄糖苷基苯基酚的水解作用,使得组织中含有该酶的部分在染色后呈现出蓝色的颜色。
下面将介绍Gus染色的原理及其应用。
Gus染色的原理主要是利用了β-葡萄糖苷酶对X-葡萄糖苷基苯基酚的水解作用。
X-葡萄糖苷基苯基酚是一种无色底物,在β-葡萄糖苷酶的作用下,会被水解成苯基酚和葡萄糖。
而苯基酚在碱性条件下会发生氧化反应,生成蓝色产物。
因此,含有β-葡萄糖苷酶的组织在Gus染色后会呈现出蓝色,从而可以直观地观察到该酶的活性分布情况。
Gus染色在植物学研究中有着广泛的应用。
首先,它可以用于研究植物生长发育过程中β-葡萄糖苷酶的活性分布情况。
通过对不同发育阶段的植物组织进行Gus染色,可以清晰地观察到该酶在不同组织中的表达情况,从而揭示其在植物生长发育中的作用。
其次,Gus染色还可以用于研究植物对逆境的响应机制。
在逆境条件下,植物体内的β-葡萄糖苷酶活性可能会发生变化,通过Gus染色可以对其进行快速、直观的检测,从而揭示植物对逆境的生理响应。
除了在植物学研究中的应用,Gus染色还可以用于转基因植物的筛选。
在转基因植物中,外源基因通常会与Gus基因进行融合,从而使得转基因植物组织中具有Gus活性。
通过对转基因植物进行Gus染色,可以快速、准确地筛选出具有外源基因表达的植物组织,为转基因植物育种提供了重要的技术手段。
总之,Gus染色作为一种常用的酶活性检测方法,在植物学研究中发挥着重要作用。
它不仅可以用于研究植物生长发育过程中酶活性的分布情况,还可以用于研究植物对逆境的响应机制,以及转基因植物的筛选。
相信随着技术的不断进步,Gus染色方法将在植物学研究中发挥更大的作用。

●产品简介:gus(β-glucuronidase,β-D- 葡萄糖苷酸酶)基因是目前常用的一种报告基因,其表达产物β-葡萄糖苷酸酶(GUS)是一种水解酶,能催化许多β-葡萄糖苷酯类物质的水解,它可以将5-溴-4-氯-3-吲哚-β-葡萄糖苷酸酯(X-gluc.htm' target=_blank>x-gluc)分解为蓝色的物质,其检测方法简单、快速、灵敏、稳定,且背景活性低。
因为绝大多数植物细胞内不存在内源的GUS活性,因此gus基因广泛用作转基因植物的报告基因,尤其是在研究外源基因瞬时表达的转化实验中广泛应用。
该试剂盒包含GUS染色的全部试剂,使用方便,只需将染色液和缓冲液按照比例混合即配成GUS染色液。
该试剂盒可以配制50ml GUS染色液。
●贮存和效期:X-gluc染色液-20℃保存;GUS染色缓冲液4℃贮存。
自开封之日起有效期一年。
●使用说明:一. GUS染色液配制:X-gluc染色液为50×浓缩液,使用前用GUS染色缓冲液稀释50倍即配成GUS染色液。
如0.1 ml X-gluc染色液加入到5 ml GUS染色缓冲液中,即配成5 ml GUS染色溶液。
该染色溶液最好现用现配,短期贮存可以-20℃保存2-3天。
二. GUS染色步骤:1.将准备好的材料浸泡在GUS染色液中,于25-37℃保温1小时至过夜。
2.叶片等绿色材料转入70%乙醇中脱色2-3次,至阴性对照材料呈白色。
3.肉眼或显微镜下观察,白色背景上的蓝色小点即为GUS表达位点。
注:用于染色的植物材料的制备方法要因涉及的特定组织和器官的不同而异。
例如,拟南芥的根、花和叶片以及烟草幼苗的根就可以不作任何预处理而直接染色。
但是像烟草和马铃薯这些植物的茎和叶就必须在染色前切成薄片(1-3mm)。
当操作大的组织和样品时,可以选用真空渗入法来帮助底物和酶渗入细胞。
GUS能与显色底物X-gluc 反应,显现蓝色,因而可以通过组织化学染色定性研究GUS的表达水平和表达模式。

gus染色原理Gus染色原理。
Gus染色是一种常用的细胞染色技术,用于检测β-葡萄糖苷酶(β-glucuronidase)的活性。
β-葡萄糖苷酶是一种水解酶,能够水解含有葡萄糖醛酸酯的底物,产生游离的葡萄糖醛酸。
Gus染色的原理是利用β-葡萄糖苷酶水解底物后产生的蓝色产物,对细胞或组织进行染色,从而观察β-葡萄糖苷酶的活性和分布情况。
在进行Gus染色之前,首先需要准备Gus染色液和底物。
Gus染色液通常由染色缓冲液、染色底物和其它辅助试剂组成。
染色底物是一种含有葡萄糖醛酸酯的化合物,一般为5-溴-4-氯-3-吲哚基葡萄糖醛酸(X-gluc)。
X-gluc在β-葡萄糖苷酶的作用下会产生蓝色的沉淀物,用于显示β-葡萄糖苷酶的活性。
辅助试剂通常包括有机溶剂、金属离子螯合剂等,用于增强染色效果和稳定染色产物。
在实际操作中,将待检测的细胞或组织样品加入Gus染色液中进行染色处理。
在适当的温度和时间条件下,X-gluc会被β-葡萄糖苷酶水解,产生蓝色的沉淀物。
通过显微镜观察染色结果,可以直观地了解β-葡萄糖苷酶在样品中的活性和分布情况。
活性高的细胞或组织会呈现出深色的染色,而活性低的则呈现较浅的染色或无染色。
Gus染色技术在植物学、动物学和微生物学等领域得到了广泛的应用。
在植物学中,可以利用Gus染色观察植物各部位中β-葡萄糖苷酶的表达情况,从而研究植物的生长发育过程和应激响应机制。
在动物学中,Gus染色也可用于研究动物胚胎发育过程中的基因表达和细胞分化情况。
在微生物学中,Gus染色可以用于检测细菌和真菌中β-葡萄糖苷酶的活性,从而研究微生物的代谢特性和环境适应能力。
总之,Gus染色技术是一种简单、直观的细胞染色方法,能够有效地检测β-葡萄糖苷酶的活性和分布情况。
通过对样品进行Gus染色,可以为细胞生物学和生物化学研究提供重要的实验数据,促进对生物学问题的深入理解和探讨。
随着生物技术的不断发展,相信Gus染色技术在生命科学领域中会有更广泛的应用和深入的研究。

农杆菌EHA105转化条件的优化及水稻愈伤组织遗传转化体系的初步建立:以质粒PBI121和gfp作为外源DNA转化农杆菌EHA105,通过对EHA105生长状态的测定,并对重悬液Cacl浓度,速冻时间和热处理温度等实验条件逐一进行筛2选,以确定EHA105的最优转化条件。
然后,分别用被转化的农杆菌侵染水稻愈伤组织。
结果表明,农杆菌 OD值接近0.6经过20mmol/L Cacl2重悬细胞,液氮速冻5600分钟后于28?处理5分钟,农杆菌的转化效率最高。
愈伤组织经GUS染色或荧光观察,外源基因已经转入水稻种子中。
农杆菌;水稻愈伤组织;遗传转化: Agrobacterium tumefaciens EHA105 was transformed by the plasmid PBI121 and gfp. To difine the best experimental conditions for transformationof A.tumefaciens the growth rate of the A.tumefaciens EHA105 was measured ,andthe concentration of resuspension solution,freezing time and the thawingtemperature were tested. And then infected mature rice in order to inducecallus with Agrobacterium tumefaciens respective .Result: By resuspended inCaclbuffer, frozen in liquid nitrogen for 5 min and thawed in 28? for 5 2min, the efficiency of transformation was the best. The callus was dyed byGUS or seen by fluorescence, which can testify that exterior gene has beentransferred into rice.Agrobacterium tumefaciens; rice callus; Genetic transformation水稻是世界上重要的粮食作物,并已为分子生物学研究的模式作物之一。

不同调控序列作用下GUS基因在烟草中瞬时表达活性谢伟;乐超银;郭政宏;戴志鹏;刘敏;姚伟【期刊名称】《植物学报》【年(卷),期】2007(024)004【摘要】以pBI121为出发质粒,利用烟草泛素启动子Ubi.U4、CaMV35S启动子以及Kozak序列构建4种GUS基因表达载体,通过叶盘转化法转化烟草叶片,检测瞬时表达活性,研究不同调控序列对外源基因表达的调控作用.结果表明:CaMV35S 启动子附加Kozak序列后使GUS活性比独立使用CaMV35S提高了近2倍;双CaMV35S启动子附加Kozak序列驱动GUS基因的表达活性与单CaMV35S附加Kozak序列相当;烟草泛素启动子附加Kozak序列的表达活性为CaMV35S启动子附加Kozak序列的1.5倍;Ubi.U4-CaMV35S复合启动子附加Kozak序列驱动GUS基因表达水平最高,其表达效率是双CaMV35S启动子附加Kozak序列调控下GUS表达效率的3倍,为CaMV35S独立作用时的10倍.【总页数】7页(P452-458)【作者】谢伟;乐超银;郭政宏;戴志鹏;刘敏;姚伟【作者单位】三峡大学生物技术研究中心,宜昌,443002;三峡大学生物技术研究中心,宜昌,443002;三峡大学生物技术研究中心,宜昌,443002;三峡大学生物技术研究中心,宜昌,443002;三峡大学生物技术研究中心,宜昌,443002;三峡大学生物技术研究中心,宜昌,443002【正文语种】中文【中图分类】Q94【相关文献】1.不同调控因子下GUS基因在马铃薯块茎中瞬时表达的影响 [J], 舒锐;姚甜甜;李燕;臧传江;焦健;兰成云;刘少军2.不同调控序列控制下的gus基因在柑桔原生质体中的瞬间表达 [J], 王锋;朱祯3.不同调控序列控制下的GUS基因在水稻和毛白杨愈伤组织中的瞬时表达 [J], 刘根齐;李秀丽;杨春玲;陈钟;赵世民4.GUS基因在烟草原生质体中的瞬时表达 [J], 王业5.内源β-微管蛋白侧翼序列调控下条斑紫菜原生质体GUS基因的瞬间表达 [J], 宫倩红;于文功;戴继勋;刘红全;徐日富;管华诗;潘克厚因版权原因,仅展示原文概要,查看原文内容请购买。

Updated 03/05/09 powered by Li-WenyangGUS染色操作1.取材(避免夹伤);2.PBS漂洗3次;3.加入染色液,37C避光反应(如何控制反应时间:” Incubate seedlings at 37C until the desired staining intensity is observed”, ACC培养基上 5X EBS-GUS/Col-0 3天黄化苗经染色约2小时,在根的上半部就会有明显蓝色出现);4.回收染液;5.PBS漂洗3次;6.固定液室温固定2~4小时,或者过夜;7.95%乙醇(目的是使用接近固定液浓度的乙醇)漂洗数次至脱掉色素(室温或者37C均可);8.70%乙醇漂洗(目的是让材料在接近生理浓度时恢复形状);9.透明液室温透明15’,或者过夜(推荐1~24h);10.临时压片观察,照相。
注明:阴影字为快捷操作步骤,另外绿苗在此操作基础上需要进行脱色/透明操作,快捷步骤为100%乙醇、37C漂洗数次至脱掉绿色。
●PBS:100mM磷酸盐缓冲液A液:3.582g Na2HPO4·12H2O溶解于无菌蒸馏水,定容至10ml;B液:1.56g NaH2PO4·2H2O溶解于无菌蒸馏水,定容至10ml;取5.77ml A试剂、4.23ml B试剂混合,无菌蒸馏水定容至100ml;●staining buffer取40ml PBS,依次加入试剂:0.01861g EDTA0.01211195g 六氰合铁(II)酸钾0.016462g六氰合铁(III)酸钾(加入铁盐的目的:防止无色反应中间产物渗漏)用PBS定容至50ml,加入1% Trrton-X 100,避光保存;●GUS染液用EP管称取适量X-gluc粉末,加入少量DMSO或 N,N-二甲基甲酰胺助溶(一般溶解10mg 粉末约10~20ul二甲基甲酰胺),然后用staining buffer配成终浓度为1mg/ml的GUS染液,避光保存;●固定液无水乙醇:冰醋酸=9:1●透明液:30 ml H2O80 g 水合氯醛10 ml 100%甘油搅拌约1小时,使之充分溶解●背景GUS 基因由大肠杆菌E. coli 菌株K12 中uidA (也称为gusA) 基因座编码。

Gus染⾊试剂配制及使⽤⽅法●产品简介:gus(β-glucuronidase,β-D- 葡萄糖苷酸酶)基因是⽬前常⽤的⼀种报告基因,其表达产物β-葡萄糖苷酸酶(GUS)是⼀种⽔解酶,能催化许多β-葡萄糖苷酯类物质的⽔解,它可以将5-溴-4-氯-3-吲哚-β-葡萄糖苷酸酯(X-gluc.htm' target=_blank>x-gluc)分解为蓝⾊的物质,其检测⽅法简单、快速、灵敏、稳定,且背景活性低。
因为绝⼤多数植物细胞内不存在内源的GUS活性,因此gus基因⼴泛⽤作转基因植物的报告基因,尤其是在研究外源基因瞬时表达的转化实验中⼴泛应⽤。
该试剂盒包含GUS染⾊的全部试剂,使⽤⽅便,只需将染⾊液和缓冲液按照⽐例混合即配成GUS染⾊液。
该试剂盒可以配制50ml GUS染⾊液。
●贮存和效期:X-gluc染⾊液-20℃保存;GUS染⾊缓冲液4℃贮存。
⾃开封之⽇起有效期⼀年。
●使⽤说明:⼀. GUS染⾊液配制:X-gluc染⾊液为50×浓缩液,使⽤前⽤GUS染⾊缓冲液稀释50倍即配成GUS染⾊液。
如0.1 ml X-gluc染⾊液加⼊到5 ml GUS 染⾊缓冲液中,即配成5 ml GUS染⾊溶液。
该染⾊溶液最好现⽤现配,短期贮存可以-20℃保存2-3天。
⼆. GUS染⾊步骤:1.将准备好的材料浸泡在GUS染⾊液中,于25-37℃保温1⼩时⾄过夜。
2.叶⽚等绿⾊材料转⼊70%⼄醇中脱⾊2-3次,⾄阴性对照材料呈⽩⾊。
3.⾁眼或显微镜下观察,⽩⾊背景上的蓝⾊⼩点即为GUS表达位点。
注:⽤于染⾊的植物材料的制备⽅法要因涉及的特定组织和器官的不同⽽异。
例如,拟南芥的根、花和叶⽚以及烟草幼苗的根就可以不作任何预处理⽽直接染⾊。
但是像烟草和马铃薯这些植物的茎和叶就必须在染⾊前切成薄⽚(1-3mm)。
当操作⼤的组织和样品时,可以选⽤真空渗⼊法来帮助底物和酶渗⼊细胞。
GUS能与显⾊底物X-gluc 反应,显现蓝⾊,因⽽可以通过组织化学染⾊定性研究GUS的表达⽔平和表达模式。
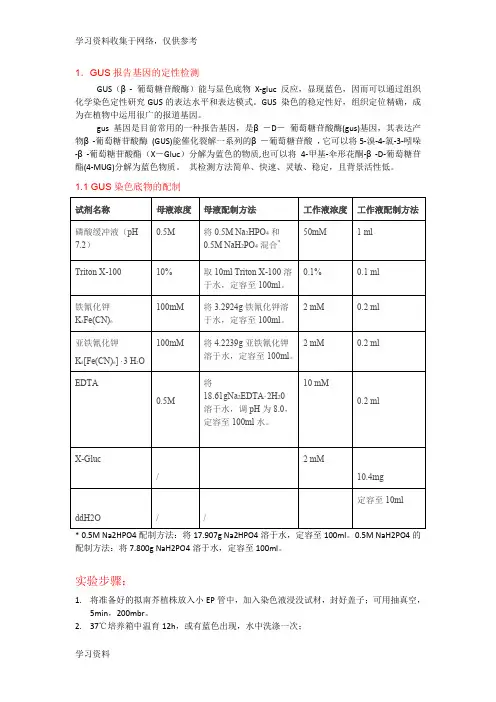
1.GUS报告基因的定性检测GUS(β- 葡萄糖苷酸酶)能与显色底物X-gluc 反应,显现蓝色,因而可以通过组织化学染色定性研究GUS的表达水平和表达模式。
GUS 染色的稳定性好,组织定位精确,成为在植物中运用很广的报道基因。
gus基因是目前常用的一种报告基因,是β-D-葡萄糖苷酸酶(gus)基因,其表达产物β-葡萄糖苷酸酶(GUS)能催化裂解一系列的β-葡萄糖苷酸,它可以将5-溴-4-氯-3-吲哚-β-葡萄糖苷酸酯(X-Gluc)分解为蓝色的物质,也可以将4-甲基-伞形花酮-β-D-葡萄糖苷酯(4-MUG)分解为蓝色物质。
其检测方法简单、快速、灵敏、稳定,且背景活性低。
1.1 GUS染色底物的配制* 0.5M Na2HPO4配制方法:将17.907g Na2HPO4溶于水,定容至100ml。
0.5M NaH2PO4的配制方法:将7.800g NaH2PO4溶于水,定容至100ml。
实验步骤:1.将准备好的拟南芥植株放入小EP管中,加入染色液浸没试材,封好盖子;可用抽真空,5min,200mbr。
2.37℃培养箱中温育12h,或有蓝色出现,水中洗涤一次;3.将浸染过的试材转入70%(或95%乙醇)中脱色2-3次(除去叶绿素),每隔1小时更换一次脱色液,至阴性对照材料呈白色为止。
(漂洗:先后用50%,70%,100%的乙醇漂洗样品,每次浸泡5分钟。
脱色:加入100%乙醇浸泡直至完全脱色。
)4.立体显微镜观察拍照。
2.GUS报导基因的定量检测GUS 能与底物MUG(分子量352.3,4-甲基伞型酮-β-葡萄糖醛酸苷,4-methylumbelliferylβ-D-glucuronide)反应产生荧光物质MU(分子量198.2,4-甲基伞型酮,4-methylumbelliferone)。
MU的激发波长为365nm,发射波长为456nm,其含量可由荧光分光光度计测出。
因此,我们可以根据单位质量的植物总蛋白在单位时间内产生的荧光物质的多少来定量的检测GUS含量。

gus报告基因:解析人类遗传密码的奇妙之旅基因,是构成生物体的遗传信息的基本单位,承载着人类漫长而神秘的进化史。
在近代科学技术的推动下,我们逐渐揭开了基因的面纱,而在这个不断进步的时代,成为了一个引人注目的话题。
今天,我们将一同踏上一场奇妙的基因之旅,探寻的秘密。
首先,我们需要明确,是基因表达的一种方式,它使用Gus基因编码的蛋白质作为报告者,帮助科学家观察和研究基因的活动。
Gus基因来自于一个细菌,它产生的酶能将一种特定底物转化为可见的、有色的产物。
因此,通过引入到生物体中,我们便能通过颜色变化来观察到基因表达的情况。
技术的广泛应用,使得生命科学领域的研究更加精确和高效。
在植物领域,帮助我们了解植物生长过程中的基因活动,比如在植物组织或细胞中的分化和发育过程中,通过观察产生的颜色变化,我们可以得知特定基因在哪些部位或时期表达,进而了解其功能和调控。
这对于改良作物的生长、抗病性以及增加农作物产量将具有重要意义。
此外,在动物研究中,同样发挥着重要作用。
例如,在小鼠模型研究中,科学家会将与某些特定基因结合,使得这些特定基因表达的部位或活动受到限制,通过观察的活性,研究人员可以理解这些特定基因对小鼠生命过程的影响,例如生长发育、免疫反应等。
这种技术的应用将有助于揭示基因与疾病之间的联系,为人类疾病治疗提供新的思路和方法。
与此同时,技术也解决了传统方法无法回答的问题。
以微生物研究为例,通过引入,科学家能够观察到微生物在复杂环境中的活动和生态功能,探究它们在土壤、水体等生态系统中的作用。
此外,在细胞生物学和分子生物学领域也被广泛应用,帮助研究人员了解基因的调控、信号传导以及细胞功能等重要问题。
然而,技术也存在一些技术上的限制和伦理考虑。
首先,该技术必须正确选择和设计Gus基因,以确保其在目标生物体中的表达与目标基因的表达一致。
其次,只能提供定性结果,无法给出具体的基因表达水平信息。
此外,在应用该技术时,需要进行合理伦理评估,确保在实验过程中对生物体的健康和福利造成最低程度的干扰。
亚细胞定位准备(用烟草ck)MS无抗培养基倒平皿,铺二层滤纸于培养基上;吸水纸(卫生纸一卷),小滤纸,用10ml 离心管代替打孔器,50ml离心管;小三角瓶(均需要灭菌,115℃,30min)1.将保存的农杆菌划线(kan+rif),第三天中午挑菌于(kan+rif)LB培养基中28-30℃,摇床20h至第四天早上;2.以1:25比例(1ml接种于25ml)接菌液于25mlLB(含kan+rif,50nmAS)28-30℃,摇床培养至OD=0.6-0.8,约5h。
3.用50mL离心管收集菌体,常温,5000rpm,离心5min,弃上清;4.用以下溶液重悬菌体等体积25ml(10mM MgCL2,10mM MES, 150nM AS)放入小三角瓶,室温下静置活化2h,(铺滤纸于已凝的无抗MS培养基);5.将叶片打孔,圆状的叶片浸泡在菌液中,真空渗透30min-1h(0.85Mpa)。
6.用灭菌的吸水纸吸干表面的菌液,平铺放置于MS培养基上,光照培养48h。
7.观察。
GUS定量分析所用试剂:1、0.1M磷酸缓冲液)(pH7.0)1M Na2PO4 11.54ml1M NaH2PO4 8.46mlAdd ddH2O TO 200ml2、GUS 蛋白提取液 (现用现配)0.1M磷酸缓冲液(pH7.0) 100ml10% SDS 2ml0.5M EDTA(Ph8.0) 4mlTritonx-100 200ulβ-巯基乙醇 200uladd ddH2O TO 200ml121℃灭菌室温保存3、gus蛋白分析buffer每100ml的蛋白提取液加入4-MUG 70.46mg,-20℃保存,现配现用。
4、0.2M Na2CO3 buffer。
Gus蛋白提取方法(全过程于冰上操作)•取适量烟草叶片,加入适量PVP,加液氮研磨成粉末,取约0.6g装入15ml离心管中•预先加入500ml蛋白提取液,摇匀,在冰上放置置沉淀•4℃,13000prm离心15min.•吸取上清到另一管中进行下一步实验,(未及时做放-20℃)Gus活性测定•取20ul蛋白加入37℃预热的180ulgus 蛋白分析buffer中,37℃温浴。
1.GUS报告基因的定性检测GUS(β- 葡萄糖苷酸酶)能与显色底物X-gluc 反应,显现蓝色,因而可以通过组织化学染色定性研究GUS的表达水平和表达模式。
GUS 染色的稳定性好,组织定位精确,成为在植物中运用很广的报道基因。
gus基因是目前常用的一种报告基因,是β-D-葡萄糖苷酸酶(gus)基因,其表达产物β-葡萄糖苷酸酶(GUS)能催化裂解一系列的β-葡萄糖苷酸,它可以将5-溴-4-氯-3-吲哚-β-葡萄糖苷酸酯(X-Gluc)分解为蓝色的物质,也可以将4-甲基-伞形花酮-β-D-葡萄糖苷酯(4-MUG)分解为蓝色物质。
其检测方法简单、快速、灵敏、稳定,且背景活性低。
1.1 GUS染色底物的配制配制方法:将7.800g NaH2PO4溶于水,定容至100ml。
实验步骤:1.将准备好的拟南芥植株放入小EP管中,加入染色液浸没试材,封好盖子;可用抽真空,5min,200mbr。
2.37℃培养箱中温育12h,或有蓝色出现,水中洗涤一次;3.将浸染过的试材转入70%(或95%乙醇)中脱色2-3次(除去叶绿素),每隔1小时更换一次脱色液,至阴性对照材料呈白色为止。
(漂洗:先后用50%,70%,100%的乙醇漂洗样品,每次浸泡5分钟。
脱色:加入100%乙醇浸泡直至完全脱色。
)4.立体显微镜观察拍照。
2.GUS报导基因的定量检测GUS 能与底物MUG(分子量352.3,4-甲基伞型酮-β-葡萄糖醛酸苷,4-methylumbelliferylβ-D-glucuronide)反应产生荧光物质MU(分子量198.2,4-甲基伞型酮,4-methylumbelliferone)。
MU的激发波长为365nm,发射波长为456nm,其含量可由荧光分光光度计测出。
因此,我们可以根据单位质量的植物总蛋白在单位时间内产生的荧光物质的多少来定量的检测GUS含量。
2.1 试剂配制1) 1mol/L Na2HPO4溶液:35.814g Na2HPO4溶于100ml水。
gus染色原理Gus染色原理:探索细胞内的奥秘引言:Gus染色原理是一种常用的细胞染色技术,它能够帮助研究人员观察和分析细胞中特定化合物的存在与分布情况。
本文将深入探讨Gus染色原理的基本概念、实验步骤和应用领域。
一、Gus染色原理的基本概念Gus染色原理是基于β-葡萄糖苷酶(Gus)酶的活性,通过其与葡萄糖苷酶底物X-葡萄糖苷(X-Gluc)的反应来实现细胞染色。
Gus 酶是一种广泛存在于真核生物和细菌中的酶,它能够催化底物X-Gluc的水解反应,产生可观察的蓝色沉淀。
二、Gus染色原理的实验步骤1. 样品处理:首先,需要准备待研究的细胞样品。
样品的获取可以通过组织切片、细胞培养等方式进行,确保样品的完整性和活性。
2. Gus染色液配制:将X-Gluc溶解在染色缓冲液中,制备Gus染色液。
染色缓冲液的配制需要根据实验需求来确定,一般包括pH 值的调节,以保证酶的活性。
3. 细胞染色:将样品浸泡在Gus染色液中,经过一定时间的反应,底物X-Gluc与Gus酶发生反应,生成蓝色沉淀物。
染色时间的长短应根据具体情况进行调整,以确保染色效果的最佳化。
4. 观察和分析:通过显微镜观察染色后的细胞,可以观察到蓝色沉淀物的存在和分布情况。
通过对细胞的形态、数量、位置等特征进行分析,可以进一步推测特定化合物的存在和功能。
三、Gus染色原理的应用领域1. 植物生物学研究:Gus染色在植物生物学研究中得到广泛应用。
通过染色观察植物组织中特定基因的表达情况,可以揭示基因在不同组织和发育阶段的活性,进而理解其在生长和发育过程中的功能。
2. 微生物学研究:Gus染色也在微生物学研究中发挥重要作用。
通过对细菌、酵母等微生物中特定基因的表达进行染色观察,可以研究其在适应环境、代谢调控等方面的功能。
3. 分子生物学研究:Gus染色可作为一种辅助手段,用于研究基因调控网络和信号传导途径。
通过观察Gus染色后的细胞,可以揭示基因在细胞内的表达模式和调控机制,为深入理解细胞功能提供重要线索。