啮齿类动物安乐死方法
- 格式:pdf
- 大小:268.11 KB
- 文档页数:1

小鼠处死方法小鼠是一种常见的实验动物,广泛应用于医学、生物学等领域的实验研究中。
在实验完成后,需要对小鼠进行处死,以终止其生命。
正确的处死方法不仅可以减少小鼠的痛苦,还可以保证实验结果的准确性。
本文将介绍几种常见的小鼠处死方法,供大家参考。
1. 麻醉后处死。
首先,可以选择使用麻醉药物将小鼠进行麻醉,待小鼠完全失去知觉后,再使用适当的方法进行处死。
常见的麻醉药物包括异氟醚、氯仿等,这些药物可以迅速使小鼠陷入麻醉状态,减少其痛苦。
在小鼠完全失去知觉后,可以选择采用颈部脱臼、颈椎切断等方法进行处死。
这种方法可以确保小鼠在没有任何痛苦的情况下结束生命。
2. 窒息处死。
另一种常见的小鼠处死方法是利用二氧化碳或一氧化碳进行窒息。
将小鼠置于密闭的容器中,注入适量的二氧化碳或一氧化碳,待小鼠呼吸困难,最终窒息死亡。
这种方法可以快速、有效地结束小鼠的生命,减少其痛苦。
在使用二氧化碳或一氧化碳进行处死时,需要注意控制浓度和时间,以确保处死的效果和速度。
3. 颈椎切断。
颈椎切断是一种常见的小鼠处死方法,适用于需要获取小鼠脑组织样本的实验。
在进行颈椎切断时,需要将小鼠固定在手术台上,用手术刀迅速切断颈椎,使小鼠立即丧失知觉并死亡。
这种方法需要专业人员操作,以确保操作的准确性和速度,避免小鼠产生痛苦。
4. 麻醉药物注射。
除了麻醉后处死外,也可以选择直接使用麻醉药物进行注射处死小鼠。
将适量的麻醉药物注射到小鼠体内,使其迅速失去知觉并死亡。
这种方法需要注意药物的剂量和注射部位,以确保小鼠在短时间内安全、无痛苦地结束生命。
总之,正确的小鼠处死方法可以减少小鼠的痛苦,保证实验结果的准确性。
在进行处死操作时,需要严格遵守实验室的规定和操作流程,以确保小鼠在最短的时间内安全、无痛苦地结束生命。
希望本文介绍的小鼠处死方法对大家有所帮助,谢谢阅读。

小鼠处死方法小鼠是一种常见的实验动物,广泛应用于医学、生物学、药理学等领域的实验研究中。
在实验结束后,对小鼠进行处死是必不可少的环节。
正确的处死方法不仅可以减少小鼠的痛苦,还能保证实验结果的准确性。
因此,选择合适的小鼠处死方法显得尤为重要。
一、麻醉处死法。
麻醉处死法是一种常见的小鼠处死方法,通过给小鼠注射麻醉药物,使其迅速丧失知觉并最终死亡。
这种方法可以减少小鼠的痛苦,是一种较为温和的处死方式。
常用的麻醉药物包括氯仿、异氟醚等,其中氯仿是一种常用的麻醉药物,使用方便,效果明显。
在使用麻醉药物时,需要注意药物的剂量和注射部位,以免造成不必要的疼痛和伤害。
二、颈椎脱位法。
颈椎脱位法是一种较为快速和有效的小鼠处死方法,通过迅速而准确地将小鼠的颈椎脱位,造成脊髓损伤,从而使小鼠迅速丧失知觉并死亡。
这种方法需要操作者具备一定的技术和经验,以确保操作的准确性和效果。
在进行颈椎脱位时,需要注意力度和速度的控制,避免造成小鼠的痛苦和不必要的伤害。
三、二氧化碳麻醉法。
二氧化碳麻醉法是一种常用的小鼠处死方法,通过将小鼠置于装有二氧化碳气体的密闭容器中,使其迅速丧失知觉并死亡。
这种方法操作简单,效果明显,可以减少小鼠的痛苦。
在使用二氧化碳麻醉法时,需要注意控制气体的浓度和流速,以确保处死的效果和速度。
四、颈部切割法。
颈部切割法是一种常见的小鼠处死方法,通过迅速而准确地切断小鼠的颈部血管和气管,造成大量出血和窒息,最终导致小鼠死亡。
这种方法需要操作者具备一定的技术和经验,以确保操作的准确性和效果。
在进行颈部切割时,需要注意刀具的锋利度和速度的控制,避免造成小鼠的痛苦和不必要的伤害。
五、电击法。
电击法是一种较为快速和有效的小鼠处死方法,通过给小鼠施加电击,造成心脏骤停和死亡。
这种方法需要使用特制的电击设备,操作简单,效果明显。
在使用电击法时,需要注意电击的电压和时间,以确保处死的效果和速度。
综上所述,选择合适的小鼠处死方法是非常重要的。

二氧化碳处死小鼠原理二氧化碳处死小鼠(Carbon Dioxide Euthanasia in Mice)是一种常用于实验室动物处死的方法。
该方法利用二氧化碳浓度过高导致小鼠窒息,最终导致死亡。
以下将详细介绍二氧化碳处死小鼠的原理。
首先,在开始处死过程之前,需要选择适当的装置。
常见的装置包括处理室、透明容器或封闭的箱子。
装置必须具备以下特点:能够将二氧化碳引导到装置中,防止逃逸;能够使二氧化碳浓度逐渐增加,而不是突然增加。
然后,将小鼠放入适当的装置中。
这可以通过将小鼠置于适当大小的封闭容器中,例如多孔透明塑料盒子或封闭的处理室来完成。
装置必须有良好的密封性,防止二氧化碳逃逸。
在放入小鼠之前,可以向装置中添加环境丰富的材料,例如纸张或木屑,以提供适当的环境。
接下来,逐渐引入二氧化碳。
可以使用可控的流量控制器将二氧化碳缓慢注入装置。
二氧化碳的流量和注入速度必须被控制在安全范围内,以防止小鼠感到过度恐惧或痛苦。
通常,流量设置在四升/分钟,几分钟内达到目标浓度。
二氧化碳在装置中逐渐积累,浓度逐渐增加,最终导致小鼠窒息。
二氧化碳可以通过鼻孔或嘴巴进入小鼠的呼吸道,从而取代氧气,导致氧气供应不足。
缺乏氧气会导致假性窒息,最终引起小鼠死亡。
在整个处死过程中,研究人员应密切观察小鼠的状况。
症状通常包括呼吸急促、痉挛和惊慌。
最终,小鼠会进入昏迷,停止呼吸,最终死亡。
总结而言,二氧化碳处死小鼠是一种常用于实验室动物处死的方法。
该方法利用二氧化碳浓度过高导致小鼠窒息,最终导致死亡。
了解二氧化碳处死小鼠的原理有助于实施处死过程的正确操作,并确保对动物的尊重和最低程度的痛苦。
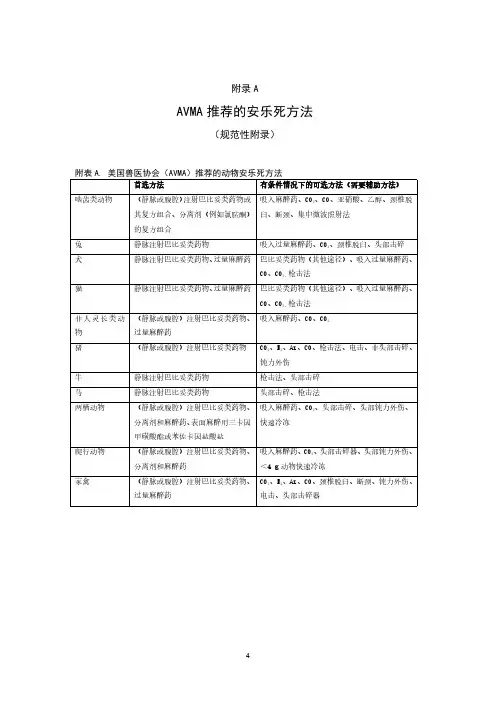
附录A
AVMA推荐的安乐死方法
(规范性附录)
附表A.美国兽医协会(AVMA)推荐的动物安乐死方法
首选方法有条件情况下的可选方法(需要辅助方法)
啮齿类动物(静脉或腹腔)注射巴比妥类药物或
其复方组合、分离剂(例如氯胺酮)
的复方组合吸入麻醉药、CO
2
、CO、亚硝酸、乙醇、颈椎脱臼、断颈、集中微波照射法
兔静脉注射巴比妥类药物吸入过量麻醉药、CO
2
、颈椎脱臼、头部击碎
犬静脉注射巴比妥类药物、过量麻醉药巴比妥类药物(其他途径)、吸入过量麻醉药、
CO、CO
2、
枪击法
猫静脉注射巴比妥类药物、过量麻醉药巴比妥类药物(其他途径)、吸入过量麻醉药、
CO、CO
2、
枪击法
非人灵长类动物(静脉或腹腔)注射巴比妥类药物、
过量麻醉药
吸入麻醉药、CO、CO
2
猪(静脉或腹腔)注射巴比妥类药物CO
2、N
2
、Ar、CO、枪击法、电击、非头部击碎、
钝力外伤
牛静脉注射巴比妥类药物枪击法、头部击碎马静脉注射巴比妥类药物头部击碎、枪击法
两栖动物(静脉或腹腔)注射巴比妥类药物、
分离剂和麻醉药、表面麻醉用三卡因
甲磺酸酯或苯佐卡因盐酸盐吸入麻醉药、CO
2
、头部击碎、头部钝力外伤、快速冷冻
爬行动物(静脉或腹腔)注射巴比妥类药物、
分离剂和麻醉药吸入麻醉药、CO
2
、头部击碎器、头部钝力外伤、<4g动物快速冷冻
家禽(静脉或腹腔)注射巴比妥类药物、
过量麻醉药CO
2
、N
2
、Ar、CO、颈椎脱臼、断颈、钝力外伤、电击、头部击碎器
4。

狗狗疫苗操作方法给狗狗做安乐死的原因及操作方法哈士奇(详情介绍)一、给狗狗做安乐死的原因1.给狗狗进行安乐死多时因为狗狗患上了难以治愈又不至于立马死去的疾病。
狗狗所患疾病让狗狗承受着无痛苦,如吃不下、睡不好、四肢瘫痪在地上,发出痛苦的声。
例如狗狗的外伤导致四肢严重的瘫痪,处于临危状态,故主人不忍心看着爱狗承受着这般痛苦而对其选择了安乐死。
还有如狂犬病患犬、一些狗瘟病犬等等可能给狗狗进行安乐死。
比熊犬(详情介绍)二、怎样对狗狗进行安乐死3.注射凝血剂:先让患病宠物以麻醉剂沉睡,再注射凝血剂,堵塞静脉。
凝血剂的作用机制主要是作用于动物机体的血液蛋白的凝血因子,造成血液的凝结,形成血栓,造成血管的阻塞,阻断血液流动,造成患病宠物的死亡。
4.注射戊钠法:以每千克体重15毫升或每千克体重75毫克快速静脉注射。
5.注射饱和硫酸镁法:40%硫酸镁溶液以每千克体重1毫升快速静脉注射。
饱和硫酸镁法是另一种不会让狗狗出现挣扎就迅速死亡的方法。
其原理为镁离子具有抑制中枢神经系统、使意识丧失和直接抑制延髓的呼吸及血管运动中枢的作用,同时还有阻断末梢神经与骨骼肌结合部的传导使骨骼肌弛缓的作用。
给狗狗做安乐死的原因及操作方法第一,狗安乐死的原因1.长期安乐死狗,因为狗患有难以治愈的疾病,不会立即死亡。
狗狗患有不能进食、睡眠不好、地面四肢瘫痪、痛苦等疾病。
比如狗的外伤导致四肢严重瘫痪,处于危急状态,主人不忍看着狗受这么大的痛苦,选择了安乐死。
还有狂犬,一些狗瘟狗,等等,可能会对狗实施安乐死。
双极狗(详情)二、如何对狗实施安乐死3.凝结剂注射:让生病的宠物用麻药睡觉,然后注射凝结剂阻断静脉。
凝固剂的作用机制主要是作用于动物体内血液蛋白的凝固因子,引起血液凝固、血栓形成、血管堵塞、血流中断、患病宠物死亡。
4.戊钠注:15ml/kg体重或75mg/kg体重。
5.饱和硫酸镁注射法:静脉注射40%硫酸镁溶液,每公斤体重1毫升。
饱和硫酸镁法是另一种不会导致狗挣扎而迅速死亡的方法。

大鼠和小鼠的处死方法1.脊椎脱臼法右手抓住鼠用力向后拉,同时左手拇指与食指用力向下按住鼠头,将脊髓与脑髓拉断,鼠便立即死亡。
2.断头法实验者戴上棉绿纱手套,用右手握住大鼠头部,左手握住背部,露出颈部,助手用剪刀在鼠颈部将鼠头剪掉。
小鼠处死法相同。
3.击打法右手抓住鼠尾,提起,用力摔击其头部,鼠痉挛后立即死亡。
用小木锤用力击打鼠头部也可致死。
4.急性大失血法可采用鼠眼眶动脉和静脉急性大量失血方法使鼠立即死亡。
5.化学致死法吸入一氧化碳,大、小鼠在一氧化碳浓度为0.2-0.5%环境中即可致死。
皮下注射士的年,吸入乙醚、氨仿,均可致死。
士的年注射量,小鼠为0.76~2.0mg/kg体重,大鼠3.0-3.5ml/kg体重。
氯化钾处死大鼠剂量:25%溶液0.6ml/只静脉注入。
快速处死小鼠的专业方法:这是在动物试验中最常用的也是最使用的处死小鼠的方法,要领是拉的时候必须要快速使劲,才可让小鼠瞬间死亡,如果拉时固定小鼠头部的手指松了有可能造成小鼠转身咬伤手指的事故发生。
脊柱脱臼法:用左手拇指和食指捏住小白鼠头的后部,并用力下压,右手抓住鼠尾,用力向后上方拉,即可使颈椎脱臼,瞬间死亡动物处死方法:主要依据动物的种类、动物的大小、取材的手段以及观察的组织结构特点,选用动物处死的方法。
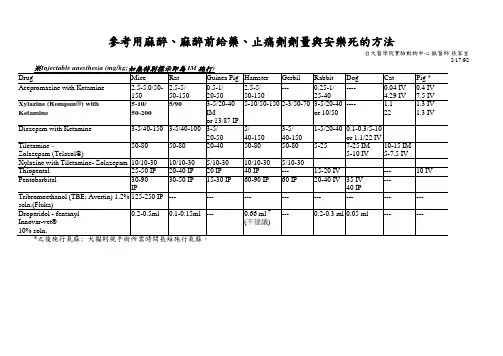
1.麻醉的方法(1)吸入麻醉法:适用的动物:大鼠、豚鼠等。
麻醉药物:乙醚、三氯甲烷(氯仿)。
(2)注射麻醉法适宜的动物:大鼠、豚鼠、兔、猫、犬、猴等。
麻醉药物: 4%戊巴比妥、20%氨基甲酸乙酯、1%水合氯醛。
按照动物的每公斤体重给予药量。
注射途经:肌肉注射、静脉注射、腹腔注射。
2.空气栓塞方法通过向动物静脉内注射一定量的空气,使其心脏在暂短的时间内发生急性空气栓塞,从而造成机体血液循环障碍,导致动物痉挛而死亡。
适用的动物:家兔、犬等。
注射空气的量视动物大小而不同,家兔:约20~60ml;犬:约80~150ml。
注意:利用空气栓塞方式处死动物虽然迅速方便,但此方法可使动物机体内各脏器或多或少地出现淤血的现象,如心内膜下淤血。

小鼠颈椎脱臼法处死的方法全文共四篇示例,供读者参考第一篇示例:小鼠颈椎脱臼法是一种常用的实验动物处死方法,通常用于科研实验或者教学实验中。
在实验室动物处死的过程中,使用小鼠颈椎脱臼法是比较常见的一种方法,这种方法操作简单,并且能够迅速而有效地让小鼠死亡,减少小鼠的痛苦。
需要准备好所需的工具及小鼠。
在操作之前,需要将用于处死的工具进行消毒处理,以确保操作过程的卫生和安全。
可以选择使用针头或者金属棒作为工具,确保具有一定的硬度和锋利度,以便于在操作过程中快速而准确地实施颈椎脱臼。
接下来,将小鼠放置在一个固定的位置上,例如一个固定的台子或者悬挂的架子上,以确保小鼠在进行操作的过程中能够保持稳定。
然后,使用所准备好的工具,将其精准地放置在小鼠的颈部,同时用力向下压迫颈椎,直至颈椎脱臼,从而导致小鼠迅速死亡。
在操作过程中,需要保持手法准确、稳定,以确保能够尽快且有效地让小鼠死亡。
还需要注意观察小鼠的生理反应,如果发现小鼠有生命迹象或者痉挛等情况,应及时进行处置,以免引起不必要的痛苦和害怕。
在完成操作后,需要将小鼠的尸体妥善处理,可以选择进行焚化或者尸体处理,以确保不会对环境和人员造成任何污染或危害。
小鼠颈椎脱臼法是一种常见的实验动物处死方法,操作简单且有效,能够迅速让小鼠死亡,减少小鼠的痛苦。
但是在实施过程中,需要注意操作的准确性和稳定性,以确保操作的效果和安全性。
希望大家在使用小鼠颈椎脱臼法时能够遵守相关的规范和要求,确保实验工作的顺利进行。
第二篇示例:小鼠是实验室中常见的实验动物,用于进行各种科学研究和药物试验。
在进行实验过程中,有时候需要对小鼠进行处死,以获取实验数据或者进行解剖。
在实验室中,小鼠颈椎脱臼法是一种常见的处死方法。
本文将介绍小鼠颈椎脱臼法的操作步骤,注意事项以及该方法的优缺点。
操作步骤:1. 准备工作:首先需要准备好处死小鼠的场地和工具,确保操作环境干净整洁,避免交叉感染。
同时准备好合适大小的小鼠。

详细介绍对动物进行安乐死方法实验动物安乐死问题一直困扰着动物实验工作者,什么是安乐死技术或方法? 如何实施安乐死?怎样的安乐死方法才能既保证动物福利、符合伦理道德准则,又对实验者方便实用? 本文根据美国兽医学会(AVMA) 关于安乐死的评价准则阐述实验动物实施安乐死的若干问题。
1 什么是安乐死安乐死一词来源于希腊文“eu”,意思是“平安和有意义的死亡”。
平安死亡意味着微量的疼痛和痛苦(pain and distress)。
实验动物科学中的安乐死指的是对实验动物实施的人道处死( humane death)。
因为实验动物作为人类的替难者用于各种科学实验,人类有义务给予实验动物足够的尊敬,处死动物时尽可能减少动物的疼痛和痛苦。
安乐死技术很难做到完全没有疼痛和痛苦,但通过改善实施安乐死的环境条件和熟练掌握技术可以减少动物的痛苦。
从定义中可以看出,安乐死技术包含两个方面的内容,一是减少疼痛,二是减轻痛苦。
减少疼痛要求建立无疼痛死亡技术,减轻痛苦要求尽量减少动物感知(丧失意识)。
2 安乐死技术( 方法) 介绍药物方法:药物安乐死技术方法的原理有:直接或间接缺氧、生命功能的神经元抑制和大脑活动或生命功能神经元的直接破坏。
直接或间接缺氧。
可以在任何地方完成,并且可以依不同速率造成动物意识丧失。
没有疼痛和痛苦的死亡一定是意识丧失先于动作消失(肌肉活动消失),而动作消失不等于意识丧失和没有痛苦发生。
因此,导致肌肉麻痹而不能造成意识丧失的安乐死药物(例如去极化或非去极化的肌肉松弛剂,士的宁、烟碱、镁盐等)不能作为安乐死的单一方法。
生命功能的神经元抑制。
药物首先抑制大脑神经元随后导致动物死亡。
某些药物在实施过程中会使动物处于一种所谓激动躁狂期,可能发出叫声或肌肉收缩。
但这不是有目的的,随着意识丧失马上死亡,原因是心脏停止跳动造成呼吸中枢供氧不足。
大脑活动或生命功能神经元的直接破坏。
来源于直接冲击破坏大脑或大脑神经元去极化可以使动物马上丧失意识。

宠物的临终关怀和安乐死方式
在宠物的一生中,主人会陪伴它们度过许多美好的时光,然而我们也需要为它们的临终关怀做好准备。
当宠物年老或患病无法康复时,安乐死是一种让宠物免受痛苦的方式。
在进行安乐死之前,我们需要提供给宠物适当的临终关怀。
首先,在宠物生命的最后阶段,主人需要给予宠物更多的关爱和关注。
这包括定期检查宠物的身体状况,确保它们的舒适和健康。
如果宠物感到疼痛或不适,可以给予适度的止痛药物或其他治疗方式来减轻其痛苦。
同时,主人应该尽量陪伴宠物,不要让它感到孤独和恐惧。
其次,在做好临终关怀的同时,主人也应该考虑安乐死这一选择。
安乐死是一种人道的方式,可以减轻宠物的痛苦,让它们在安详的环境中离开。
在决定进行安乐死之前,主人需要咨询兽医师的意见,确认宠物的疾病情况和治疗效果。
如果宠物的病情已经无法挽回,主人可以考虑选择安乐死来结束宠物的痛苦。
最后,在进行安乐死时,主人需要选择合适的方式来进行。
兽医师通常会提供两种方式:一种是注射安乐死药物,另一种是使用一种气体来实现。
注射安乐死药物是比较常见的方式,通过注射药物让宠物在短时间内安详地离开。
气体方式则是让宠物在舒适的环境中缓缓入睡,最终停止呼吸。
主人可以根据自己和宠物的情况来选择合适的方式。
总之,宠物的临终关怀和安乐死是需要主人认真考虑和准备的事项。
在宠物生命接近尽头时,主人需要给予宠物更多的爱和关怀,并在需要的时候做出合适的决定,让宠物在尽可能的舒适和安详中度过最后的时光。
希望每个宠物都能得到最好的关怀和爱护,安详地离开这个世界。

第1篇 一、目的 为保障实验动物的福利,遵循人道主义原则,确保实验动物在处死过程中减少痛苦,特制定本规程。
二、适用范围 本规程适用于各类实验动物的安乐死操作,包括但不限于小鼠、大鼠、豚鼠、兔等。 三、操作原则 1. 尊重生命:尊重动物生命,确保实验动物在处死过程中受到人道对待。 2. 减少痛苦:遵循最小痛苦原则,确保实验动物在处死过程中痛苦降至最低。 3. 安全操作:严格遵守操作规程,确保操作人员安全。 四、操作方法 1. 颈椎脱臼(断颈)处死法 操作步骤: (1)用右手抓住实验动物尾部,将其提起; (2)左手拇指、食指用力向下按压实验动物头部及颈部; (3)右手抓住实验动物尾部,用力拉向后上方,造成颈椎脱臼; (4)实验动物立即死亡。 2. 断头处死法 操作步骤: (1)用左手按住实验动物背部,拇指夹住实验动物右腋窝,食指和中指夹住左前肢;
(2)右手用剪刀在实验动物颈部垂直将头部剪断; (3)实验动物因脑脊髓断离且大量出血死亡。 3. 击打头盖骨处死法 操作步骤: (1)抓住实验动物尾部并提起; (2)用木锤等硬物猛烈打击实验动物头部; (3)实验动物因大脑中枢遭到破坏,痉挛并死亡。 4. 放血处死法 操作步骤: (1)根据实验动物种类,选择合适的放血部位,如股动脉、颈动脉、腹主动脉或心脏;
(2)在轻度麻醉状态下,用剪刀或手术刀剪断或剪破实验动物相应血管; (3)放血至实验动物死亡。 五、注意事项 1. 操作人员应熟悉各种操作方法,并经过培训,确保操作熟练; 2. 操作过程中,应保持实验动物安静,避免过度刺激; 3. 操作时应佩戴防护用品,如手套、口罩等,确保操作人员安全; 4. 处死后的实验动物应妥善处理,避免污染环境。 六、监督与评估 1. 定期对操作人员进行培训,提高操作水平; 2. 对操作过程进行监督,确保遵循本规程; 3. 对操作结果进行评估,不断优化操作方法。 本规程自发布之日起实施,如有未尽事宜,可根据实际情况进行修订。 第2篇 一、目的 为了遵循人道主义原则,确保实验动物在处死过程中减少痛苦,本规程规定了安乐死的操作流程,旨在在不影响实验结果的前提下,使实验动物短时间无痛苦地死亡。 二、适用范围 本规程适用于所有实验动物的安乐死操作,包括鼠、兔、豚鼠等。 三、操作原则 1. 尊重生命:实验人员应充分认识到实验动物的福利,严格按照操作规程进行安乐死,避免不必要的痛苦。
http :∥www.yxllx.com E-mail :zgexllx@mail.xjtu.edu.cn 中国医学伦理学Chinese Medical Ethics 2011年4月Apr.2011第24卷第2期Vol.24No.2浅谈实验动物安乐死*朱玉峰,王元占**,杨培梁,弓莉,吴湘慧,曾俊岭,刘谋荣(南方医科大学南方医院实验动物研究中心,广东广州510515)〔摘要〕在动物实验过程中或结束后,通常会为免除或减轻动物痛苦、节约动物饲养成本、获取精确的实验数据等原因,对实验动物施行安乐死。
实施实验动物安乐死,应当由经过伦理道德、技术和心理培训的人员选择适当的仁慈终点,根据动物的品种、年龄、数量、身体状况及实验目的选择最合适的安乐死方法,使动物在无痛苦的状态下迅速失去意识,直至死亡。
〔关键词〕实验动物;动物伦理;动物福利;动物安乐死;医学伦理〔中图分类号〕R -052〔文献标识码〕A〔文章编号〕1001-8565(2011)02-0260-03On the Euthanasia of Laboratory AnimalsZHU Yu -feng ,WANG Yuan -zhan ,YANG Pei -liang ,GONG Li ,WU Xiang -hui ,ZENG Jun -ling ,LIU Mou -rong(Laboratory Animal Research Center of Nanfang Hospital of Nanfang Medical University ,Guangzhou 510515,China )Abstract :During or after animal experiments ,the animals are always euthanased for various reasons including avoiding or relieving animals'pain ,saving breeding cost ,and receiving accurate data.To make the laboratory ani-mals die while in the state of grace ,the researchers who have received moral ,technological and psychological train-ing select the appropriate method of euthanasia according to the animals'species ,age ,number ,and health condi-tion.Thus the animals may be induced to death rapidly without or with a minimum of pain ,fear and anxiety.Keywords :Laboratory Animal ;Animal Ethics ;Animal Welfare ;Animal Euthanasia ;Medical Ethics1实验动物安乐死的必要性1.1对动物施行安乐死是保护动物的需要动物实验是揭示生命现象的本质和规律、发展科学技术必不可少的方法和手段。
小鼠的处死以及器脏的剪取首先在本protocol前面先强调一下实验动物的福利。
我们应当尊重科学,尊重生命,要善待实验动物,即在饲养管理和使用实验动物过程中,要采取有效措施,使实验动物免遭不必要的伤害、饥渴、不适、惊恐、折磨、疾病和疼痛,保证动物能够实现自然行为,受到良好的管理与照料,为其提供清洁、舒适的生活环境,提供充足的、保证健康的食物、饮水避免或减轻疼痛和痛苦等。
处死实验动物时,须按照人道主义原则实验安乐死术。
处死现场,不宜有其他动物在场。
确认动物死亡后,方可妥善处置尸体。
小鼠处死最常用的方法:断颈法,也是小鼠痛苦程度最小的处死方法,符合动物福利学。
操作很简单:左手用镊子夹住小鼠的颈部,右手抓住小鼠尾巴,右手猛的用力牵拉,不可犹豫,最好能够一次成功,否则小鼠会很痛苦,但注意不要将头拉掉,这需要控制用力程度,既要讲颈椎拉断,还不能将头拉掉。
还有就是最好不要让小鼠看到同类的处死过程。
大鼠的处死的方式也是断颈法,但是因为大鼠体积较大,力道较猛,不利我们徒手操作,所以一般先将大鼠放入一个装乙醚的玻璃罐中,将其迷晕,再进行断颈处理。
小鼠脏器剪取先附上一些网上收集的小鼠解剖图,以供大家了解实验所需的脏器的位置。
1 肺 lung2 膈 diaphragm3 肝中叶 middle lobe of liver4 肝右叶 right lobe of liver5 小肠 small intestine6 股动、静脉 femoral artery and vein7 胸乳突肌 sternomastoideus muscle 8 胸腺 thymus9 心heart 10 肝左叶 left lobe of liver I1 胃 stomach 12 脾 spleen13 结肠 colon 14 膀胱 urinary bladder1 肺lung2 膈diaphragm3 肝中叶middle lobe of liver4 肝右叶right lobe of liver5 小肠small intestine6 股动、静脉femoral artery and vein7 胸乳突肌sternomastoideus muscle8 胸腺thymus9 心heart 10 肝左叶left lobe of liver I1 胃stomach 12 脾spleen 13 结肠colon 14 膀15 气管 trachea 16 咬肌 masseter muscle4 肝liver 5空肠jejunum 7 阴囊scrotum 13 脾spleen 14 结肠colon 16 阴茎penis 17 膀胱urinary bladder 18 股直肌rectus femoris muscle 19 回肠ileum 20 后肠系膜动脉posterior mesenteric artery 21 股薄肌gracilis musele1 肋弓costal arch2 小肠small intestine3 肾kidney4 阴道vagina5 脂肪fat6 肝liver7 卵巢ovary8 子宫uterus9 直肠rectum 10 膀胱一般实验所需的脏器在上面图中都能找到。
狗的安乐死和临终关怀狗是人类最忠诚的伙伴之一,陪伴我们度过了许多美好的时光。
然而,当狗狗年迈或身患终末疾病时,我们面临着一个艰难的决定——是否应该给予它安乐死和临终关怀。
本文将探讨狗的安乐死和临终关怀,以及我们应该如何面对这一难题。
一、狗的安乐死狗的安乐死,也被称为安乐死(euthanasia),是指在狗病重或身心痛苦无法缓解时,通过无痛苦的方式结束其生命。
这是一种人道的决定,旨在减少狗狗的痛苦和折磨。
1. 为何选择安乐死我们选择给予狗狗安乐死的主要原因是出于对其福祉、尊严和痛苦的关怀。
当狗狗年老、身体衰弱或患有终末疾病时,它们可能会承受剧烈的疼痛,无法正常进食、行走或享受生活。
通过安乐死,我们可以使狗狗摆脱这些痛苦,让它在安详的环境中离开,避免进一步的痛苦。
2. 进行安乐死的方式狗狗的安乐死可以通过两种常见的方式实施:注射安乐死药物和气体麻醉。
注射安乐死药物是较为常见的方式,通过给予狗狗安乐死药物,使其安然逝去。
而气体麻醉则是将狗狗置于充满安乐气体的空间中,让其逐渐失去知觉,并最终安静地离世。
二、狗的临终关怀除了安乐死,我们也应该给予狗狗临终关怀(end-of-life care)。
临终关怀的目的是让狗狗在离世之前能够感受到我们的关爱和温暖。
1. 提供舒适的环境在狗狗的临终阶段,我们应该尽可能地提供一个舒适、安静的环境。
这包括保持房间的温度适宜、确保床铺的柔软舒适、避免过多的噪音和刺激等。
我们还可以在狗狗旁边放置它喜欢的玩具或舒适的毛毯,以增加它的安全感。
2. 调整饮食和水分摄入狗狗在临终阶段往往对食物和水分的需求降低。
我们应该留意狗狗的食欲和口渴程度,并咨询兽医师的建议。
有时候,狗狗可能需要额外的营养补充或体外喂食,以确保它能够摄取充足的营养和水分。
3. 经常与狗狗互动无论狗狗的情况如何,我们都应该经常与其互动。
这体现了我们对它的关怀和爱意,同时也能给予它安慰和安心。
与狗狗互动的方式可以是轻轻抚摸它的毛发、与它交谈或坐在它的身旁。
小鼠处死方法小鼠是一种常见的实验动物,常常被用于实验室的科研工作中。
在实验完成后,需要对小鼠进行处死,以结束它们的生命。
正确的处死方法不仅可以减少小鼠的痛苦,还可以保证实验结果的准确性。
下面将介绍几种常见的小鼠处死方法。
1. 麻醉后处死。
将小鼠放入适当的麻醉箱中,使用合适的麻醉药物将其麻醉。
待小鼠完全麻醉后,可以选择以下方式进行处死:颈椎脱位,将小鼠放在坚硬的表面上,用手轻轻按住小鼠的头部,另一只手快速向下拉动小鼠的尾部,使颈椎脱位,达到迅速而无痛的处死效果。
离体心脏穿刺,在小鼠完全麻醉后,可以通过心脏穿刺的方式迅速处死小鼠,这需要专业技能和经验,不适合普通人操作。
2. CO2麻醉后处死。
将小鼠放入装有适量CO2气体的密闭容器中,缓慢增加CO2浓度,直至小鼠完全失去知觉和呼吸。
然后可以选择以下方式进行处死:颈椎脱位,同上述方法。
离体心脏穿刺,同上述方法。
3. 颈椎脱位处死。
如果没有麻醉药物和专业设备,也可以选择直接进行颈椎脱位处死。
将小鼠放在坚硬的表面上,用手轻轻按住小鼠的头部,另一只手快速向下拉动小鼠的尾部,使颈椎脱位。
这种方法需要技巧和经验,否则容易造成小鼠痛苦。
4. 离体心脏穿刺处死。
同样是一种需要专业技能和经验的处死方法,不适合普通人操作。
在小鼠完全麻醉后,可以通过心脏穿刺的方式迅速处死小鼠。
在进行处死操作时,需要注意以下几点:尽量减少小鼠的痛苦,选择合适的处死方法。
需要尽快将小鼠的尸体处理妥善,避免对环境和其他动物造成影响。
处死操作需要在专业人员的指导下进行,确保操作的安全和准确性。
总之,小鼠处死是实验工作中不可或缺的一环,选择合适的处死方法可以减少小鼠的痛苦,保证实验结果的准确性。
在进行处死操作时,需要谨慎选择合适的方法,并在专业人员的指导下进行操作,以确保操作的安全和准确性。
小型猪安死术与解剖(一)安死术很多实验最终需要处死动物取材,动物的处死需要遵循实验动物福利和伦理的要求,按照人道主义原则实施安死术。
对小型猪实施安乐死最好的一种方法是在应用镇静剂后建立静脉通道,然后超剂量静脉注射戊巴比妥钠(>150mg/kg)。
其他的安死术包括在麻醉的状态下静脉注射2mmol/kg的KCl或者放血处死,下面介绍麻醉后放血的方法。
1.操作程序(1)常规麻醉。
(2)将猪侧卧于解剖台(架)上。
(3)左手拉起一侧后肢,右手持手术刀在股三角部位做大切口,同时切断股动脉和静脉。
(4)用温水不断冲洗出血部位,防止凝血。
2.注意事项(1)确保足够的麻醉深度,避免猪的痛苦和挣扎。
(2)切开股动脉时会有血液喷出,可以用大方巾遮挡或下压放血侧猪腿。
(3)若放血不够充分,可以用同样方法剖开另一侧股动脉。
(二)解剖1.操作程序(1)解剖时通常让猪呈左侧卧位。
(2)以解剖刀深深地刺入右侧腋窝,扩展切口上至下颚,下到肛门(将刀插入皮下组织,向外切),掀开皮肤,切开右髋关节,打开后膝关节,折断后腿,检查腹股沟淋巴结。
(3)沿肋侧打开腹腔,再将腹侧切口延伸到盆腔,向腹侧掀开皮肤。
(4)刺穿膈肌并切开,切断肋骨,打开胸腔。
(5)检查腹部和胸腔,如果出现渗出、粘连、纤维或其他病理学变化,则采集组织作微生物学培养和组织病理学检查,此时也可以进行血液和尿液采集。
(6)原位打开心包并检查。
(7)将两侧下颚骨中央的连接组织切开,游离舌头,将舌头向外拉向头侧,切断舌骨,沿椎骨切开软组织,游离颈部和胸部脏器的连接。
(8)检查口腔,检查局部淋巴结,切开舌头,打开食管。
(9)触摸检查肺脏,打开气管和主要的气道,切去支气管淋巴结,打开心脏。
(10)检查胆囊是否肿胀。
(11)压缩直肠的粪便,结扎直肠,剪开直肠的远端,以钝性和锐性剥离游离整个肠道。
(12)切除双侧肾上腺,并以解剖刀切开。
(13)通过牵拉输尿管取出肾脏,剥开肾囊膜,切开至肾盂并检查,打开膀胱。
小鼠颈椎脱臼法处死的方法-概述说明以及解释1.引言1.1 概述小鼠颈椎脱臼法是一种常用于实验动物处死的方法,通过对小鼠进行颈椎脱臼,使其迅速失去生命体征。
这种方法通常被用于研究某些疾病模型的建立以及药物的评价等实验。
小鼠颈椎脱臼法相对简单易行且成本较低,因此在科研领域得到了广泛的应用。
在小鼠颈椎脱臼法中,实验者首先需要将小鼠固定在手术台上,并进行必要的麻醉操作以减少其痛苦。
接下来,实验者使用显微镜或其它细微的手术工具来准确地定位小鼠的颈椎位置。
然后,实验者将施加适当的力气或工具来实现颈椎的脱臼。
颈椎脱臼后,小鼠的呼吸和心跳将迅速停止,从而达到处死的效果。
小鼠颈椎脱臼法在实验动物处死中具有一定的优势和适用性。
首先,该方法操作简单并且操作时间短暂,对于实验者来说具有一定的易操作性。
其次,小鼠颈椎脱臼法相对于其它处死方法而言,成本较低,不需要昂贵的设备和药品等资源投入。
此外,该方法在研究特定疾病模型时,能够提供清晰、规范的处死结果,有助于实验数据的准确性和可比性。
然而,小鼠颈椎脱臼法在处死过程中也存在一些潜在的问题。
首先,由于手术操作的复杂性和小鼠个体的差异,操作者需要具备一定的技术和经验,以确保手术的准确性和成功率。
其次,这种方法对小鼠造成的痛苦程度和压力较大,需要实验者在操作过程中尽可能减少小鼠的痛苦。
综上所述,小鼠颈椎脱臼法是一种常用的实验动物处死方法,具有操作简单、成本低等优势。
然而,在使用该方法时需要注意减少小鼠的痛苦,并且实验者需要具备一定的技术和经验。
未来的研究还需要进一步探索和改进小鼠颈椎脱臼法,以提高操作的成功率和减少对小鼠的不适。
文章结构是指文章按照一定的逻辑和顺序进行组织和呈现的方式。
本文的结构如下:1. 引言1.1 概述在这一部分,我们将介绍小鼠颈椎脱臼法处死的方法并讨论其意义和重要性。
1.2 文章结构本文将按照以下顺序展开内容:首先介绍小鼠颈椎脱臼法,然后详细讨论该方法的处死过程。
附录C
啮齿类动物安乐死方法
(规范性附录)
C.1啮齿类动物安乐死方法操作要点
C.1.1注射巴比妥类药物(例如戊巴比妥钠)为啮齿类动物安乐死首选方法。
C.1.2操作人员应具备保定动物、注射及相关技术,并能识别动物死亡状态。
C.1.3断颈时,需以锐利的专业器械断颈。
C.1.414日龄以下啮齿类动物,不建议单独使用二氧化碳安乐死,需配合断颈。
C.2常用啮齿类动物安乐死方法见附表C.1。
附表C.1常用啮齿类动物安乐死方法
方法1-6日龄7-14日龄体重<200g体重>200g 戊巴比妥钠100-150mg/kg.IP,IV N Y Y Y
二氧化碳(CO2)N Y Y Y
氟烷、甲氧氟烷、异氟醚、安氟醚、七氟醚、地氟醚N Y Y Y
麻醉后放血N N Y Y
麻醉后断颈Y Y Y Y
低温麻醉后断颈Y N N N
清醒中断颈Y X X X
麻醉后颈椎脱臼N N Y Y
麻醉后注射氯化钾2meq/kg,IV N N Y Y
清醒中颈椎脱臼N N Y X
注:Y:推荐方法。
N:不推荐方法,但经IACUC同意后可使用的方法。
X:不推荐使用。
IP:腹腔注射。
IV:静脉注射。
6。