圈养和自由生活猕猴肠道微生物多样性研究
- 格式:doc
- 大小:14.04 KB
- 文档页数:4

肠道微生物相互作用的研究及体外肠道模拟系统的构建和应用肠道微生物能够增强机体免疫力,改善腹泻。
肠道是肠道微生物赖以生存的环境,肠道微生物的含量占整个人体微生物含量的78%,是临床研究的重点[1,2]。
能够影响肠道微生物的因素主要有4个方面:第一,人体自身的因素;第二,人体摄入的饮食;第三,细菌自身因素;第四,肠道微生物之间的相互作用。
而肠道微生物的相互作用最为主要、复杂,为科研研究的重点。
为了研究肠道微生物,我们引入了肠道微生物模拟系统。
体外肠道模拟模型是基于对人体体内消化道的仿生模拟而建立,用来培养单种或多种微生物的培养系统。
综上所述,为了研究肠道微生态系统,我们做了两方面工作:研究肠道微生物的相互作用,构建模拟肠道系统及应用。
具体实验如下:利用qPCR(Quantitative Polymerase Chain Reaction)检测肠道微生物:首先设计经过分离得到的鼠李糖乳杆菌、纳豆芽孢杆菌、保加利亚乳杆菌、干酪乳杆菌、粪肠乳杆菌、发酵乳杆菌、唾液乳杆菌的qPCR引物,保证了qPCR检测的特异性。
然后将上述肠道微生物混合培养,用得到的qPCR引物检测混合培养体系中每一种肠道微生物的活菌数。
结果为:发酵乳杆菌为4.1×107CFU/mL,唾液乳杆菌为2.2×107 CFU/mL,纳豆芽孢杆菌为0.8×107 CFU/mL,植物乳杆菌为2.3×107 CFU/mL,干酪乳杆菌为4.1×107 CFU/mL,保加利亚乳杆菌为2×107 CFU/mL,粪肠乳杆菌6.8×107 CFU/mL。
可得出结论:qPCR通过特异性引物设计提高了检测的特异性,qPCR能够在混合肠道微生物体系中精准检测一种或多种肠道微生物的种类和含量。
为后续开展研究肠道微生物的相互作用的研究提供技术保障。
肠道微生物相互作用的研究:将分离得到的8种肠道细菌即:鼠李糖乳杆菌、保加利亚乳杆菌、植物乳杆菌、干酪乳杆菌、粪肠乳杆菌、发酵乳杆菌、唾液乳杆菌、纳豆芽孢杆菌两两混合培养测活菌数。

恒河猴的遗传多样性和遗传进化恒河猴是生活在亚洲的猴子,是以印度次大陆为中心分布的一类灵长类动物,其科学名称为Macaca mulatta。
在中国,恒河猴也被称为猕猴,在印度则被称为拉尔猴。
恒河猴是研究灵长类动物进化和行为的重要对象,这得益于它们广泛分布和独特的生态定位,同时拥有丰富的行为文化和良好的机能。
恒河猴的遗传多样性对其进化发挥了重要的作用。
研究表明,恒河猴的遗传多样性非常丰富,主要是由于它们分布范围广、繁殖力强、迁移能力强等因素所致。
不同地理区域的恒河猴基因表达差异显著,这可能与环境压力、生存食物、生境限制等共同因素有关。
恒河猴是一种纯种的典型南亚猕猴,也是一类进化成功的动物。
在恒河猴的进化历史中,对机能基因的选择压力是非常强的。
在其野生环境中,游离氧自由基和其他环境压力对其生命健康产生了巨大的挑战,因此,恒河猴正在进化出一系列与氧代谢、代谢抗性、抗氧化、免疫应答有关等机能基因。
尽管机体的细胞代谢和基因表达等是由环境和基因之间的复杂调节网络所控制的,但是恒河猴不断在这个网络上进行基因组调节和修饰,进而适应并生存于复杂的自然环境中,实现了生物进化的辉煌。
恒河猴的遗传多样性和进化不仅对研究和探究人类进化史和祖先行为文化等方面有着重要的价值,而且还对现代医学、药物开发、食品生产等领域有着深远的影响。
首先,恒河猴是研究人类疾病模型的重要材料。
许多人类的癌症、心脏病、糖尿病等疾病都可以在恒河猴身上进行病理研究,推进人类医疗的新进展。
其次,恒河猴是研究生态环境变化和全球气候变化的重要指标。
恒河猴是热带的典型动物种类之一,在它们身上进行自然生态环境的监测可以更好地了解全球变化的情况。
最后,恒河猴的进化和生物多样性对保护自然环境和生态平衡也有重要意义。
恒河猴的栖息地及个体数量的下降会影响其生存繁殖能力,同时也会导致该地区生态固有物种数目的下降,最终影响整个地区的生态平衡。
总之,恒河猴的遗传多样性和进化对科学研究、医学疗效、环境保护等方面具有重要的意义。


圈养大熊猫肠道微生物分离、鉴定及细菌耐药性研究李蓓;郭莉娟;龙梅;汤纯香;周晓平;罗燕;邹立扣【期刊名称】《四川动物》【年(卷),期】2014(033)002【摘要】对中国卧龙自然保护区大熊猫研究中心-碧峰峡基地64只大熊猫分别采取粪样,用选择性培养基分离大肠杆菌、沙门氏菌,根据形态特征及16S rDNA序列对菌株进行鉴定;用PDA培养基分离真菌,真菌通用引物ITS4、ITS5进行扩增鉴定.采用K-B法(CLSI)药敏试验测试大肠杆菌和沙门氏菌对18种药敏纸片的耐药性.形态学与rDNA-ITS序列鉴定表明,共分离到真菌19株,鉴定为8个属.分离出大肠杆菌88株,沙门氏菌47株;大肠杆菌对各抗生素的耐药率为0%~ 35.22%,耐药率为TET(35.22%)、AML(12.50%)、S3(12.50%),共产生17种耐药谱,其中TET、AML-TET谱型占优势;沙门氏菌对各抗生素的耐药率为0%~42.55%,耐药率为TET(42.55%)、AML(40.43%)、S3(38.30%),也产生了17种耐药谱,AML和AML-TET谱型占优势.通过对细菌和真菌的分离鉴定以及细菌的耐药性试验,了解大熊猫肠道微生物与不同个体的关系,为研究大熊猫的营养及消化等奠定基础,对预防和诊断大熊猫肠道疾病,提高大熊猫的存活率提供依据.【总页数】6页(P161-166)【作者】李蓓;郭莉娟;龙梅;汤纯香;周晓平;罗燕;邹立扣【作者单位】四川农业大学都江堰校区微生物学实验室,森林资源保护与利用实验室,四川都江堰611830;四川农业大学都江堰校区微生物学实验室,森林资源保护与利用实验室,四川都江堰611830;四川农业大学资源环境学院,成都611130;四川农业大学都江堰校区微生物学实验室,森林资源保护与利用实验室,四川都江堰611830;四川农业大学资源环境学院,成都611130;中国保护大熊猫研究中心雅安碧峰峡基地,四川雅安625000;中国保护大熊猫研究中心雅安碧峰峡基地,四川雅安625000;四川农业大学都江堰校区微生物学实验室,森林资源保护与利用实验室,四川都江堰611830;四川农业大学都江堰校区微生物学实验室,森林资源保护与利用实验室,四川都江堰611830【正文语种】中文【中图分类】S852.65【相关文献】1.圈养猕猴胃肠道细菌的分离与初步鉴定 [J], 蒲忠慧;王雄清;陈希文;游章强;党明术;马缨2.圈养大熊猫肠道致病菌的分离与初步鉴定 [J], 陈希文;尹苗;王雄清;蒲中慧;马缨;陈紫娟3.华北地区圈养大熊猫粪便中产纤维素酶芽孢杆菌菌株的分离与鉴定 [J], 武红敏;郭威;郭晓军;周贤;朱宝成4.野外放归大熊猫和圈养大熊猫肠道正常菌群的研究 [J], 谭志;鲍楠;赖翼;张和民;李德生;刘成君5.一株大熊猫肠道厌氧纤维素菌的分离鉴定、系统发育分析及生物学特性的研究[J], 荣华;邱成书;胡国全;刘晓凤;张辉;费立松;徐恒;邓宇因版权原因,仅展示原文概要,查看原文内容请购买。
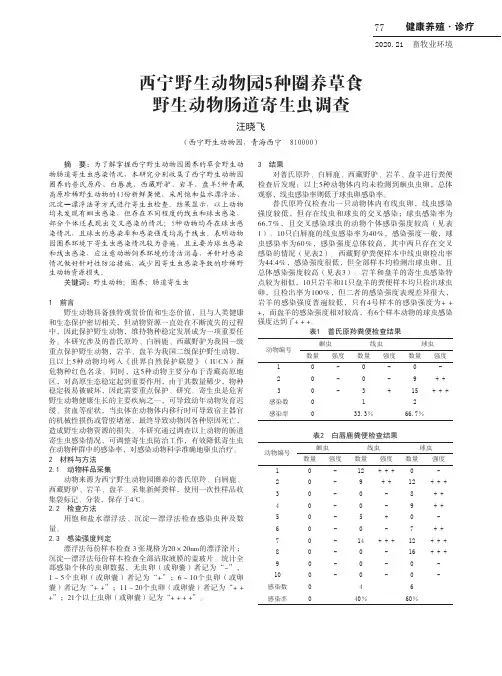
健康养殖·诊疗2020.21 畜牧业环境77摘 要:为了解掌握西宁野生动物园圈养的草食野生动物肠道寄生虫感染情况,本研究分别收集了西宁野生动物园圈养的普氏原羚、白唇鹿、西藏野驴、岩羊、盘羊5种青藏高原珍稀野生动物的43份新鲜粪便,采用饱和盐水漂浮法、沉淀—漂浮法等方式进行寄生虫检查。
结果显示,以上动物均未发现有蛔虫感染,但存在不同程度的线虫和球虫感染,部分个体还表现出交叉感染的情况;5种动物均存在球虫感染情况,且球虫的感染率和感染强度均高于线虫。
表明动物园圈养环境下寄生虫感染情况较为普遍,且主要为球虫感染和线虫感染,应注意动物饲养环境的清洁消毒,并针对感染情况做好针对性防治措施,减少因寄生虫感染导致的珍稀野生动物资源损失。
关键词:野生动物;圈养;肠道寄生虫1 前言野生动物具备独特观赏价值和生态价值,且与人类健康和生态保护密切相关,但动物资源一直处在不断流失的过程中,因此保护野生动物,维持物种稳定发展成为一项重要任务。
本研究涉及的普氏原羚、白唇鹿、西藏野驴为我国一级重点保护野生动物,岩羊、盘羊为我国二级保护野生动物,且以上5种动物均列入《世界自然保护联盟》(IUCN)濒危物种红色名录。
同时,这5种动物主要分布于青藏高原地区,对高原生态稳定起到重要作用,由于其数量稀少,物种稳定极易被破坏,因此需要重点保护、研究。
寄生虫是危害野生动物健康生长的主要疾病之一,可导致幼年动物发育迟缓、贫血等症状,当虫体在动物体内移行时可导致宿主器官的机械性损伤或管腔堵塞,最终导致动物因各种原因死亡,造成野生动物资源的损失。
本研究通过调查以上动物的肠道寄生虫感染情况,可调整寄生虫防治工作,有效降低寄生虫在动物种群中的感染率,对感染动物科学准确地驱虫治疗。
2 材料与方法2.1 动物样品采集动物来源为西宁野生动物园圈养的普氏原羚、白唇鹿、西藏野驴、岩羊、盘羊。
采集新鲜粪样,使用一次性样品收集袋标记、分装,保存于4℃。

四川动物Sichuan Journal of Zoology 2016,35(1):17-23收稿日期:2015-04-19接受日期:2015-06-23基金项目:四川省科技厅国际合作项目(2013HH0043畜禽温室气体排放量检测及减排技术研究)作者简介:王立志(1974—),男,博士,副教授,硕士生导师,主要从事动物营养学研究*通信作者Corresponding author ,E-mail :wanglizhi@aliyun.com DOI :10.11984/j.issn.1000-7083.20150140圈养大熊猫粪便中微生物多样性的研究王立志*,徐谊英(四川农业大学动物营养研究所,动物抗病营养教育部重点实验室,四川雅安625014)摘要:本试验采集了5只圈养成年大熊猫的新鲜粪便,用高通量测序技术,研究了大熊猫粪便中细菌和古菌的结构和组成。
试验结果表明:圈养成年大熊猫粪便细菌主要由变形菌门Proteobacteria (74.45%)、厚壁菌门Firmi-cutes (15.66%)、拟杆菌门Bacteroidetes (4.34%)、蓝藻门Cyanophyta /色球藻纲Chroococcophyceae (4.01%)等组成,其中变形菌门主要以埃希氏杆菌属Esherichia /志贺氏菌属Shigella (49.84%)为主;厚壁菌门主要以梭菌属Clostridi-um (4.65%)为主;拟杆菌门主要以稳杆菌属Empedobacter (3.51%)为主;蓝藻门全部为未分类的色球藻纲(4.01%)。
古菌主要由泉古菌门Crenarchaeota (55.99%)和广古菌门Euryarchaeota (42.33%)组成,其中优势古菌是热变形菌纲Thermoprotei (55.99%)中未分类的属和产甲烷菌属Methanogenium (24.70%)。
关键词:大熊猫;细菌;古菌;高通量测序中图分类号:Q959.8文献标志码:A文章编号:1000-7083(2016)01-0017-07Diversity of Microorganism in the Feces of Captive Giant PandasWANG Lizhi *,XU Yiying(Animal Nutrition Institute of Sichuan Agricultural University ,Key Laboratory for Animal Disease-ResistanceNutrition of Ministry of Education ,Ya ’an ,Sichuan Province 625014,China )Abstract :The structures and compositions of bacteria and archaeal in the feces of five adult captive giant pandas were studied using high-throughput sequencing technology.The results showed that the bacteria mainly consisted of Proteobacteria (74.45%of total sequences ),Firmicutes (15.66%),Bacteroidetes (4.34%),and Cyanophyta /Chroococcophyceae (4.01%)at the phylum level.Within the phylum Proteobacteria ,Escherichia /Shigella (49.84%)was the most abundant genus.Within the phylum Firmicutes ,Clostridium (4.65%)was the most abundant genus.Within the phylum Bacte-roidetes ,Empedobacter (3.51%)was the most abundant genus.Within the phylum Cyanophyta //Chroococcophyceae ,only the unclassified Chroococcophyceae (4.01%)was detected.The archaea mainly consisted of Crenarchaeota (55.99%)and Euryarchaeota (42.33%)at the phylum level ,and the unclassified Thermoprotei (55.99%)and Methanogenium (24.70%)were the two dominant memberships at the genus level.Key words :giant panda ;bacterium ;archaea ;high-throughput sequencing大熊猫Ailuropoda melanoleuca 是我国特有的珍稀濒危动物,属食肉目,其消化器官和消化酶至今仍保留着肉食性动物的特点,但它已高度特化为以竹类植物性食物为生的动物。

猴子喂养实验报告猴子喂养实验报告引言:猴子是人类最近的亲属之一,对于研究人类的行为和生理特征具有重要意义。
为了深入了解猴子的饮食习惯和营养需求,我们进行了一项猴子喂养实验。
本报告将详细介绍实验的设计、执行以及结果分析。
实验设计:我们选取了10只健康的恒河猴,将它们随机分为两组:实验组和对照组。
实验组的猴子将接受特殊饮食,而对照组的猴子将继续接受常规饮食。
为了保证实验结果的准确性,我们将两组猴子的性别、年龄和体重尽量保持一致。
实验执行:实验组的猴子将被喂养一种富含蛋白质、维生素和矿物质的特殊饮食,以模拟它们在野外觅食时的情况。
我们根据猴子的体重和营养需求,制定了每日的食谱。
食谱中包括新鲜水果、蔬菜、坚果和一定比例的蛋白质来源,如豆类和鸟蛋。
同时,我们还为猴子提供了足够的饮水。
对照组的猴子将继续接受常规饮食,即以野生水果、植物叶子和昆虫为主要食物。
我们将监测对照组猴子的饮食习惯,并记录其每日的食物摄入量。
实验结果:经过一段时间的实验观察和数据收集,我们得出了以下结论:1. 实验组猴子的体重增加速度较对照组更快。
这表明特殊饮食对猴子的生长发育具有促进作用。
2. 实验组猴子的毛发质量更好,毛色更亮丽。
这可能是由于特殊饮食中提供的维生素和矿物质对毛发的滋养作用。
3. 实验组猴子的精神状态更为活跃,活动能力更强。
这可能是由于特殊饮食中的蛋白质和能量提供了更多的营养。
4. 实验组猴子的免疫系统更为健康,罹患疾病的几率较低。
这可能是由于特殊饮食中的维生素和抗氧化剂对免疫功能的增强作用。
5. 对照组猴子的食欲和摄食量无明显变化。
这表明野生食物的营养价值已经满足了猴子的生理需求。
结论:通过这项猴子喂养实验,我们得出了特殊饮食对猴子生长发育、毛发质量、精神状态和免疫系统的积极影响。
然而,我们也要注意到实验的局限性,如样本数量有限、实验时间较短等。
因此,进一步的研究仍然是必要的。
此外,我们还要强调对野生动物的保护和尊重。

陈帮丹,魏 洪,黄亚励,等.猕猴桃果肉内生菌株鉴定及其抑菌活性分析[J].江苏农业科学,2018,46(12):71-75.doi:10.15889/j.issn.1002-1302.2018.12.016猕猴桃果肉内生菌株鉴定及其抑菌活性分析陈帮丹1,2,魏 洪1,黄亚励1,冯 丽1,李俞亭1,王芳胜1(1.贵州医科大学微生物学教研室/贵州省医科大学感染与免疫学实验室,贵州贵阳550025;2.贵州省六盘水市人民医院检验科,贵州六盘水553000) 摘要:采用PDA和LB培养基培养新鲜的猕猴桃果肉内生菌,用平板对峙法筛选出具有抑菌活性的内生菌株,用平板倾注法测定筛选出的内生菌不同浓度发酵液对标准菌株和临床菌株的抑菌活性,并基于形态特征、生理生化特性、电镜扫描结果、16SrDNA基因序列同源性分析、N-J法系统发育树鉴定菌株。
结果表明,从猕猴桃果肉中分离获得3株内生细菌,并初筛出1株抑菌活性较为明显的菌株,被鉴定为粪肠碱杆菌,能够抑制标准菌株大肠埃希氏菌、金黄色葡萄球菌及临床菌株中革兰氏阴性菌株大肠埃希氏菌、阴沟肠杆菌、肺炎克雷柏菌的生长,对革兰氏阳性菌株金黄色葡萄球菌、溶血性葡萄球菌、肺炎链球菌的生长无作用。
关键词:猕猴桃;果肉;内生菌;抑菌活性;粪肠碱杆菌;金黄色葡萄球菌;大肠埃希氏菌 中图分类号:S182 文献标志码:A 文章编号:1002-1302(2018)12-0071-04收稿日期:2017-10-10基金项目:贵州省科技合作项目[编号:(2015)7316、(2016)7367]。
作者简介:陈帮丹(1978—),女,贵州六盘水人,硕士,副主任技师,从事病原生物学研究。
E-mail:82433287@qq.com。
通信作者:魏 洪,博士,副教授,从事病原生物学及天然药物的开发研究。
E-mail:263676470@qq.com。
我国植物资源丰富,从植物中分离和提取具活性物质的内生菌可应用于新型活性物质的生产,制造环保、高效的新药。

用微卫星DNA标记技术建立猕猴遗传检测方法及对群体遗传多样性的分析随着生物学、医学和药学的发展,对标准化实验猕猴的需求量不断增加,建立并提供遗传背景清楚的标准化实验猕猴,将对生命科学研究结果的准确性和可靠性提供有力保障。
实验动物科学是生物医学乃至整个生命科学研究的基础和支撑条件,其发展和应用程度是衡量一个国家或地区科学技术水平高低的一个重要标志。
但是,从整体水平看,我国实验动物工作的发展还不平衡,标准化进程和水平也不一致,尤其是实验猕猴等大型实验动物,不管是资源丰厚程度,还是自身的研究力度都相当薄弱。
实验动物遗传质量监测是评价动物质量好坏的一个重要手段,其目的是为了验证各种动物品系应具有的遗传特性,检查是否存在杂合性、基因突变和遗传污染等,以确定被检对象是否符合该群体的生物学特性。
微卫星DNA标记技术由于其具有高度地灵敏性、特异性和多态性,方法简便、快速和廉价等特性,被广泛地应用到实验动物的遗传质量监测和遗传结构多样性分析中,是目前公认的物种遗传多样性评估的最佳分子遗传标记技术,也是实验动物遗传质量监测的重要手段。
本实验研究通过优化各猕猴微卫星DNA位点的复性温度和Mg2+浓度等PCR扩增反应体系条件,从100个位点中筛选出D1S1594、D1S533、D3S3045、D21S1246、D7S513、D6S493、D6S2419、D4S1645、D5S820、D5S1470、D5S1466、D14S255、D15S644、D10S611、D20S171、D12S372、D2S1333、D12S67、D2S146、D11S2002、D11S1352、D9S934、D17S1290、D17S791、D13S797、D18S536、D18S869、D19S571、D19S559和D16S403等30个具有多态性高、等位基因数多和染色体上分布均匀的微卫星DNA位点。
利用这30个多态性微卫星DNA位点对北京地区恒河猴种群的28只个体的遗传结构进行了监测分析,其等位基因数均在7条以上,最高的达到了11条。

收稿日期:2004202225 3通讯作者文章编号:049020756(2004)0621276204野外放归大熊猫和圈养大熊猫肠道正常菌群的研究谭 志1,鲍 楠1,赖 翼1,张和民2,李德生2,刘成君1,3(1.四川大学生命科学学院,成都610064;2.中国保护大熊猫研究中心,四川卧龙623006)摘要:对四川卧龙中国保护大熊猫研究中心1只放归亚成体大熊猫和3只圈养亚成体大熊猫肠道正常菌群的种类、数量和分布情况进行了比较研究,结果鉴定出17种细菌,发现放归大熊猫和圈养大熊猫肠道优势菌群均为肠杆菌、肠球菌和乳杆菌.与圈养大熊猫相比,大熊猫放归野外后,肠道菌群中的肠球菌增多,肠杆菌和乳杆菌的数量有所下降,芽孢杆菌和酵母菌的检出率增大.关键词:放归大熊猫;圈养大熊猫;肠道菌群中图分类号:Q93 文献标识码:A为更好地保护大熊猫这一中国特有的濒危物种,2003年7月四川卧龙中国保护大熊猫研究中心启动了大熊猫野外放归工程,这项工程旨在将人工圈养的大熊猫放归大自然,补充野生大熊猫种群数量,改善野生大熊猫遗传的多样性,同时进一步壮大圈养种群,达到长期保存这个物种的目的,这项实验的关键在于要提高圈养大熊猫在野外的存活率.研究表明,大熊猫趋于濒危的主要原因之一是疾病致死,在致死大熊猫的各种疾病中,以肠道疾病最为严重[1].因此,研究放归大熊猫和圈养大熊猫的肠道菌群的种类和分布对预防和诊断大熊猫胃肠道疾病,提高野外放归的存活率具有十分重要的意义.目前,圈养大熊猫的饲料主要由高蛋白高热量的精饲料构成,食谱丰富,营养水平高,而放归后大熊猫的主食将变为以竹子为主的高纤维低热量野生植物,食物结构发生很大转变.研究表明,大熊猫易因食物结构的转变而发生胃肠道疾病,并影响其生长发育,甚至造成死亡[1,2].本实验的目的就是要研究放归大熊猫和圈养大熊猫的肠道菌群变化,搞清变化规律,从而为放归大熊猫饲料的合理搭配,采取药物预防食物结构转换期肠道内病原菌的过度繁殖等措施提供重要的科学依据.1 材料和方法1.1 材料1.1.1 实验动物 亚成体大熊猫4只,分别为“祥祥”、“林蕙”、“林阳”、“福福”,由四川卧龙中国保护大熊猫研究中心饲养.其中熊猫“祥祥”于2003年7月8日放归野外放养场.另三只大熊猫为圈养,大熊猫“林蕙”于2003年10月12日被租借到泰国清迈.1.1.2 培养基 根据已报道的肠道常见菌,选择15种选择性培养基(见表1)进行培养.培养基配方参考《微生物培养基的制造与应用》[3]、《临床厌氧菌检验手册》[4]、熊德鑫(1986)[5]方法.其它普通培养基和生化实验培养基均按常规方法制备.1.1.3 试剂和溶液 革兰氏染色液,硝酸盐还原试剂,MR 试剂,V P 试剂等均按常规方法配制.1.2 方法1.2.1 采样 粪样采集从2003年7月7日开始,到目前共采样10次,分别在7月7日,7月8日,7月162004年12月第41卷第6期四川大学学报(自然科学版)Journal of Sichuan University (Natural Science Edition )Dec.2004Vol.41 No.6日,7月23日,8月1日,8月15日,9月14日,10月15日,11月15日,12月15日.用于厌氧培养的大熊猫新鲜粪便即刻放入装有10mL 厌氧运送培养基的厌氧转送管内[6].样品立即于当日开始进行细菌培养,计数,鉴定等工作.表1 培养基与培养对象培养基培养对象培养基 培养对象 肠杆菌培养基(MCA )肠杆菌科(Enterobacteriaceae )优杆菌培养基(ES )优杆菌属(Eubacterium )肠球菌培养基(EC )肠球菌(Enterococci )乳杆菌培养基(Cd )乳杆菌属(L actobacillus )葡萄球菌培养基(Sp )葡萄球菌属(S taphylococcus )梭菌培养基(Sd )梭菌属(Clost ridium )沙鲍氏培养基(Sb )酵母菌(Yeasts )消化球菌培养基(Ps )消化球菌(Peptococcus )芽孢杆菌培养基(BA )芽孢杆菌属(B acillus )双歧杆菌培养基(BLB )双歧杆菌属(Bif idobacterium )沙门氏菌培养基(HE )沙门氏菌属(S al monella )韦荣氏球菌培养基(Vs )韦荣氏球菌属(V eillonella )耶尔森氏菌培养基(S.S )耶尔森氏菌属(Yersinia )空肠弯曲菌培养基(CO )空肠弯曲菌(V ibrio Jeiuni )类杆菌培养基(Bds )类杆菌培养基(B acteroide )1.2.2 分离纯化、鉴定和计数 按检测对象的不同,分别在不同温度下进行需氧或厌氧培养[7](厌氧培养采用碱性焦性没食子酸法和姚伟邦等方法[8]进行培养).对分离的细菌纯培养物按伯杰氏系统鉴定手册和《常见细菌系统鉴定手册》[9]鉴定到属、种,并计数菌落数,用菌落形成单位(CFU )表示.2 结果2.1 肠道菌群的种类及分布对选择性培养基中出现的菌落进行细菌鉴定后共发现17种细菌.实验结果表明,圈养大熊猫和放归大熊猫肠道正常菌群中优势菌群为肠杆菌,肠球菌和乳杆菌,其中埃希氏大肠杆菌的检出率最高,为100%,其次是粪链球菌、乳杆菌及产气肠杆菌,检出率分别为97.2%、88.9%及72%.其它细菌的检出率较低,依次为小肠结肠炎耶尔森氏菌、葡萄球菌、芽孢杆菌、普通变形杆菌、肠炎沙门氏菌、酵母菌、双歧杆菌、空肠弯曲杆菌、小韦荣氏球菌、脆弱类杆菌(见表2).优杆菌、消化球菌、梭菌等未在受试粪样中检出.表2 卧龙放归大熊猫和圈养大熊猫粪便正常菌群检测结果细菌种类3细菌数量(Log10n /g )检出率(%)放归大熊猫圈养大熊猫放归大熊猫圈养大熊猫17.9±0.28.2±0.210010028.0±0.47.4±0.210096.137.0±0.77.9±0.29088.54 6.6±0.5 6.8±0.37069.25 6.7±1.0 6.7±0.55053.86 6.3±0.6 6.5±0.84038.57 6.8±0.67.1±0.760238 6.4±0.7 6.0±0.63026.99 6.7±0.6 6.4±0.63026.110 6.4±0.2 6.3±0.7401511 6.3±1.4 6.2±0.82019.212— 6.5±1.1015.413— 6.8±1.307.714— 6.90 3.8 31:埃希氏大肠杆菌(Escherichia coli );2:粪链球菌(S t reptococcus f aecalis );3:乳杆菌(L actobacillus sp.);4:产气肠杆菌(Enterobacter aerogenes );5:小肠结肠炎耶尔森氏菌(Yersinia enterocolitica );6:葡萄球菌(S taphylococcus sp.);7:芽孢杆菌(B acillus sp.);8:普通变形杆菌(Proteus vulgaris );9:肠炎沙门氏菌(S al monella enteritidis );10:酵母菌(Yeasts );11:双歧杆菌(Bif idobacterium );12:空肠弯曲杆菌(Cam pylobacter jejuni );13:小韦荣氏球菌(V eillonella parvula );14:脆弱类杆菌(B acteroides f ragilis )7721第6期谭志等:野外放归大熊猫和圈养大熊猫肠道正常菌群的研究2.2 放归大熊猫肠道菌群的变化 检查结果表明,放归大熊猫在放归一周后,与圈养大熊猫相比肠道正常菌群中优势菌群仍为肠杆菌,肠球菌和乳杆菌,但细菌数量和分布即开始发生了一定变化,表现在肠球菌数量明显增加,乳杆菌数量明显减少,肠杆菌数量有轻微减少,到采样后期,肠球菌数量超过肠杆菌;另外,放归大熊猫粪样中芽孢杆菌和酵母菌的检出率较高,分别为60%和40%.3 讨论 圈养大熊猫放归野外后,其食物结构由富含高蛋白、高脂肪以及高能量和各种维生素、电解质、微量元素的种类丰富的精饲料变成单一的以粗纤维为主、营养成分贫乏的竹子.其肠道微生态平衡会发生生理性波动[10].大熊猫在以精饲料为主食的圈养期间,肠道内的肠杆菌和乳酸菌的数量较多,通过肠杆菌和乳酸菌对多糖、蛋白质的分解,有利于肠道粘膜对乳糖、乳蛋白等高蛋白性食物的消化吸收和利用.在大熊猫以高纤维性的竹子为主食后,肠道微生态平衡发生波动,细菌种类和分布发生变化,肠球菌增多,有利于在厌氧环境下肠球菌对纤维性食物的分解和利用[11].同时,肠杆菌和乳杆菌的数量有所下降.Metchnikotl (1970)提出,乳杆菌有利于抑制肠道内条件性病原菌的生长和维持消化道中微生物菌群的平衡[2]. 值得注意的是,放归大熊猫粪样中芽孢杆菌和酵母菌等过路菌的检出率较高,这可能与圈养时卫生条件较好而放归时野外卫生条件较差有关.张志和等认为,抗生素的过量使用或联合使用会造成大熊猫胃肠道正常菌群比例失调,进而导致大熊猫慢性腹泻,表现在常住菌消失和少数过路菌参与,其中如酵母菌、乳8721四川大学学报(自然科学版)第41卷杆菌等菌的优势繁殖是大熊猫慢性腹泻的主要原因[7].因此,当长期圈养的大熊猫放归后,胃肠道菌群也会发生变化,芽孢杆菌和酵母菌等过路菌数量的增加会不会也导致大熊猫的胃肠道疾病成为了一个重要的课题,需进一步研究. 本实验中放归大熊猫厌氧菌的检出量和检出率较低,其原因客观上可能是由于放归大熊猫粪样在野外难以及时采集,相对于圈养大熊猫的粪样暴露于空气中的时间较长,而且大熊猫具有肉食性动物消化道结构的特点,如肠道较短、无盲肠[12],使得厌氧菌难以在其内定植. 研究发现,动物消化道中正常菌群的种类和数量只是暂时稳定的,它们受饮食、生活习惯、地理环境、年龄及卫生条件的影响而变动[2].圈养大熊猫放归野外后,在食物结构发生巨大变化的同时,其生活环境也发生了全面的改变,各种内外因素的变化可能导致大熊猫肠道生理功能的失调,造成某些条件性病原菌的入侵,就会导致机体的各种疾病发生.因此,在圈养大熊猫放归前应注意竹子饲料和精饲料的逐步替换,避免食物结构在短期内的急剧变化,必要时可使用药物预防食物结构转换期肠道内病原菌的过度繁殖;同时,在生活环境上也要尽量模拟野生环境,提高熊猫放归后的适应能力,避免胃肠道菌群比例失调.研究放归大熊猫肠道正常菌群的种类、分布和变化对于大熊猫野外放归工程具有重大意义,还需要积累更多的数据和进行更深入的研究,这将是一项长期的工作.参考文献:[1] 邹兴淮,曾鲁军,孙中武,等.东北林业大学学报,1998,26(1):53-56.[2] 熊焰,李德生,王印,等.畜牧兽医学报,2000,31(2):165-170.[3] 陈天寿.微生物培养基的制造与应用[M ].北京:中国农业出版社,1995.[4] 熊德鑫.临床厌氧菌检验手册[M ].北京:中国科学技术出版社,1994.[5] 熊德鑫.厌氧菌的分离和鉴定[M ].南昌:江西科学技术出版社,1986.[6] 苏建平,马纪平.中华医学检验杂志,1993,16(4):238.[7] 张志和,何光昕,王行亮,等.兽类学报,1995,15(3):170-175.[8] 姚伟邦,马晓莉.生物技术,1999,9(4):20-23.[9] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M ].北京:科学出版社,2001.[10] 杨景云主编.医用微生态学[M ].北京:中国医药科技出版社,1997.[11] 彭广能,熊焰,李德生,等.四川畜牧兽医,1999,26(5):26.[12] 陈玉村,翁妮娜,邹兴淮,等.东北林业大学学报,1998,26(4):36-38.The Study on the Normal Intestinal Microflora of the G iant PandaR eturned to Wild and the G iant Panda in C aptivityTA N Zhi 1,BA O N an 1,L A I Yi 1,ZHA N G He 2m i n 2,L I De 2sheng 2,L IU Cheng 2j un 1(1.College of Life Science ,Sichuan University ,Chengdu 610064,China ;2.China G iant Panda Protection and Research Center ,Sichuan Wolong ,623006,China )Abstract :A comparative study of the intestinal microflora ’s variety ,number and distribution of one young G iant panda returned to wild and 3young giant pandas in captivity in China giant Panda Protection and Re 2search Center ,Wolong Sichuan has been made.17species were identified.The study also found that the pre 2dominant intestinal florae of giant panda returned to wild and giant panda in captivity were enterobacteria ,en 2terococcus and pared with the giant panda in captivity ,the number of enterococcus of the giant panda returned to wild increased while the number of enterobacteria and lactobacillus decreased.At the same time ,the detection rate of B acill us sp.and yeasts increased.K ey w ords :giant panda returned to wild ;giant panda in captivity ;intestinal flora9721第6期谭志等:野外放归大熊猫和圈养大熊猫肠道正常菌群的研究。

动物营养学报2014,26(4):852-862C hi ne s e J our nal of A ni m al N ut r i t i ond o i :10.3969/j .i ssn .1006-267x.2014.04.004牛瘤胃与肠道微生物多样性的研究进展马 晨 张和平*刘彩虹 赵 洁(内蒙古农业大学,乳品生物技术与工程教育部重点实验室,呼和浩特010018)摘 要:牛瘤胃与肠道中的微生物区系共同影响着宿主的营养与健康。
宏基因组学与代谢组学的飞快发展,帮助研究者逐渐解析了牛体内这2大微生物群落的真实面貌。
二代高通量测序技术的出现,加快了挖掘瘤胃微生物与肠道微生物这2大基因库的速度,使得对其中功能基因的筛选更加高效。
牛共生微生物的研究不局限于基础科学,其成果在工业生产、食品安全检测、疾病诊疗与预防等许多领域都得到很广泛的应用。
本文综述了近些年来围绕牛的瘤胃和肠道共生微生物的研究报告,例举了大量瘤胃细菌、真菌、古菌的研究,宏基因组学的研究以及常见疾病诊疗预防的研究,旨在为养殖业与乳品行业生产中遇到的难题提供科学有效的指导。
关键词:牛;瘤胃微生物;肠道微生物;微生物多样性中图分类号:S823 文献标识码:A 文章编号:1006-267X (2014)04-0852-11收稿日期:2013-11-12基金项目:农业部现代农业产业技术体系建设项目(C A R S-37)作者简介:马 晨(1986—),女,内蒙古呼和浩特人,博士研究生,从事肠道微生物研究。
E -m a i l :m a c he n21@s i na .c om *通讯作者:张和平,教授,博士生导师,E-m a i l :he pi ngdd@vi p.s i na .c om牛是反刍动物,具有不同于其他食草动物的特殊生理结构,可食用难以被其他动物体所消化的纤维素物质,并通过自身的生物转化,将一些人类无法直接利用的营养物质合成动物性蛋白质(肉、奶),为人类所利用[1]。
猕猴饲养及常见病防治顾宏伟/南通濠河旅游园景建设有限公司 226001摘 要:猕猴属于灵长类动物,而灵长类动物和人类的遗传性相似度极高,是人的近亲。
因此,猕猴的饲养问题十分重要,需要有专门的工作人员对其进行喂养。
但是,当下猕猴的常见病种类有很多,这些病对猕猴的生长发展极为不利,需要人们加强重视及时防治。
本文首先阐述猕猴的饲养工作,然后分析其常见病种类并且提出具体的防治措施。
关键词:猕猴饲养;常见病;预防治疗猕猴作为珍贵的灵长类动物不一样,不仅对我国生命科学领域来说十分重要,对于整个人类文明来说也是十分的宝贵的。
因此要从根本上重视猕猴的饲养工作,确保猕猴能在健康中成长。
1 猕猴饲养工作的相关阐述1.1 饲养管理 野外的猕猴主要是吃树叶和各种野果,但是人工饲养的猕猴主要以饲料、水果和各种蔬菜为主要饮食,而且不同种类食物的比例是固定的。
这就要求工作人员要有相关方面的理论知识,要注重营养搭配。
同时,除了饮食方面之外,对于这种规模化饲养的猕猴还要注重交配工作。
每个猴舍里放多少只雌猴和雄猴都是固定的,一般现在都是一个猴舍内就只饲养一只雌猴和一只雄猴。
1.2 饲养场的建设 科学的饲养场建设是喂养猕猴的首要条件。
饲养场的选址、规模、结构以及通风因素等都是在建设过程中需要重点关心的方面。
饲养场的所在地既要靠近城市,又要与居民生活区保持一定的距离。
另外,交通便利、水源充足以及地势宽广也是选址的重要参考因素。
同时,在饲养场内要设置生活区、综合办公区、进出口检疫区以及废物处理区。
不同区域之间的结构划分应该合理,并且距离适中。
2 猕猴常见病种类及具体防治措施2.1 病毒性传染病及其防治 病毒性传染病是在猕猴种群中最常见的病种之一,这种病来势凶猛且传染性极强。
想要防治这种病毒性传染病,首先要做好的就是猕猴生活区域的清洁工作。
要对饲养环境进行定期的消毒,例如门口设置消毒池、供应充足的消毒水、用消毒液洗刷猕猴的生活用具等。
其次是重视猕猴的引种工作。
猕猴养殖方法和注意事项猕猴,又称猢狲,是一种性情活泼、机灵聪慧的灵长类动物,常被人们喜爱和关注。
近年来,猕猴养殖逐渐成为民众的兴趣和业余爱好。
但是,养殖猕猴需要一定的技术和知识,并且有一些重要的注意事项需要遵守。
本文将深入探讨猕猴养殖的方法和注意事项,帮助读者了解如何科学、良好地养殖猕猴。
首先,我们来探讨一下猕猴的养殖方法。
猕猴是群居动物,习性相对复杂,所以养殖时需要提供合适的场所和合理的环境。
饲养箱的选择至关重要,应该选择空间宽敞,通风良好且具备良好居住环境的箱子。
同时,也需要保证适宜的温度和湿度,可以适当安装加热设备和湿度控制器来维持适宜的生存环境。
其次,由于猕猴是杂食性动物,所以养殖时需要提供丰富的饮食。
主要食物包括新鲜水果、蔬菜、坚果和适当的动物蛋白质。
水源也是不容忽视的,应该保证猕猴随时能够获得清洁饮用水。
此外,应注意不要给猕猴过多或过少的食物,遵循适量原则来养殖,确保其营养均衡。
除了合理的饲养环境和适宜的饮食,猕猴养殖还需要注重日常护理。
首先是定期除虫和防疫,这是保证猕猴健康的重要手段。
可以咨询兽医师,制定科学的防疫计划。
此外,定期的身体检查也是必要的,以便早发现并处理猕猴的健康问题。
如果需要进行繁殖,还需要掌握合适的配种时机和方法,以提高繁殖成功率。
与养殖方法相关的注意事项同样重要。
首先,猕猴是属于野生动物,所以在养殖之前需要充分了解相关法规和执照申请程序。
此外,养殖猕猴需要投入较大的经济和时间成本,并且需要具备一定的专业知识,因此需要认真评估自身的条件和能力。
其次,要合理规划饲养猕猴的数量,避免养殖过多导致过量养殖和滥竽充数的情况。
要避免过度扩大养猴规模,造成资源浪费和环境负荷过大。
同时,还要避免将猕猴随意放生或交易,遵守野生动物保护法律法规,维护合理的猕猴养殖产业发展。
最后,需要强调的是,养殖猕猴是一项需要长期坚守的任务。
需要投入足够的热情和注意力,维持稳定的养殖环境和生活规律,与猕猴建立良好的互动关系。
草食动物肠道微生物多样性及生态学机制研究动物的肠道内含有大量微生物,这些微生物有着重要的生理作用。
在肠道中,微生物可以帮助动物消化食物、合成营养物质、维持免疫系统平衡等。
因此,对肠道微生物的研究具有重要的意义。
本文将从草食动物肠道微生物的多样性和生态学机制两个方面探讨这一问题。
一、草食动物肠道微生物多样性草食动物的食谱主要由植物组成,多样性较高。
这种广泛的天然食物来源可能会导致草食动物肠道内微生物多样性的提高。
实际上,人们对草食动物(象、鹿、马等)肠道内微生物多样性的研究发现,其多样性确实较高。
各类禾本科植物(草、麦、稻米等)均含有膳食纤维,这些膳食纤维的消化需要微生物协作完成。
草食动物的肠道内也有较高密度的微生物,它们可以产生多种酶类、酸、气体等,帮助动物消化膳食纤维。
此外,对策略性以草叶为食的昆虫的肠道微生物的研究表明,这些昆虫有着较高的肠道微生物多样性,这些微生物都与消化膳食纤维相关联。
昆虫肠道微生物多样性比动物肠道微生物多样性更高,这反映了昆虫的食物来源也更加多样化。
肠道微生物多样性还与肠道在生态系统中的地位有关。
草食动物中老龄动物的肠道微生物多样性明显高于青年动物,这可能是因为老龄动物对环境中的微生物有更高的依赖,性格更加稳定。
此外,野生草食动物的肠道内微生物与不同季节和不同地区的微生物多样性存在巨大差异。
这表明环境条件和食物来源等因素对草食动物肠道微生物多样性的形成也有着很大的影响。
二、草食动物肠道微生物生态学机制草食动物肠道中的微生物生态在一定程度上是稳态的。
肠道微生物生态稳定性的维持,涉及很多生态学机制。
首先,肠道狭窄潮湿的环境和较低的氧浓度为肠道微生物间的生存创造了最佳的生态环境。
肠道微生物能够形成一种微生态,利用彼此的代谢产物实现资源的深度共享。
其次,动物肠道中的微生物生态稳定性得益于肠道中不同微生物种群间的互相影响和相互作用。
这种胃肠道微生态的稳定性,以群体水平的协同和平衡为基础。
圈养和自由生活猕猴肠道微生物多样性研究动物的肠道是一个复杂的生态系统,其中栖息着丰富、多样的微生物。
越来越多的研究表明,肠道微生物(gut microbiota)在动物的营养消化吸收、能量代谢平衡、免疫防御功能以及行为等诸多方面有着重要的影响,是动物适应性演化的重要特征,与栖息环境、食物资源等密切相关。
然而,伴随人类活动产生的全球以及局域性变化,不仅可以直接、间接影响动物的栖息环境、食物资源、生理生态以及行为等,还可以通过改变肠道微生物群落而影响动物行为、健康等方面。
因此,探究不同环境条件下,动物尤其是野生动物的肠道微生物群落组成与多样性,不仅有助于理解物种对变化环境的响应,还
可以为圈养动物、野生动物尤其是珍稀濒危动物保护与管理提供依据。
猕猴(Macaca mulatta)是世界上自然分布最广泛的非人灵长类物种,在生理、生化、行为等方面与人类有着诸多相似之处,不仅是重要的实验动物,亦是诸如动物园、野生动物园以及生态旅游区内重要的观赏动物。
为探究不同环境条件对猕猴肠道微生物多样性的影响,于2017年1月,采用非损伤性取样的方法,基于二代高通量测序技术,借助生物信息分析技术与平台,以分析圈养(captive)和自由生活(free-ranging)猕猴的肠道微生物群落组成与多样性,旨在深化认识不同环境对猕猴肠道微生物的影响,以便为动物园、野生动物园、生态旅游区等处的猕猴管护等提供科学依据。
主要研究内容与结果如下:1)圈养猕猴肠道微生物多样性研究以圈养于郑州市动物园“猴山”的猕猴为研究对象,于2017年1月10日,分别采集上、下午新鲜粪样各20份,利用商业DNA提取试剂盒提取与质控,随机选取质控合格的上、下午样品各10份,然后,借助二代测序平台进行高通量测序,经生物信息学分析,
探究圈养猕猴肠道微生物群落组成与多样性。
结果显示:1)物种组成分析:上、下午组共有741个OTU、160属、57科13门,其中上午组独有28个OTU、2个特有属,而下午组仅有6个特有OTU;2)α多样性分析:上午组OTU水平上的丰富度Sobs指数、多样性Shannon指数与均匀度Shannon even指数均显著高于下午组,而在其他水平的各指标中,仅丰富度Sobs指数在上午组的纲和科水平上显著高于下午组;3)样本分组分析:在OTU、属、科和门水平上ANOSIM分析显示上午组和下午组无显著差异;4)核心菌群分析:门水平上厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)的比例约为86%,科水平上胃瘤菌科(Ruminococcaceae)和普雷沃氏菌科(Prevotellaceae)占主导,属水平上因普氏菌属(Prevotella)占优势而被归为“普氏菌肠型”;5)组间物种差异分析:OTU水平上,上午组的OTU299、OTU691、OTU705等的百分比显著低于下午组,而OTU177则相反;属、科水平上,下午组的乳杆菌属(Lactobacillus)、乳杆菌科(Lactobacillaceae)的百分比均显著高于上午组;门水平上,群落中柔膜菌门(Tenericutes)百分比上午组显著高于下午组。
2)自由生活太行山猕猴肠道微生物多样性研究以活动于河南省济源市五龙口地区的太行山猕猴WLK-1群为研究对象,于2017年1月11日至15日,分别采集成年雌性、成年雄性个体的新鲜粪便样,随机选取经DNA提取、质控合格的样品各10份,然后,借助二代测序平台进行高通量测序,经生物信息学分析,探究自由生活太行山猕猴肠道微生物群落组成与多样性。
结果显示:1)物种组成分析:成年雌性组和成年雄性组共有845个OTU,分别隶属于185属、62科、14门,其中前者特有11个OTU、1个属、1个科和1个门(Fusobacteria),而后者特有37个OTU、1个属;2)α多样性分析:成年雌性组OTU、属、科和门水平上的丰富度
Sobs指数、多样性Shannon指数与均匀度Shannon even指数与成年雄性组均无显著差异;3)样本分组分析:在OTU、属、科和门水平上ANOSIM分析显示成年雌性组和成年雄性组无显著差异;4)核心菌群分析:门水平上厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)占据约84%,科水平占优势的为胃瘤菌科(Ruminococcaceae)和普雷沃氏菌科(Prevotellaceae)共占约43%,属水平上因
普氏菌属(Prevotella)占优势而被归为“普氏菌肠型”;5)组间物种差异分析:科水平上,成年雌性组拟杆菌目S24-7组(Bacteroidales_S24-7_group)的百分比显著高于成年雄性组;门水平上,成年雄性组蓝细菌门(Cyanobacteria)百分比显著高于成年雌性组。
3)圈养与自由生活猕猴肠道微生物多样性比较基于圈养、自由生活猕猴肠道微生物群落分析发现,虽然圈养上午组和下午组组间、自由生活雌性组和雄性组组间存在一些物种组成上的一定差异,但两种条件下各自组间差异性均不显著,因此,本研究将圈养条件和自由生活条件分别划为“圈养组”和“自由组”。
对圈养组和自由组猕猴肠道微生物群落组成与多样性比较分析发现:1)物种组成分析:圈养组和自由组共有个1064个OTU,分别隶属于191属、66科、14门,其中前者特有60个OTU、3个属和2个科,而后者特有95个OTU、7个属和1个科;2)α多样性分析:圈养组除在属水平上丰富度Sobs指数显著低于自由组外,其余OTU、属和门水平的丰富度Sobs指数、多样性Shannon指数与均匀度Shannon even
指数等均无显著性差异;3)样本分组分析:除门水平上ANOSIM分析显示分组无显著性差异外,在OTU、属和科水平上ANOSIM分析显示圈养组与自由组均存在显著差异;4)核心菌群分析:门水平上厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)约占总肠道微生物的85%,科水平占优势的为胃瘤菌科
(Ruminococcaceae)和普雷沃氏菌科(Prevotellaceae)共占约44%,而属水平上
因普氏菌属(Prevotella)占优势而被归为“普氏菌肠型”;5)组间物种差异分析:OTU水平上,圈养组的OTU669、OTU957、OTU1034、OTU668、OTU1003和OTU361等的百分比显著高于自由组,而OTU2877、OTU958、OTU806、OTU181、OTU92和OTU809则相反;属水平上,除圈养组的部分未清楚划分类群的百分比显著高于自
由组之外,自由组的琥珀酸弧菌属(Succunivibrio)和巨型球菌属(Megasphaera)等的百分比均显著高于圈养组;科水平上,自由组的毛螺菌科(Lachnospiraceae)、韦荣球菌科(Veillonellaceae)和琥珀酸弧菌科(Succinivibrionaceae)等显著
高于圈养组,而消化链球菌科(Peptostreptococcaceae)则相反;门水平上,群落
中拟杆菌门(Bacteroidetes)、柔膜菌门(Tenericutes)、疣微菌门(Verrucomicrobia)和硝化螺旋菌门(Lentisphaerae)百分比圈养组显著高于自
由组。
综上研究结果显示,两种环境条件下,猕猴肠道微生物菌落具有较高的一致性,即存在较强的保守性,然而亦存在一定程度的可塑性,即环境条件差异会导致猕猴肠道微生物组成在保持较强稳定性的基础上发生一定的差异。
本研究初步分析了环境条件差异对猕猴肠道微生物群落组成和多样性的影响,然而这些影响是否会对猕猴种群,尤其是对野生种群带来积极、负面影响等问题有待深入研究。