异硫氰酸苯酯衍生物的合成.
- 格式:pdf
- 大小:166.19 KB
- 文档页数:4
![四硫脲基杯[4]芳烃衍生物的合成](https://uimg.taocdn.com/8e0ba0b1fd0a79563c1e72d7.webp)

18种天然氨基酸分析迪马科技摘要氨基酸组成测定是蛋白质组学、食品质量检测以及药品质量检测中的重要分析项目。
本文分别以异硫氰酸苯酯、2,4-二硝基氟苯作为衍生剂对蛋白质水解液和游离氨基酸注射液进行衍生,使用Diamonsil AAA柱250×4.6 mm,5 μm,梯度洗脱进行分离,能够满足19种天然氨基酸的分析,各组分分离度较高、定量结果准确而稳定。
AbstractThe amino acid determination is an important analysis project in proteomics, food and drug quality testing.The method determination of 19 nature amino acid in protein hydrolyzed solution and free amino acid injection, the derived reagent is phenyl isothiocyanate (PITC) and 1-Fluoro-2,4-dinitrobenzene. The column is Diamonsil AAA (250 × 4.6 mm, 5 μm), gradient elution, the results are accurate and stable.引言从化学角度讲,同时含有一个或多个氨基和羧基的脂肪酸均可称为氨基酸。
自然界存在300多种氨基酸,但构成天然蛋白质的氨基酸只有20种,这20种氨基酸又称为天然氨基酸。
天然氨基酸分析是食品、饲料和药品分析的重要项目。
目前氨基酸分析常常采用这样两种方式:离子交换色谱分离-柱后衍生和柱前衍生-反相色谱法分离。
后者以操作灵活、费用低廉而被广泛应用。
在柱前衍生-反相色谱法分离中,异硫氰酸苯酯(PITC)和2,4-二硝基氟苯(DNFB)均可与一级胺、二级胺反应,是理想的柱前衍生剂。

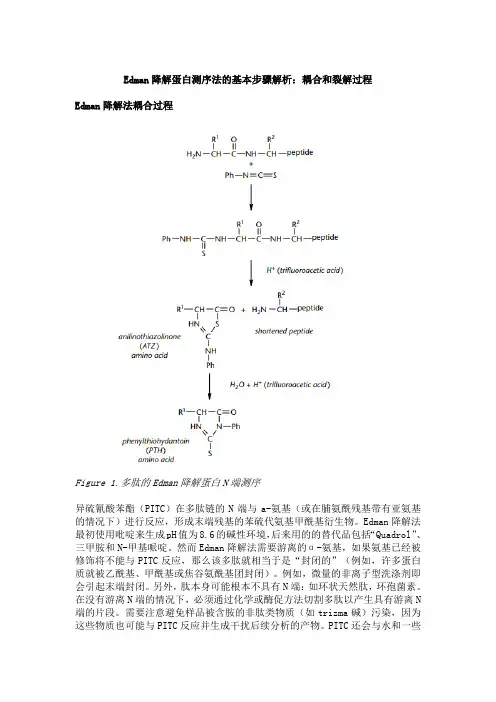
Edman降解蛋白测序法的基本步骤解析:耦合和裂解过程Edman降解法耦合过程Figure 1.多肽的Edman降解蛋白N端测序异硫氰酸苯酯(PITC)在多肽链的N端与a-氨基(或在脯氨酰残基带有亚氨基的情况下)进行反应,形成末端残基的苯硫代氨基甲酰基衍生物。
Edman降解法最初使用吡啶来生成pH值为8.6的碱性环境,后来用的的替代品包括“Quadrol”、三甲胺和N-甲基哌啶。
然而Edman降解法需要游离的α-氨基,如果氨基已经被修饰将不能与PITC反应,那么该多肽就相当于是“封闭的”(例如,许多蛋白质就被乙酰基、甲酰基或焦谷氨酰基团封闭)。
例如,微量的非离子型洗涤剂即会引起末端封闭。
另外,肽本身可能根本不具有N端:如环状天然肽,环孢菌素。
在没有游离N端的情况下,必须通过化学或酶促方法切割多肽以产生具有游离N 端的片段。
需要注意避免样品被含胺的非肽类物质(如trizma碱)污染,因为这些物质也可能与PITC反应并生成干扰后续分析的产物。
PITC还会与水和一些难以在反应中被完全排除的其他分子发生反应,因此试验中总会发现一些副产物,例如二苯硫脲。
尽量减少副反应有助于提高化学反应和后续分析的效率。
与过去的手动测序法相比,自动测序法的优势之一就是可以做到这一点。
Edman降解法裂解过程在强酸存在的情况下,裂解发生在第一个肽键上,从而得到减去第一个碱基的肽段和释放的第一个anilinothiazolinone (ATZ)形式的残基。
洗掉其他反应物和释出的残基,缩短的肽段就可以通过另一轮偶联和裂解而释放出第二个残基,依此类推,直到最后一个氨基酸残基被释出。
目前,该裂解反应使用的是三氟乙酸(TFA)。
因为要使多肽链内各点的酸水解最小化,需要尽可能的制造无水环境。
这些都达成之后,可生成一个新的N端,从而对其进行测序。
将这种酸裂解最小化可促使序列运行更持久、更清晰。
Edman降解法残基转化过程通过有机溶剂,乙酸乙酯或氯丁烷,萃取,将ATZ残基与肽分离,然后将其向更稳定的苯硫代乙内酰脲(PTH)形式转化,以更好的进行分析。

迪马科技18种天然氨基酸分析说明(异硫氰酸苯酯柱前衍生法)分析条件色谱柱: Diamonsil AAA 250×4.6 mm ,5 μm (Cat.#:99751) 流动相A: 0.05 mol/L 乙酸钠水溶液(冰乙酸调节pH 值为6.50 ± 0.05) 流动相B:甲醇 : 乙腈 : 水=20 : 60 : 20(V : V : V) 流速:1.0 mL/min 检测波长: UV 254 nm柱温: 45 ℃进样体积:10 μL 样品溶液: 量取200 μL 19种氨基酸+NH 3混合使用液(胱氨酸浓度为 1.0mmol/L ,其他氨基酸浓度为2.0 mmol/L),置于1.5 mL 塑料离心管中,混匀,再加入100 μL 1 mol/L 三乙胺-乙腈溶液和100μL 0.2mol/L 异硫氰酸苯酯-乙腈溶液,混匀,室温反应1 h ,然后加入400μL 正己烷,旋紧盖子后剧烈振荡5~10 s ,静置分层,取200μL 下层溶液与800 μL 水混合,0.22 μm 针式过滤器过滤,待分析。
梯度程序时间/min0 39 40 45 46 60 流动相A/%95 52 0 0 95 95 流动相B/%5 48 100 100 5 5迪马科技18种天然氨基酸、正亮氨酸以及NH 3(氨)-异硫氰酸苯酯衍生物的液相色谱图10203040Time (min)12345678910111213141516171819201 Asp(天冬氨酸)2 Glu(谷氨酸)3 Ser(丝氨酸)4 Gly(甘氨酸)5 His(组氨酸)6 Arg(精氨酸)7 Thr(苏氨酸)8 Ala(丙氨酸)9 Pro(脯氨酸) 10 NH 3(氨) 11 Tyr(酪氨酸) 12 Val(缬氨酸) 13 Met(蛋氨酸) 14 Cys(胱氨酸) 15 Ile(异亮氨酸) 16 Leu(亮氨酸) 17 Nle(正亮氨酸) 18 Phe(苯丙氨酸) 19 Trp(色氨酸) 20 Lys(赖氨酸)色谱柱使用注意事项1、预处理:进行氨基酸分析前,首先用15%甲醇水溶液和纯甲醇冲洗HPLC 系统,流速设定在0.5-1.0 mL/min 范围内,冲洗体积均是60 mL ;然后将氨基酸专用柱与HPLC 系统连接,用30 mL 纯甲醇和15 mL15%甲醇水溶液冲洗色谱柱和系统,流速设定在0.5-1.0 mL/min 范围内;最后用流动相进行平衡,直到基线稳定。

百泰派克生物科技
蛋白质测序Edman
Edman降解法是瑞典化学家于1967年发明的一种测序方法,用于蛋白质或多肽N
末端序列分析,基于Edman降解法的测序仪也是第一台蛋白质测序仪。
Edman降解法进行蛋白质或多肽N末端序列分析是一个循环式的化学反应过程,主
要包括3个主要步骤:第一步就是发生偶联反应,利用异硫氰酸苯酯(PITC)与蛋白质多肽的N末端氨基酸残基结合形成苯氨基硫甲酰(PTC)衍生物,即PTC-肽。
然后在三氟乙酸的作用下进行环化裂解,利用三氟乙酸处理PTC-肽,使N末端氨
基酸被选择性的切断,释放出该氨基酸残基的噻唑啉酮苯胺(ATZ)衍生物。
最后
利用该ATZ-衍生物的有机溶液从反应液中萃取出来,ATZ-衍生物不稳定,需通过
酸化处理将其转化为稳定的苯乙内酰硫脲(PTH)衍生物,即PTH氨基酸,然后对
该氨基酸进行鉴定。
这一系列反应如此循环,每次循环鉴定一个切下的末端氨基酸,直到完成N末端氨基端的序列测定。
百泰派克生物科技提供基于Edman法的蛋白质N末端测序一站式科研技术服务,用于蛋白或活性多肽N端序列分析,还可用于确认重组蛋白表达情况,如是否完整表达、表达过程是否发生断裂以及N端序列是否发生修饰等。
百泰派克生物科技还可根据需求提供定制化技术服务,欢迎免费咨询。

氨基酸分析解决方案序列号:L009 作者:孔维超,顾春艳摘要氨基酸组成测定是蛋白质组学、食品质量检测以及药品质量检测中的重要分析项目。
由于该分析项目涉及的化合物种类繁多,且需要柱前或柱后衍生技术,对分析方法和分析产品具有较高要求。
迪马科技应用实验室分别以异硫氰酸苯酯、2,4-二硝基氟苯作为衍生剂对蛋白质水解液和游离氨基酸注射液进行衍生,然后使用Diamonsil AAA柱进行分离,能够满足19种天然氨基酸的分析,各组分分离度较高、定量结果准确而稳定。
引言从化学角度讲,同时含有一个或多个氨基和羧基的脂肪酸均可称为氨基酸。
自然界存在300多种氨基酸,但构成天然蛋白质的氨基酸只有20种,这20种氨基酸又称为天然氨基酸。
氨基酸通过氨基和羧基形成肽键(酰胺键)相互联结成多肽和蛋白质。
天然氨基酸上的氨基与羧基连在同一个C上,所以这些氨基酸均为α-氨基酸。
天然氨基酸分析是食品、饲料和药品分析的重要项目。
目前氨基酸分析常常采用这样两种方式:离子交换色谱分离-柱后衍生和柱前衍生-反相色谱法分离。
后者以操作灵活、费用低廉而被广泛应用。
在柱前衍生-反相色谱法分离中,异硫氰酸苯酯(PITC)和2,4-二硝基氟苯(DNFB)均可与一级胺、二级胺反应,是理想的柱前衍生剂。
尽管天然氨基酸多达20种,但由于蛋白质水解过程中天冬酰胺和谷氨酰胺分别转化为天冬氨酸和谷氨酸,半胱氨酸则以胱氨酸形式存在,因而对于含蛋白食品、饲料等样品的氨基酸分析时,只需分析Asp(天冬氨酸)、Glu(谷氨酸)、Ser(丝氨酸)、Gly(甘氨酸)、His(组氨酸)、Arg(精氨酸)、Thr(苏氨酸)、Ala(丙氨酸)、Pro(脯氨酸)、Tyr(酪氨酸)、Val(缬氨酸)、Met(甲硫氨酸)、Cys-Cys(胱氨酸)、Ile(异亮氨酸)、Leu(亮氨酸)、Phe(苯丙氨酸)、Trp(色氨酸)、Lys(赖氨酸)等18种氨基酸,PITC和DNFB均能与这些氨基酸生成稳定的衍生物。

岛津氨基酸柱前衍生
岛津氨基酸柱前衍生是一种常用的氨基酸分析方法,主要涉及到色谱分离和柱前衍生技术。
该方法通过在色谱柱前对氨基酸进行衍生化处理,使原本不易被检测的氨基酸转化为更易于检测的衍生物,从而提高检测灵敏度和准确性。
以下是岛津氨基酸柱前衍生的基本步骤:
1.衍生试剂准备:根据具体的衍生方法,准备所需的衍生试剂,如邻苯二甲醛(OPA)、异硫氰酸苯酯(PITC)等。
2.氨基酸衍生:将待测氨基酸溶液与衍生试剂混合,在一定条件下进行衍生化反应,使氨基酸转化为荧光或紫外可检测的衍生物。
3.柱前衍生:将衍生化后的氨基酸溶液通过色谱柱进行分离,以便后续的检测和分析。
4.检测与分析:通过色谱仪对分离后的氨基酸衍生物进行检测,如荧光检测器或紫外检测器。
根据检测结果,可以采用相应的色谱软件对数据进行处理和分析。
岛津氨基酸柱前衍生具有较高的灵敏度和准确性,能够有效地检测和区分不同类型的氨基酸。
同时,通过选择不同的衍生试剂和检测器,可以对不同种类的氨基酸进行定性和定量分析。
因此,该方法在生物、医学、农业和食品等领域中得到了广泛应用。


一. 名词解释(多数为理解为主)第一章蛋白质的结构与功能1.蛋白质一级结构:蛋白质分子中氨基酸的排列顺序称蛋白质的一级结构。
一级结构的主要化学键是肽键,有的还包含二硫键。
一级结构是蛋白质空间构象和特异生物学功能的基础。
5.生物活性肽:具有生物学活性的寡肽或多肽。
例如谷胱甘肽等。
2. 蛋白质的二级结构:指蛋白质分子中某一段肽链的局部空间结构,也就是该肽链主链骨架原子的相对空间位置,并不涉及氨基酸残基侧链的构象。
蛋白质二级结构包括α-螺旋、β-折叠、β-转角和无规卷曲。
维持蛋白质二级结构的化学键是氢键3.蛋白质四级结构:由两条或两条以上多肽链组成的蛋白质,每一条多肽链都有其完整的三级结构,称为蛋白质的亚基,亚基与亚基之间呈特定的三维空间排布,并以非共价键相连接,这种蛋白质分子中各个亚基的空间排布及亚基接触部位的布局和相互作用,称为蛋白质的四级结构。
4.肽单元(peptide unit):参与肽键的6个原子——C-α1,C,O,N,H,C-α2。
位于同一平面,C-α1和C-α2在平面上所处的位置为反式(trans)构型,此同一平面上的6个原子构成肽单元。
5. 盐析:指将硫酸铵、硫酸钠等无机盐类加入蛋白质溶液,破坏蛋白质在溶液中的稳定性因素而沉淀,各种蛋白质盐析时所需的盐浓度及pH均不同。
6.氨基酸的等电点:在某一pH值的溶液中,氨基酸解离成阴/阳离子的趋势及程度相等,成为兼性离子,呈电中性,此时溶液的pH值称该氨基酸的等电点。
7.glutathine:即谷胱甘肽,是由谷、半胱和甘氨酸组成的三肽,分子中半胱氨酸的巯基是其主要功能基因,具有还原性和嗜核特性,故谷胱甘肽可保护机体免遭氧化剂和毒物的损害。
10.蛋白质变性:在某些物理或化学因素的作用下,蛋白质的空间构象被破坏,从而导致其理化性质的改变和生物活性的丧失,称蛋白质的变性。
8.肽平面:参与肽键形成的6个原子(C-α1,C,O,N,H,C-α2)位于同一平面,C-α1和C-α2在平面上所处的位置为反式(trans)构型,此同一平面上的6个原子构成肽平面,即肽单元(peptide unit)。