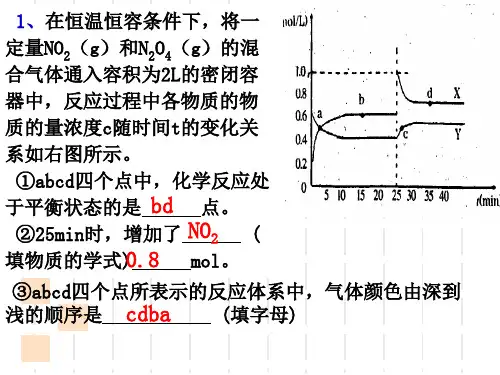
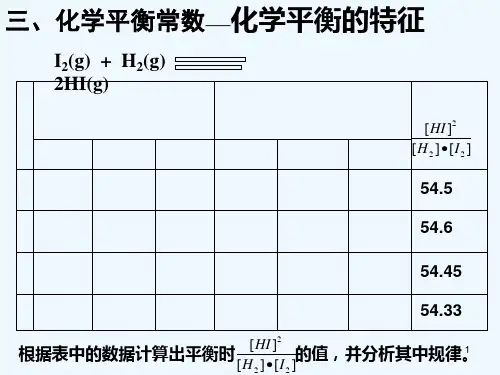
(2) Kc=[NO2]2/[N2O4]
(3)
Kc= [CO2]
13
4、平衡常数只表现反应进行的程度,即 可能性问题,而不表现到达平衡所需的 时间,即现实性问题.
5、平衡常数K与温度有关,与浓度无关,由K随温度 的变化可推断正反应是吸热反应还是放热。 若正反应 是吸热反应,升高温度,K 增大;若正反应是放热反应,升 高温度,K 减少;
3
二、数学表达式: 对于一般的可逆反应mA+nB pC+qD
{c(C)}p{c(D)}q
K = {c(A)} m{c(B)} n
三、平衡常数的单位 浓度的单位为mol·L-1
∴K的单位为(mol·L-1)n; 4
练习:试写出下列反应的浓度平衡常数的数学表达式:
2SO2(g)+O2(g) 催化剂 2SO3
反应物A: [A]=c0(A) - △c(A) (2)生成物:平衡浓度=初始浓度+转化浓度
生成物D: [D] = c0(D) +△c(D) (3)各物质的转化浓度之比等于它们在化学方程式中 相应的化学计量数之比。△c(A):△c(D)=a:d
20
例度1平:合衡成是氨:[N的2]反=3应mNol2·+L3-1H,[H22]2=N9mH3o在l·L某-1,温[N度H3下] =各4m物o质l·L的-1浓求 该反应的平衡常数和N2、H2的初始浓度。
3、反应的平衡常数与反应可能进行的程度。一般来 说,反应的平衡常数KC≥105,认为正反应进行得较完 全;KC ≤10-5则认为这个反应的正反应很难进行(逆反 应较完全)。
17
例如:不同温度时,反应:H2(g)+I2(g) △ 的平衡常数与温度的关系如下: