化合价和化学方程式的关系
- 格式:docx
- 大小:36.64 KB
- 文档页数:1

化学式的简化与化合价的计算化学式的简化与化合价的计算是化学中的重要概念,用于描述和表示化学物质的组成和结构。
在化学反应和化学方程式中,正确地简化化学式并计算化合价能够帮助我们更好地理解和预测化学反应的过程和结果。
1. 化学式的简化化学式是用化学符号和数字表示化学物质的组成。
简化化学式通过消除公约数来表示化合物的最简整数比例。
以氧化亚氮(亚氮化物)为例,化学式为N2O,它表示两个氮原子和一个氧原子的组合比例。
为了简化该化学式,我们可以除以最大公约数,得到简化后的化学式为N2O。
2. 化合价的计算化合价是指一个原子在化合物中与其他原子结合时的电荷数。
通过化合价,我们可以确定化合物的性质和其在化学反应中的行为。
化合价的计算需要考虑原子的电子数和它们在化学键中的电荷转移。
以下是几种常见元素的化合价计算例子:- 氧(O)的化合价通常为-2,在大多数情况下,氧与其他元素结合时会失去两个电子,因此它的化合价为-2。
例如,在二氧化碳(CO2)中,氧的化合价为-2,碳的化合价为+4。
- 氢(H)的化合价通常为+1,在大多数情况下,氢与其他元素结合时会失去一个电子,因此它的化合价为+1。
例如,在水(H2O)中,氧的化合价为-2,氢的化合价为+1。
- 氮(N)的化合价通常为-3,在大多数情况下,氮与其他元素结合时会得到三个电子,因此它的化合价为-3。
例如,在氨(NH3)中,氮的化合价为-3。
通过计算化合价,我们可以确定化合物中各个原子之间的电荷数和键的类型(离子键或共价键),从而进一步了解化合物的性质和反应特征。
总结:化学式的简化和化合价的计算是化学中必不可少的概念。
简化化学式可以帮助我们更清晰地表示化学物质的组成比例,而化合价的计算则可以帮助我们确定原子在化合物中的电荷数和化合物的性质。
熟练掌握化学式的简化和化合价的计算能力,对于深入理解化学反应和预测化学变化具有重要意义。
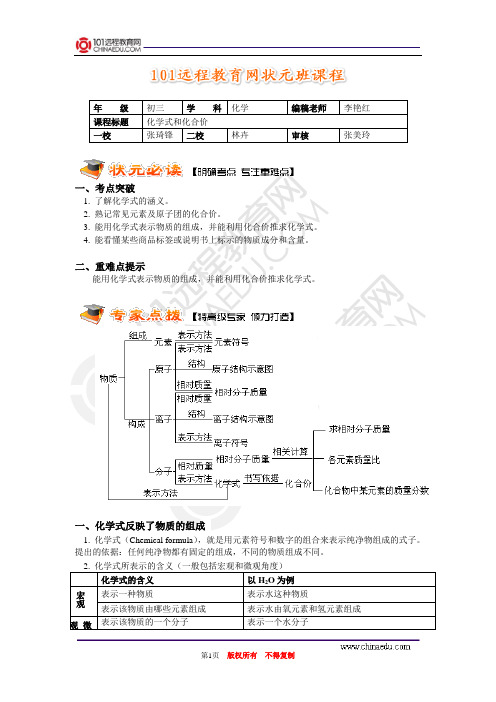
年级 初三 学 科 化学 编稿老师 李艳红课程标题 化学式和化合价一校张琦锋二校林卉审核张美玲一、考点突破1. 了解化学式的涵义。
2. 熟记常见元素及原子团的化合价。
3. 能用化学式表示物质的组成,并能利用化合价推求化学式。
4. 能看懂某些商品标签或说明书上标示的物质成分和含量。
二、重难点提示能用化学式表示物质的组成,并能利用化合价推求化学式。
一、化学式反映了物质的组成1. 化学式(Chemical formula ),就是用元素符号和数字的组合来表示纯净物组成的式子。
提出的依据:任何纯净物都有固定的组成,不同的物质组成不同。
2. 化学式所表示的含义(一般包括宏观和微观角度)化学式的含义以H 2O 为例 宏观表示一种物质表示水这种物质表示该物质由哪些元素组成表示水由氧元素和氢元素组成 微观表示该物质的一个分子表示一个水分子表示一个分子里有多少个原子表示一个水分子中有2个氢原子和1个氧原子质量表示物质的相对分子质量M r(H2O)=2A r(H)+A r(O)=2+16=18表示物质中各种元素的原子个数比水中氢元素和氧元素的原子个数比为2:1表示物质中各种元素的质量比水中氢元素和氧元素的质量比为1:83. 化学式中元素符号周围的数字的意义如aR b ca表示有a个这样的微粒b表示一个微粒中有b个原子或原子团c表示一个该离子中带有c个正(负)电荷如:二、简单化合物的命名1. 由两种元素组成的化合物的命名根据元素的名称,从右往左读作“某化某”。
如NaCl读作“氯化钠”,ZnO读作“氧化锌”,Fe3O4读作“四氧化三铁”。
但要注意,H2O就是“水”,不能读成“氧化氢”,NH3就是“氨气”。
2. 含有OH原子团的化合物的命名一般命名为“氢氧化某”如:NaOH读作“氢氧化钠”,Cu(OH)2读作“氢氧化铜”3. 含有其他原子团的化合物的命名一般根据原子团和另一元素的名称从右到左的顺序读作“某酸某”。
如:CaCO3读作“碳酸钙”,Cu(NO3)2读作“硝酸铜”,但要注意,H2CO3就读作“碳酸”,H2SO4就读作“硫酸”等。

化学式与化合价化学式是一种用符号和数字来表示化学物质组成的式子,它反映了物质组成、结构和性质的重要信息。
而化合价则是指一种元素的一个原子与其他元素的原子形成化合物时所具有的价态。
化学式与化合价在化学学习中扮演着重要的角色,对于理解化学反应、合成与分解物质以及掌握元素的性质等方面都具有重要的意义。
一、化学式化学式是用符号和数字来表示化学物质组成的式子,它具有以下特点:1、客观性:化学式能够客观地反映物质的组成和结构,不受主观意识的影响。
2、简洁性:通过化学式,可以简洁明了地表示出物质的组成和结构,方便记忆和使用。
3、通用性:化学式是国际通用的表示方式,不受地域和语言的限制。
化学式的书写规则包括:1、单质采用元素符号来表示,如氧气(O₂)、氢气(H₂)等。
2、化合物采用元素符号和数字的组合来表示,其中数字表示原子个数,如水(H₂O)、二氧化碳(CO₂)等。
3、书写化学式时,一般按照先读后写的顺序进行,如硫酸钠(Na₂SO ₄)。
二、化合价化合价是指一种元素的一个原子与其他元素的原子形成化合物时所具有的价态。
化合价的确定对于理解化学反应中元素的性质和化学键的形成具有重要意义。
化合价的确定方法包括:1、实验测定:通过化学实验测定物质的性质和反应条件,从而确定元素的化合价。
2、理论推导:根据化学键理论和元素周期律等理论知识,推导出元素的化合价。
化合价的规则包括:1、常见元素的化合价:如氢为+1价,氧为-2价,金属元素一般显正价等。
2、化合价的代数和为零:在化合物中,正负化合价的代数和为零。
3、化合价的标示方法:在元素符号的正上方标示化合价,如NaOH中,钠显+1价,氢氧根显-1价。
三、化学式与化合价的应用化学式与化合价在化学学习中具有广泛的应用,例如:1、化学式的书写:通过化学式可以方便地表示出物质的组成和结构,有助于理解物质的性质和用途。
2、化合价的计算:通过化合价可以计算出物质中各元素的原子个数比,有助于理解化学反应中元素的性质和变化规律。

化学式与化合价的计算与应用化学式是用元素符号和数字表示化合物中各元素原子的种类和相对原子数的符号表示法。
化合价则是指描述化合物中元素原子与其他元素原子之间的化学结合方式与程度的数值。
一、化学式的计算与表示化学式的计算主要有两种情况:离子化合物和共价化合物。
1. 离子化合物的化学式计算离子化合物由正离子和负离子组成,正离子通常是金属原子失去一个或多个电子形成的,负离子通常是非金属原子获得一个或多个电子形成的。
化学式中,正离子写在前面,负离子写在后面,并用互补的电荷数来表示。
例如,氯化钠的化学式为NaCl,其中Na+为正离子,Cl-为负离子。
2. 共价化合物的化学式计算共价化合物是由非金属元素间的共价键连接而成的化合物。
对于共价化合物的化学式,需满足以下要求:原子价合为零、积成分子、电荷守恒。
例如,二氧化硫的化学式为SO2,其中每个氧元素与硫元素共享一个氧原子,满足共价键的特点。
二、化合价的计算与应用化合价反映了一个元素在其化合物中所表现出的类型和程度的阐明,是化学反应理解和预测的重要基础。
化合价的计算方法主要包括以下几种:1. 基于单质的化合价计算单质元素的化合价通常为0。
当元素与其他元素形成化合物时,根据其在化合物中的电子变化情况,可以推算出其化合价。
例如,氧气中氧原子的化合价为0,而在水中氧原子的化合价为-2。
2. 基于化合物的原子价计算利用化合物已知的化学式和已知元素的化合价,可计算其他元素的化合价。
例如,利用已知的化学式H2O和已知氧的化合价为-2,可计算出氢的化合价为+1。
化合价的应用主要表现在以下几个方面:1. 确定化合物的化学式通过计算元素的化合价,可以确定化合物的化学式。
例如,已知硫的化合价为+4,氧的化合价为-2,通过化合价计算可以确定二氧化硫的化学式为SO2。
2. 预测反应产物通过化合价的计算,可以预测化学反应的产物。
例如,已知金属钠的化合价为+1,非金属氯的化合价为-1,通过化合价的预测可以确定钠与氯反应时生成氯化钠。

化合价与化学式一、知识梳理1、化合价的定义知识衔接点拨:这部分内容在初中教材中介绍的不够深入,虽然也可能进行过大量训练,但是由于初中知识的局限性,大多数同学对化合价的概念没有掌握,以至于在进入高中后的学习过程中感到与化合价的变化密切相关的氧化还原理论非常艰涩难懂,甚至在整个高中化学的学习过程中都分不清关于氧化还原反应的相关概念,更不用说弄清它们之间的关系了。
因此,要想从根本上解决这个问题,首先应把常见元素的符号及常见化合价记准背熟,再次应下大力气弄清1-18号元素的核外电子排布和原子结构示意图,按照结构决定性质、性质反映结构的观点,用元素周期律揭示常见元素的主要化合价的递变规律,最后用元素周期表中元素所处的位置印证元素的性质与原子结构之间的关系,就能真正的领会掌握元素的“位(位置)、构(原子结构)、性(元素性质)”三者之间的关系,从而更深刻地理解并掌握元素化合价的定义,最终为氧化还原理论的深入学习打下坚实的基础,做好知识的充分准备。
针对性训练:1、科学家研究发现,以Y2O3、BaCO3和CuO为原料经研磨烧结后可以合成一种高温超导物质,其化学式可写成Y2Ba4Cu6O13,且在合成过程中各元素的化合价均无变化,则()A、此合成过程的反应类型是化合反应,Y的化合价为+2价B、此合成过程的反应类型是化合反应,Y的化合价为+3价C、此合成过程的反应类型不是化合反应,Y的化合价为+2价D、此合成过程的反应类型不是化合反应,Y的化合价为+3价2、根据元素化合价书写化学式知识衔接点拨:根据元素化合价书写物质的化学式是学习化学的基本素质和基本技能,在高中阶段更加注重的是使用元素化合价与原子最外层电子数的关系解释化学键的形成、某些有机物分子的空间构型,特别是在确定并书写有机物的同分异构体时应用的更为广泛,由此可以看出:上述能力要求的本质仍然是理解并应用化合价的概念,因此要求同学们一定要彻底掌握它。
针对性训练:2、为了防染病疫情发生,必须对发生重大自然灾害的地区进行环境消毒,下列有关常用的消毒剂及对应的化学用语表示错误的是()A、熟石灰的化学式:CaOHB、过氧乙酸结构简式:CH3COOOH ,其化学式为:C2H4O3C、过氧化氢(122H O)中,氧元素为-1价D、漂白精有效成分次氯酸钠(1Na Cl O)中,氯元素为+1价3、元素化合价的变化与氧化还原理论的关系知识衔接点拨:元素化合价有变化是氧化还原反应的基本特征,元素化合价的升降变化揭示和氧化还原反应的本质是电子的转移。

【知识梳理】一、化学式1、概念:用元素符号和数字的组合表示物质组成的式子,叫做化学式。
2、化学式表示的意义(由分子构成的物质)宏观:(1)表示一种物质(2)表示该物质由哪些元素组成微观:(3)表示该物质的一个分子(4)表示构成物质的一个分子的构成3、化学式的书写(1)单质:金属单质、固态非金属单质、稀有气体单质:用元素符号表示气态非金属单质:在元素符号右下角加数字(2)化合物:根据化合价书写已知化合物的化学式,一般按排序(一般正价在前,负价在后)、标价、定数的方法书写。
4、化合物的读法:由两种元素组成的:某化某含酸根化合物:某酸某二、化合价及其应用1、常见元素和根的化合价(1)化合价是元素在形成化合物时表现出来的一种性质。
化合价有正价和负价之分。
(2)化合价的表示方法:在元素符号正上方用+n或-n表示;(3)意义:表示某种元素的化合价(4)化合价规律:①金属元素与非金属元素化合时,金属元素显正价,非金属元素显负价。
②氢元素通常显+1价,氧元素通常显-2价。
③在化合物中元素化合价的代数和为零。
④在单质里,元素的化合价为零。
2、化合价的应用(1)根据化合价书写化学式一般把正价元素或原子团写在左边,负价元素或原子团写在右边,将正负化合价的绝对值相约至最简整数后,将其交叉写在元素符号或原子团的右下角(即十字交叉法)。
(2)根据化学式确定化合价依据化合物中正负化合价代数和为零的规则,根据原子团中正负化合价代数和为根价的原则,计算确定。
三、化学符号周围数字的意义1、元素符号:宏观上表示元素,微观上表示该元素的一个原子.2、化学式:宏观上表示物质及其组成,微观上表示该物质的构成;3、离子符号:整体上表示一个该离子,右上角表示一个该离子带几个单位的正或负电荷;4、数字的含义:(1)化学符号前面的数字,表示微粒的个数;(2)化学符号右下角的数字,表示一个该微粒中所含该原子的数目;(3)化学符号右上角的数字,表示一个该离子所带的电荷数;(4)化学符号正上方的数字,表示在该化合物里该元素或原子团所显的化合价。
化学式与化合价考点1.化学式(1)化学式的书写方法:①单质的化学式:a.稀有气体单质、金属单质及部分非金属单质(如硫、磷等)是由单原子构成,其化学式直接用元素符号表示。
如:He 、Ne 、Fe 、Mg 、C 、S 、P ;b .常温下是气态的非金属单质,一般为双原子分子,在其元素符号右下角写上“2”,即表示其化学式,例如:O 2、H 2、Cl 2、N 2等。
②化合物的化学式:a.弄清不同元素原子的个数比;b .化合物为氧化物时,一般把氧的元素符号写在右方,另一种元素的符号写在左方c .金属在左,非金属在右,如NaCl 。
(2)化学式表示的意义:①由分子构成的物质,其化学式意义(以CO 2为例):⎩⎨⎧氧元素组成的二氧化碳是由碳元素和组成表示该物质由哪些元素二氧化碳表示该物质宏观:: ⎩⎨⎧构成的一个碳原子和两个原子一个二氧化碳分子是由构成表示该物质一个分子的一个二氧化碳分子表示该物质的一个分子微观:: ②由原子构成的物质,其化学式的意义(以Fe 为例):⎩⎨⎧铁是由铁元素组成的素组成表示该物质是由什么元铁表示该物质宏观:: 微观:表示该物质的一个原子:一个铁原子。
相关练习:1.今年,我省合肥、芜湖等城市已开始使用西气东输工程送来的天然气,天然气的主要成分是CH4。
下列四位同学在讨论化学式CH4的意义,其中错误的是( )2.具有不同原子团的一组物质是 ( )A .FeSO 4和Fe 2(SO 4)3B .NaMnO 4和Na 2MnO 4C .Mg(NO 3)2和AgNO 3D .(NH 4)2SO 4和NH 4Cl3.在2H +、2CO 、2O 、2Ca 2+和2NH 3等符号中,能够表示2个分子的符号有 ( )A .1个B .2个C .3个D .4个4. 2003年10月15日,中国“神州五号”飞船载人航天取得成功。
偏二甲肼是火箭推进器的常用燃料。
根据偏二甲肼的化学式C 2H 8N 2,你知道哪些信息?(即式表示的意义,回答不要求涉及相对原子质量。
初中常见化合价、化学式及化学方程式一、初中化合价钾钠银氢正一价,氟氯溴碘负一价;正一亚铜正二铜,正二亚铁正三铁,(Cu2O、CuO;FeO、Fe2O3)钙镁钡锌正二价,铝是正三氧负二,氯是负一最常见;硫有负二正四六,(Na2S、FeS、CuS、SO2、SO3)负一硝酸氢氧根,负二硫酸碳酸根;负三记住磷酸根,正一价的是铵根,正四硅,二四碳,单质零价永不变。
其他元素有变价,先死后活来计算。
三、化合物初中化学方程式全(已配平)一、化合反应1、镁在空气中燃烧:2Mg+O2点燃2MgO2、铁在氧气中燃烧:3Fe+2O2点燃Fe3O43、铝在空气中燃烧:4Al+3O2点燃2Al2O34、氢气在空气中燃烧:2H2+O2点燃2H2O5、红磷在空气中燃烧:4P+5O2点燃2P2O56、硫粉在空气中燃烧:S+O2点燃SO27、碳在氧气中充分燃烧:C+O2点燃 CO28、碳在氧气中不充分燃烧:2C+O2点燃2CO9、二氧化碳通过灼热碳层:C+CO2高温2CO10、一氧化碳在氧气中燃烧:2CO+O2 点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O=H2CO312、生石灰溶于水:CaO+H2O=Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O=CuSO4·5H2O14、钠在氯气中燃烧:2Na+Cl2点燃2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2MnO22H2O+O2↑16、加热高锰酸钾:2KMnO4△K2MnO4+MnO2+O2↑17、水在直流电的作用下分解:2H2O通电2H2↑+O2↑18、碳酸化学性质不稳定而分解:H2CO3=H2O+CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温CaO+CO2↑20、加热氯酸钾分解:2KClO3=2KCl+3O2↑21、氧化汞加热分解:2HgO△2Hg+O2↑三、置换反应(单质+化合物→新的单质+新的合化物)22、锌和稀盐酸反应(实验室制氢气):Zn+2HCl=ZnCl2+H2↑锌和稀硫酸反应(实验室制氢气):Zn+H2SO4=ZnSO4+H2↑23、镁和稀盐酸反应:Mg+2HCl=MgCl2+H2↑镁和稀硫酸反应:Mg+H2SO4=MgSO4+H2↑24、铁和稀盐酸反应:Fe+2HCl=FeCl2+H2↑铁和稀硫酸反应:Fe+H2SO4=FeSO4+H2↑25、铝和稀盐酸反应:2Al+6HCl=2AlCl3+3H2↑铝和稀硫酸反应:2Al+3H2SO4=Al2(SO4)3+3H2↑26、铁和硫酸铜溶液反应:Fe+CuSO4 =FeSO4+Cu铝和硫酸铜溶液反应:2Al+3CuSO4=Al2(SO4)3+3Cu27、铜和硝酸银反应:Cu+2AgNO3=Cu(NO3)2+2Ag28、氢气还原氧化铜:H2+CuO△Cu+H2O29、木炭还原氧化铜:C+2CuO高温 2Cu+CO2↑30、焦炭还原氧化铁:3C+2Fe2O高温 4Fe+3CO2↑31、水蒸气通过灼热碳层:H2O+C高温 H2+CO四、复分解反应复分解反应是由两种互相交换成分,生成另外两种化合物的反应。
确定化学方程式实用技巧确定化学方程式是化学学习中的基础技能之一。
化学方程式可以描述化学反应的反应物和生成物的种类和数量关系。
然而,对于初学者来说,确定化学方程式可能是一个具有挑战性的任务。
本文将介绍一些实用的技巧,帮助初学者更好地确定化学方程式。
首先,了解元素的化合价是确定化学方程式的关键。
化合价是元素与其他元素结合时所表现出的价态。
通过了解元素的化合价,我们可以确定元素在反应中的位置和数量。
例如,氧气的化合价为-2,氢气的化合价为+1。
当氢气和氧气反应时,我们可以根据化合价确定反应的方程式:2H2 + O2 → 2H2O。
在这个方程式中,氢气的化合价为+1,氧气的化合价为-2,通过乘以适当的系数,我们可以保持反应物和生成物的化合价平衡。
其次,观察反应物和生成物的物质的状态是确定化学方程式的重要步骤。
化学反应可以发生在固体、液体、气体或溶液中。
当我们观察到反应物和生成物的状态时,可以使用适当的符号表示。
例如,(s)表示固体,(l)表示液体,(g)表示气体,(aq)表示溶液。
通过观察反应物和生成物的状态,我们可以更好地理解反应过程,并确定方程式中的物质状态。
此外,了解化学反应的类型也是确定化学方程式的关键。
化学反应可以分为合成反应、分解反应、置换反应和双替反应等。
合成反应是指两个或多个物质结合形成一个新的物质。
例如,2Na + Cl2 → 2NaCl就是一个合成反应。
分解反应是指一个物质分解成两个或多个物质。
例如,2H2O → 2H2 + O2就是一个分解反应。
置换反应是指一个元素被另一个元素替换。
例如,Zn + 2HCl → ZnCl2 + H2就是一个置换反应。
双替反应是指两个化合物中的离子交换位置。
例如,AgNO3 + NaCl → AgCl + NaNO3就是一个双替反应。
通过了解不同类型的化学反应,我们可以更好地确定化学方程式中的反应类型。
最后,平衡化学方程式是确定化学方程式的最终步骤。
百花园地新课程NEW CURRICULUM摘要:化学方程式是初中化学教学的重点和难点,配平则是书写化学方程式的关键。
传统的配平方法只注重表面的原子个数相等,却忽略了化学反应的本质。
化合价变化正好反映了化学反应的本质,利用化合价原理可以快速准确地配平化学方程式。
关键词:化合价;配平;化学方程式许多学生在化学方程式的配平过程中存在着“猜测性”和“盲目性”,多数教师常用的配平方法也只有观察法、最小公倍数法、奇偶数法、唯一元素法、待定系数法等,这些方法无一例外都是从原子的个数出发,设法使化学方程式里各种原子反应前后数目保持不变,很少从化学反应的实质上去探索配平方法。
化学反应的实质是原子或离子重新组合的过程,化合价恰好是某种元素一定数目的原子跟其他元素一定数目的原子相互化合的性质,因此可以利用化合价的关系迅速准确地配平化学方程式,甚至“写”与“配”同时进行,一气呵成。
反应中各元素化合价都不变的,配平方程式完全可以用观察法或最小公倍数法来完成。
反应中有元素化合价变化的,配平方程式的原则就是化合价升降的数目要相等。
对于溶液中进行的反应,可以直接看相互交换位置的正价元素原子的化合价是否“等价”交换,不是“等价”交换的,通过配化学式的系数使其“等价”交换即可。
例1.书写化学方程式Fe+H2O→时,生成物中有2个+3价的Fe和1个+2价的Fe共+8价的Fe交换了反应物中2个+1价的H,不是“等价”交换,只要给H2O配可。
然后用观察法给H2配4,给Fe配3,即可配平为4H2O+3Fe Fe3O4+4H2↑。
例2.书写化学方程式Al+HCl→时,反应物中1个+3价的Al 和1个+1价的H交换,不是“等价”交换,需要给HCl配3,但是生成的H2是双原子分子,所以必须同时扩大2倍,即给Al配2,给HCl配6用观察法给AlCl3配2,给H2配3,即可配平为2Al+6HCl2AlCl3+3H2↑。
例3.书写化学方程式Al2(SO4)3+BaCl2→时,反应物中2个+3价的Al和1个+2价的Ba交换,不是“等价”交换,只要给BaCl2配3就行。
几乎每种物质均是以原子或分子的形式存在的,由原子或分子组成的
化合物的特性是它们物理性状的主要决定因素。
化学方程式定义并描
述了化合物的特性。
化学方程式定义了在化学反应中发生的变化,以
及化学式中参与元素成分、量和相互作用,标识参与反应的原料,如
果存在,还会包括产物和表明反应顺序的箭头状符号。
比如,氧化铝是一个众所周知的化学反应,反应方程式为:2A1(s)+ 3O2(g)→ 2Al2O3(s),其中2A1(s)是铝原子,3O2(g)是氧气分子,2Al2O3(s)是氧化铝的化学式,即箭头状符号表示从左至右的
反应顺序。
化合价是物质构成成分之间的相互作用力,是原子与原子之间相互结
合所产生力量的度量。
与化学方程式不同,它表示在一个分子中元素
结合时产生的特殊键的类型。
比如水的化合价:H2(g)+ O2(g)
→2H2O(l),这是水的化学式,由于水的分子构成由氢原子和氧原子组成,因此水的化合价为2,表示氢原子和氧原子之间有一个键,即电子对。
总之,化学方程式说明的是一个反应发生的过程,它指定了反应的原
料和产物及其物质量,而化合价则表明物质构成成分之间的性能特性,即它们之间发生的键类型及强度。
因此,它们彼此关联,因为在一个
化学反应中,产物是原料之间交互作用的结果,而这种交互作用是由
化合价提供的。