08-炔烃 碳链延长
- 格式:ppt
- 大小:978.00 KB
- 文档页数:40




114第六章 炔烃分子中含有碳碳叁键的烃叫做炔烃。
碳碳叁键可位于碳链中的任意位置。
开链炔烃的分子通式为C n H 2n-2 。
碳碳叁键位于碳链一端的炔烃称之为单取代或末端炔烃。
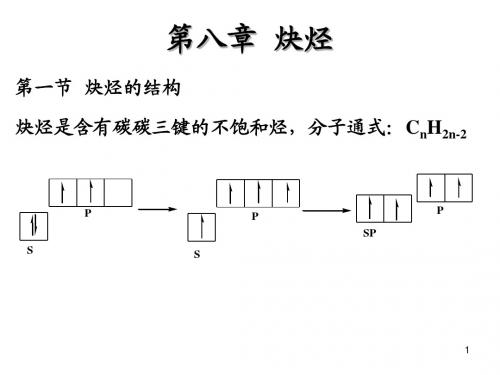
6.1 炔烃的结构与烯烃的碳碳双键相比,炔烃的碳碳叁键经历了不同的杂化。
在此杂化过程中,碳的2s 轨道和三个2p 轨道中的一个进行杂化。
每个杂化轨道含有1/2 s 轨道和1/2 p 轨道的成分。
这些杂化轨道称之为sp 轨道。
由于sp 轨道的s 成分增加,乙炔中碳氢键的极性比乙烷和乙烯中的大很多。
乙烯的pK a 值大约在44,而乙炔的pK a 值大约在25,所以末端炔烃在一些特定的情况下,可以当成弱酸,尽管酸性甚至比水还弱很多。
碳碳叁键是两个sp 杂化的碳原子相互之间形成的。
碳原子中的两个sp 杂化轨道沿一轴线呈180 o 伸展 ,该轴线与非杂化的2p x 和2p y 轨道垂直。
当两个sp 杂化碳原子相互靠近时,sp-sp σ 键形成,于是每个碳原子其它两个p 轨道之间就以肩并肩方式重叠,形成两个相互垂直的π键,如图6.1所示。
因此,乙炔C 2H 2是一个线形分子,四个原子都排布在同一条直线上。
由于此线形特性,环状炔烃至少含有十个碳原子才能消除过多的张力。
此外,围绕炔烃叁键部分的电子云密度要比乙烷、乙烯大得多。
与烯烃类似,炔烃容易与亲电试剂相互作用。
(a)(b)图6.1 乙炔的模型(a )乙炔 sp 杂化示意图(b)乙炔的电子云结构模型乙炔碳碳叁键的长度为120pm,键能大约是836 kJ/mol,所以碳碳叁键是已知的键能最大,键长最短的碳碳键。
表格6.1 乙烷,乙烯,乙炔的共价键参数乙烷乙烯乙炔C-C 键键能(KJ)C-C 键长度(pm) 154 134 120C-H 键键能(KJ) 410 444 506C-H键长度(pm) 110 108 106 很明显可以看出(836-368) 并不是(607-368)的两倍,而且实验结果表明,要打开乙炔中的π键需要大约318 KJ/mol的能量,而对于乙烯需要268KJ/mol,所以我们可以得到结论,炔烃与亲电试剂的反应比烯烃与亲电试剂的反应要迟钝。

《有机化合物的命名》炔烃命名要点在有机化学的广袤领域中,正确地给化合物命名是一项至关重要的技能。
其中,炔烃的命名有着其独特的规则和要点,掌握这些对于理解和研究有机化学具有重要意义。
首先,让我们来了解一下什么是炔烃。
炔烃是一类含有碳碳三键(—C≡C—)的不饱和烃。
其通式为 CnH2n-2(n≥2)。
常见的炔烃如乙炔(C2H2),丙炔(C3H4)等。
在给炔烃命名时,第一步是选择包含碳碳三键的最长碳链作为主链。
这条主链的长度决定了化合物的名称的“词根”。
例如,如果主链有 4个碳原子,那么词根就是“丁”。
确定主链后,要对主链进行编号。
编号的原则是要使碳碳三键的位置编号最小。
比如,对于 1-丁炔和 2-丁炔,由于碳碳三键在 1 号位时编号更小,所以正确的名称是 1-丁炔。
接下来是命名支链。
支链的命名与烷烃类似,按照其所含碳原子的数目称为“某基”。
比如,一个碳原子的支链称为甲基(—CH3),两个碳原子的支链称为乙基(—C2H5),以此类推。
如果支链不止一个,那么需要按照“次序规则”来确定它们的先后顺序。
次序规则是指按照原子序数的大小来排列取代基的优先次序。
原子序数大的取代基优先。
对于复杂的炔烃,可能会存在多个碳碳三键或者环与炔烃的组合。
在这种情况下,命名就需要更加细致和准确。
当分子中存在多个碳碳三键时,要将它们的位置和数目都标明。
比如,含有两个碳碳三键且分别位于 1 号位和 3 号位的己炔,就命名为1,3-己二炔。
如果炔烃中还包含环结构,要先将环作为母体,然后再按照炔烃的命名规则来命名。
例如,一个环上带有炔基的化合物,要先命名环,再标明炔基的位置。
在书写炔烃的名称时,要注意数字与汉字之间要用“”隔开,取代基的排列顺序按照“次序规则”从小到大依次书写。
为了更好地理解炔烃的命名,我们来看几个具体的例子。
比如,CH3—C≡C—CH2—CH3 这个化合物,主链有 5 个碳原子,所以是戊炔。
碳碳三键在 2 号位,所以命名为 2-戊炔。
有机化学(第二版)陈长水主编一、有机物的实验室制备1.醇的脱水是实验室制备烯烃的常用方法之一。
乙醇在浓硫酸170℃的作用下,生成乙烯和水2.卤代烃类化合物的制备在实验室和工业上常采用PX3,PX5,SOCL2等作为卤化剂,与醇反应来制备卤代烃类化合物①端基烃:丙醇+HBr在95%硫酸和加热的条件下,生成1-溴丙烷+H2O2-甲基-1-丙醇+PBr3在0℃的条件下,生成2-甲基-2-溴丙烷+H3PO3②非端基烃:3-戊醇+亚硫酰氯(SOCl2)在*****的作用下,生成5-氯戊烷+HCl↑+SO2↑3.醚的合成:醇(需要NaOH作催化剂)或者醇钠跟卤代烃反应制备醚例:溴乙烷跟乙醇钠制备乙醚CH3CH2Br+EtONa→Et2O4.不对称烯烃合成端基醇的反应H3C-CH=CH2→BH3→(CH3CH2CH2)3B(三乙基硼)(CH3CH2CH2)3B→H2O2 H2O OH-(三烃基硼,双氧水存在下碱性水解可得到对应的醇)→CH3CH2CH2-OH注:三烯烃基硼,双氧水存在下碱性水解可得到对应的醇或酮(P55)5.芳香酮的制备苯+(CH3CO)2O→干燥AlCl3→苯-COCH3+CH3COOH二、有机物的工业制法1.工业上,常采用催化脱氢的方法来氧化醇例:乙醇在Cu作催化剂(250~350℃)的作用下,生成乙醛和氢气2-丁醇在Cu作催化剂(400~480℃)的作用下,生成2-丁酮和氢气2.工业上用乙烯催化水化制取乙醇H2C=CH2 →(H2O H+)→CH3CH2OH三、定量分析1.蔡泽尔(Zeisel)烷氧基定量测定法:甲基醚或乙基醚与HI酸反应,几乎定量生成碘甲烷或碘乙烷。
将反映生成的碘甲烷或碘乙烷收集后再与AgNO3反应,根据生成的碘化银的量,计算出甲氧基的含量,这个方法称为蔡泽尔烷氧基定量测定法。
2.气体混合物中氧的定量分析酚比醇更容易氧化,多元酚更易被氧化。
苯环上羟基越多越容易被氧化,例如,1,2,3-苯三酚(焦没食子酸)很容易吸收氧气,故常把它用于气体混合物中氧的定量分析。