(完整word版)金属及其化合物知识点总结及方程式
- 格式:doc
- 大小:491.12 KB
- 文档页数:8


第三章 金属及其化合物知识点总结及方程式
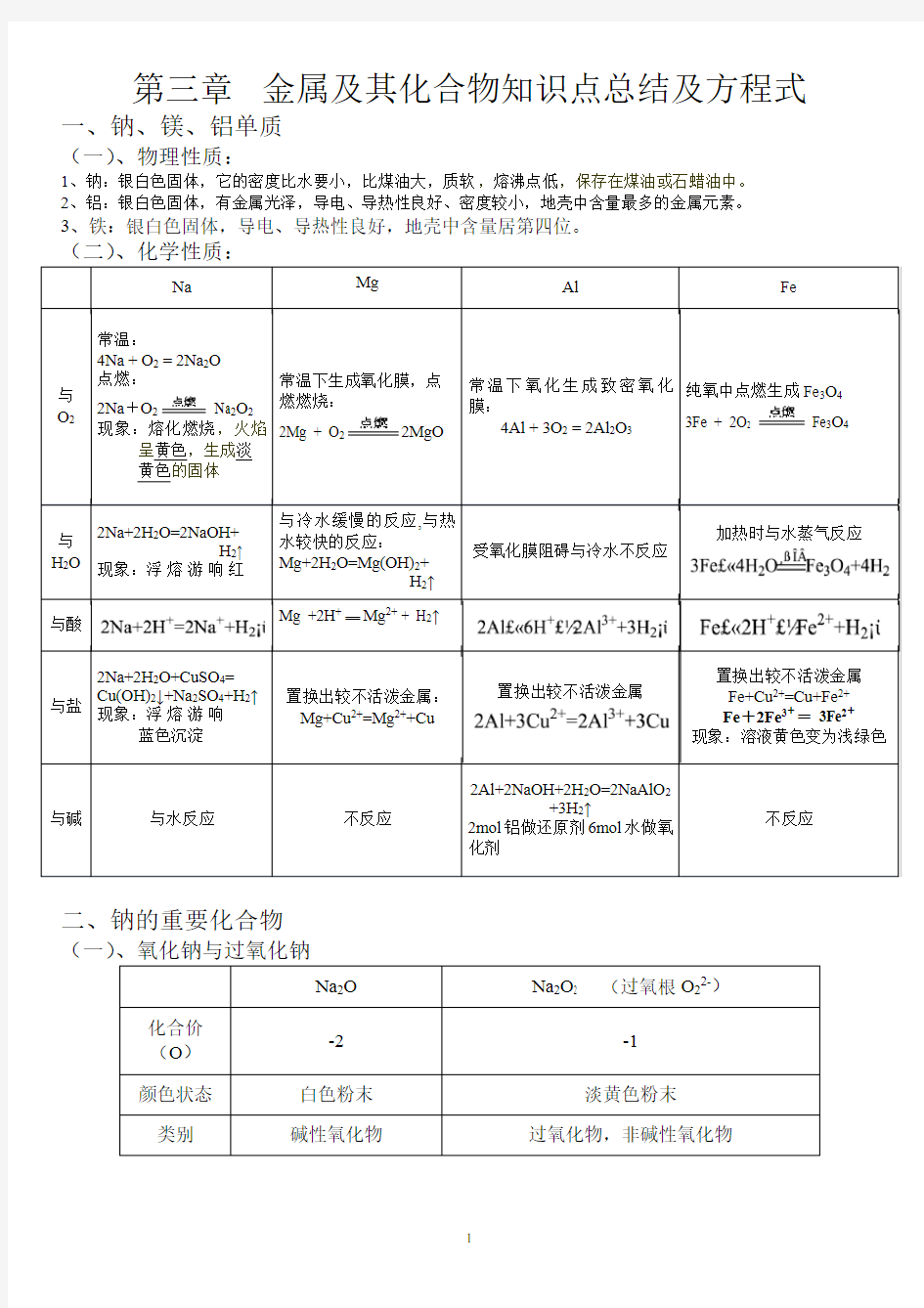
一、钠、镁、铝单质
(一)、物理性质:
1、钠:银白色固体,它的密度比水要小,比煤油大,质软,熔沸点低,保存在煤油或石蜡油中。
2、铝:银白色固体,有金属光泽,导电、导热性良好、密度较小,地壳中含量最多的金属元素。
3、铁:银白色固体,导电、导热性良好,地壳中含量居第四位。
常温:
4Na + O 2 = 2Na 2O 点燃: 2Na +O 2 Na 2O 2
现象:熔化燃烧,火焰呈黄色,生成淡 黄色的固体
2Mg + O 2
2MgO
纯氧中点燃生成Fe 3O 4 3Fe + 2O 2 Fe 3O 4 加热时与水蒸气反应
置换出较不活泼金属
二、钠的重要化合物
现象:放热,有气泡产生,带火星木条复
燃,滴加酚酞先变红,后褪色
不稳定:
2NaHCO3 Na2CO3+H2O +CO2 ↑
现象:固体减少,石灰水浑浊,试管壁有液
滴
Na2CO3+H2O+CO2 =2NaHCO3 2NaHCO3 Na2CO3+H2O +CO2 ↑NaHCO3+NaOH==Na2CO3+H2O可用来除杂
1、碳酸钠与碳酸氢钠的鉴别:
(1)、加热:有气体生成(能使澄清的石灰水变浑浊)的是碳酸氢钠
(2)、滴加酸:立刻产生气泡,是碳酸氢钠,而滴加一会儿才产生气泡的是碳酸钠。
(3)、加入CaCl2、BaCl2溶液:反应产生白色沉淀的是碳酸钠,无明显现象的是碳酸氢钠。
(4)、等浓度的碳酸钠、碳酸氢钠溶液滴加酚酞溶液:溶液变红较深的是碳酸钠,较浅的是碳酸氢钠。
(5)、与酸反应剧烈程度:生成气体剧烈的是NaHCO3,相对不剧烈的是Na2CO3。
2、NaHCO3与Na2CO3除杂:
Na2CO3固体(NaHCO3):加热;
Na2CO3溶液(NaHCO3):适量NaOH
NaHCO3溶液(Na2CO3):足量CO2
(三)钠及其化合物转化关系:
三、铝的重要化合物
(二)、Al3+、AlO2-、Al(OH)3相互转化
1.Al3+和OH-互滴现象不同:
(1)OH-滴到Al3+中:先沉淀后澄清;
①Al3++3 OH-=Al(OH)3↓
②Al(OH)3+OH-=AlO2-+2 H2O
总反应:Al3++4OH-= AlO2-+2 H2O (2)Al3+到OH-中先澄清:后沉淀
①Al3++4OH-= AlO2-+2 H2O
②Al3+ +3AlO2 - +6H2O==4Al(OH)3↓
2. NaAlO 2 和盐酸-
互滴现象不同:
(1)盐酸滴到NaAlO 2中:先沉淀后澄清; ①AlO 2-+H ++H 2O=Al(OH)3 ↓
②Al(OH)3 + 3H + = Al 3+ + 3H 2O
(2)NaAlO 2 滴到盐酸中先澄清后沉淀 ①AlO 2-+4H + = Al 3+ + 2H 2O
②Al 3+ +3AlO 2 - +6H 2O==4Al(OH)3↓
3.铝三角
(1).Al 3+与Al(OH)3的相互转化: ①Al 3+弱碱或少量强碱Al(OH)3。 Al 3++3NH 3·H 2O===Al(OH)3↓+3NH Al 3++3OH -===Al(OH)3↓ ②Al(OH)3强酸Al 3+。
Al(OH)3+3H +===Al 3++3H 2O
(2). Al 3+ 与AlO 的相互转化: ①Al 3+过量强碱AlO 。 Al 3++4OH -===AlO +2H 2O ②AlO 过量强酸Al 3+。 AlO +4H +===Al 3++2H 2O
(3).Al(OH)3与AlO 的相互转化:
①AlO 弱酸或少量强酸Al(OH)3。 ②Al(OH)3强碱AlO 。
AlO +CO 2(过量)+2H 2O===Al(OH)3↓+HCO Al(OH)3+OH -===AlO +2H 2O 2AlO +CO 2(少量)+3H 2O===2Al(OH)3↓+CO AlO +H +(少量)+H 2O=== Al(OH)3↓
4.硫酸铝钾:
(1)电离方程式: KAl(SO4)2=K + + Al 3+ + 2SO 42- (2)明矾
①化学式KAl(SO 4)2·12 H 2
O,
②用途:净水剂:Al3++ 3 H2O =Al(OH)3(胶体)+3H+,氢氧化铝胶体的吸附能力很强,
可以吸附水里悬浮的杂质,并形成沉淀,使水澄清。
5.焰色反应:是元素的性质,是物理变化;
钠的焰色是黄色,钾的焰色是紫色(透过蓝色钴玻璃)
实验操作步骤:洗,烧,蘸,烧,洗
(三)铝及其化合物之间的关系:
四、铁的重要化合物
4Fe(OH)2+O2+2H2O=4Fe(OH)3
现象:白色沉淀迅速变为灰绿色最终变为
红褐色沉淀
(三)铁盐和亚铁盐
1、Fe3+、Fe2+的检验:
(1)Fe3+的检验:
①Fe3+KSCN溶液呈血红色:
3SCN- + Fe3+=Fe(SCN)3
②加强碱有红褐色沉淀:
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
(2)Fe2+的检验:①Fe2+KSCN溶液颜色无明显变化氯水溶液变成红色
2 Fe2++Cl2=2 Fe3++2Cl-
3SCN- + Fe3+=Fe(SCN)3
②加碱有白色变灰绿色至红褐色沉淀
FeCl2+2NaOH=Fe(OH)2↓+2NaCl
4Fe(OH)2+O2+2H2O=4Fe(OH)3
2、铁三角:
1.Fe只具有还原性,可以被氧化剂氧化为Fe2+、Fe3+
(1)Fe能被S、Fe3+、Cu2+、H+等较弱氧化剂氧化为Fe2+,
如Fe+S△FeS,Fe+2Fe3+===3Fe2+。
(2)Fe能被Cl2等强氧化剂氧化为Fe3+,如2Fe+3Cl2 点燃2FeCl3。
2.Fe2+既具有氧化性又具有还原性,可以被氧化为Fe3+,也可以被还原为Fe
(1)当Fe2+遇到强氧化剂(如Cl2)时,被氧化为Fe3+,如2Fe2++Cl2===2Fe3++2Cl-。
(2)当Fe2+遇到C、Al、Zn、CO等还原剂时,可以被还原为Fe,如:
Fe2++Zn===Zn2++Fe,FeO+CO Fe+CO2。
3.Fe3+具有较强氧化性,可被还原为Fe2+或Fe
(1)Fe3+被C、CO、Al等还原为Fe,如:Fe2O3+3CO高温2Fe+3CO2,Fe2O3+2Al高温2Fe+Al2O3
(2)Fe3+被Fe、Cu等还原为Fe2+,如:2Fe3++Cu===2Fe2++Cu2+
注意:
1制备Fe(OH)2注意:亚铁盐溶液必须新制,保证无氧氛围
2铁盐可做净水剂原因是Fe3与水反应形成Fe(OH)胶体:Fe3++ 3 H2O =Fe(OH)3(胶体)+3H+四、铁及其化合物转化关系:
五、铜及其化合物
(一)、铜:
(1)物理性质:颜色:红色(紫红色)金属
(2)化学性质:价态:+1(不稳定)+2(稳定)
①与某些非金属单质反应:
2