回归课本复习高中化学
- 格式:doc
- 大小:88.50 KB
- 文档页数:16


回归课本:高三化学内容
江苏省平潮高级中学顾铁军
第一单元:晶体的类型与性质
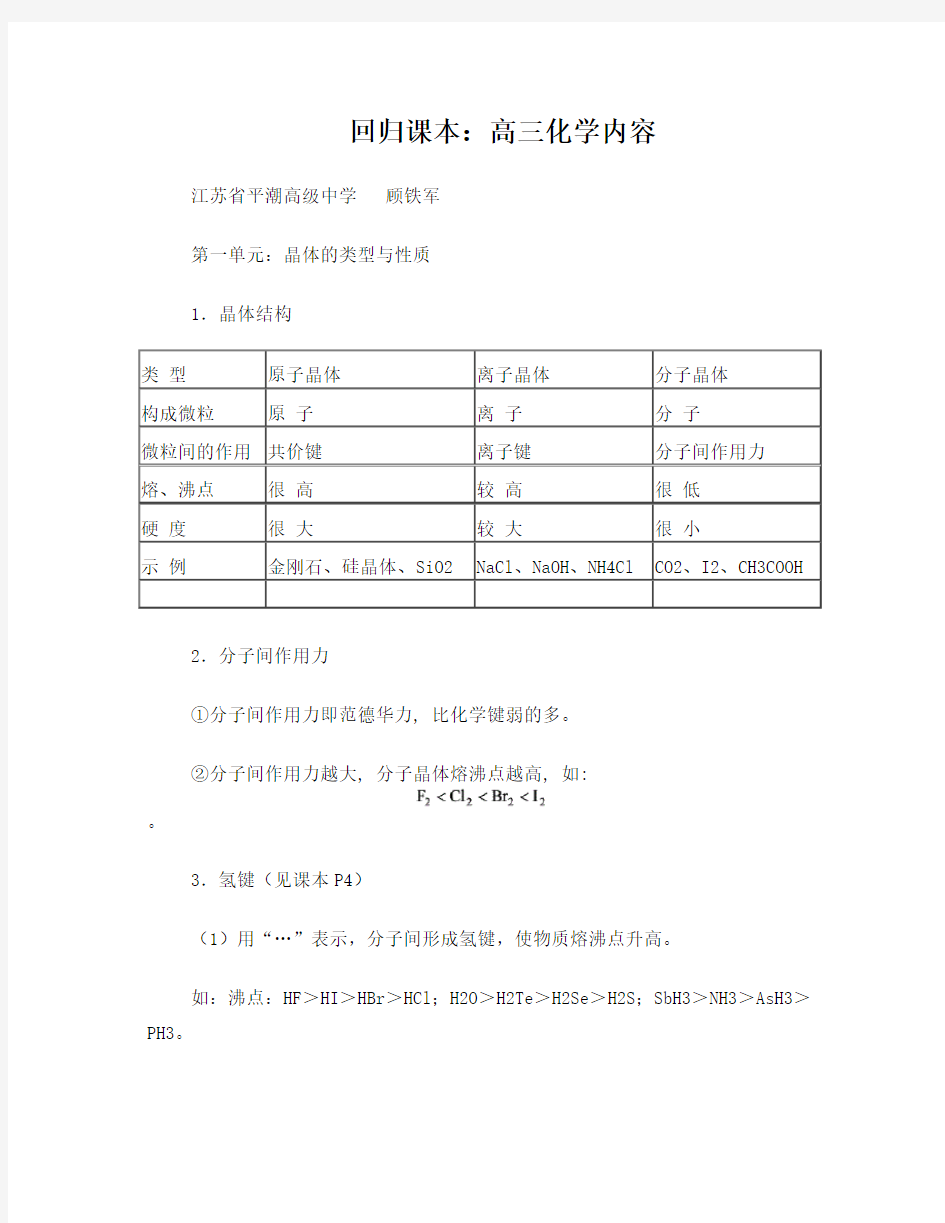
1.晶体结构
类型原子晶体离子晶体分子晶体
构成微粒原子离子分子
微粒间的作用共价键离子键分子间作用力
熔、沸点很高较高很低
硬度很大较大很小
示例金刚石、硅晶体、SiO2 NaCl、NaOH、NH4Cl CO2、I2、CH3COOH 2.分子间作用力
①分子间作用力即范德华力, 比化学键弱的多。
②分子间作用力越大, 分子晶体熔沸点越高, 如:
。
3.氢键(见课本P4)
(1)用“…”表示,分子间形成氢键,使物质熔沸点升高。
如:沸点:HF>HI>HBr>HCl;H2O>H2Te>H2Se>H2S;SbH3>NH3>AsH3>PH3。
(2)每个水分子与相邻4个水分子通过氢键相连,平均每个水分子2个氢键。
每个氟化氢分子与相邻2个水分子通过氢键相连,平均每个HF分子1个氢键。
4.晶体类型的判别
①离子晶体: 含离子键的物质, 如可溶性碱, 大部分盐, 少量金属氧化物及“类盐”。
②原子晶体: 仅有几种: 金刚石、金刚砂(SiC)、石英(SiO2)、单晶硅(Si)。
③分子晶体: 大部分有机物, 所有的酸, 难溶碱, 非金属单质, 某些盐。
5.物质熔沸点的比较及规律:
①分子间作用力
组成和结构相似的物质随着分子质量增大, 分子间作用力也增大, 其熔、沸点升高。如
②各类晶体:一般来说,原子晶体>离子晶体>分子晶体
③同类晶体
原子晶体的熔沸点取决于共价键的键能和键长, 键能越大, 键长越短, 熔沸点越高。如熔、沸点: 晶体硅<金刚砂(SiC)<金刚石。
离子晶体的熔、沸点取决于离子键的强弱, 一般来说, 离子半径越小, 离子电荷越多, 离子键越强, 熔、沸点越高。如
6.实验一:硫酸铜晶体里结晶水含量的测定(见课本P11)
(1)加热时结晶水全部失去的定性判断:蓝色全部变成白色;
加热时结晶水全部失去的定量判断:两次称量质量差不超过0.1g。
(2)误差讨论:
第二单元:胶体的性质及其应用
1.三种分数系的比较
分散系溶液胶体浊液
分散系微粒直径<1nm 1nm~100m >100nm
外观均一、透明较均一、透明不均一、不透明分散质微粒分子、离子大量分子集合体、高分子大量分子集合体能否透过滤纸能能不能
能否透过半透膜能不能不能
稳定性稳定较稳定不稳定2.胶体的精制——渗析。(图见课本P16)
3.胶体的性质
①丁达尔现象——用于区别溶液与胶体。
②布朗运动。
③电泳现象——用于说明胶体微粒带的电性。
金属氧化物,金属氢氧化物形成的胶体其胶粒带正电荷,金属硫化物、非金属氧化物、非金属硫化物形成的胶体其胶粒带负电荷。
④胶体的聚沉:加热,加少量电解质(与胶体微粒带异性电荷数越高的离子凝聚能力越强)、加入带相反电荷的胶体等都可以使胶体聚沉。(选学内容)
第三单元:化学反应中的物质变化与能量变化
1.蓝瓶子实验:课本P28
2.离子反应的本质:反应物的某些离子浓度的减小。(课本P30)
3.判断离子共存
①由于离子间发生化学反应,生成了沉淀、气体、弱电解质(H2O、弱酸、弱碱)或发生氧化还原反应而不能共存。
②由于题目条件和限制(如无色透明、碱性或酸性溶液)而不能共存。“无色”就是指不含有Cu2+、Fe2+、MnO4—等离子。与H+不共存的离子主要有OH—、AlO2—、ClO—、CO32—、HCO3—等多种弱酸根、弱酸的酸式根。与OH—不共存的离子主要有H+、NH4+、Al3+、Fe2+等多种弱碱的阳离子、HCO3—等酸式酸根离子。
③NO3—等离子只在酸性条件下具有氧化性,与S2—、Fe2+等具有较强还原性的离子不能大量共存。ClO—无论在酸、碱、中性条件下都有强氧化性,能氧化Fe2+、S2—、I—等离子。S2—与SO32—在中性或碱性条件下可共存,在酸性条件下不能共存。
④水解能相互促进的某些离子不能共存,如Fe3+、Al3+、NH4+与AlO2ˉ等不能共存。
4.化学反应中能量变化的原因
①化学反应必有新物质生成,新物质的总能量与反应物的总能量不同。
②化学反应中必然能量守恒。
③反应物与生成物的能量差若以热量形式表现,即为放热或吸热,如果反应物所具有的总能量高于生成物所具有的总量,反应为放热反应;如果反应物所具有的总能量低于生成物所具有的总能量,反应为吸热反应。通过研究化学反应中能量变化的原理可知,化学反应的过程,也可看成是“贮存”在物质内部的能量转化为热量等而被释放出来,或者是热量等转化为物质内部的能量而被“贮存”起来的过程。
5.热化学方程式的书写原则
(1) 标明物质的聚集状态如:气、液、固(通常用g、l、s表示)。
(2) 标明吸收或放出的热量值,“+”为吸热,“—”为放热。
(3) 标明吸收或放出的热量的单位,一般采用kJ/mol。
(4) 热化学方程式分子式前的化学计量数可以用分数,它只表示物质的量,不代表分子个数。同一化学反应,因化学计量数不同可有多个热化学方程式,但分子式前面的化学计量数必须与反应热相对应。若化学计量数加倍,则反应热也要加倍。
(5) 两个热化学方程式可以相加或相减,而得到新的热化学方程式。
(6) 要标明反应时的温度与压强(若为25℃,1.01×105Pa可不必标明)。
(7) 当反应逆向进行时,反应热数值相等,符号相反。
6.盖斯定律及其应用
盖斯定律:化学反应不管是一步完成还是分步完成,其反应热是相同的。也就是说,化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。如果一个反应可以分几步进行,则各步反应的反应热之和与该反应一步反应时的反应热是相同的。这就是盖斯定律。
7.燃烧热
(1)定义:在101kPa时1mol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。
燃烧热的定义突出了“101kPa”、“1mol物质”和“完全燃烧生成稳定氧化物”这些关键词。
8.中和热
在稀溶液中,酸跟碱发生中和反应而生成1molH2O,这时的反应热叫做中和热。
在中学阶段,只讨论稀溶液中强酸和强碱的中和反应。
H+(aq)+OH—(aq)= H2O(l);△H = —57.3kJ/mol
实验二:中和热的测定(课本P45)
实验装置:课本P46
9.使用燃烧热与中和热的注意点