西安理工大学《物理化学B》重修试卷
- 格式:doc
- 大小:99.01 KB
- 文档页数:6

物理化学(本科)试卷一、填空题。
在题中“____”处填上答案。
1、微小颗粒物质的化学反应活性_____________。
二、填空题。
在题中“____”处填上答案。
1、朗缪尔吸附等温式bpbp ΓΓ+=∞1的直线形式是____________,或______________。
四、是非题。
在题后括号内,正确的打“√”,错误的打“×”。
1、 毛细现象是由于液体与管壁的湿润程度不同而发生液面弯曲,形成附加压力所致。
是不是?( )2、无机盐在水溶液界面上发生的是正吸附。
是不是?( )五、选择题。
在题后括号内,填上正确答案代号。
1、在一般情况下不考虑表面的存在对系统性质的影响是因为:( )(1)表面状态复杂;(2)表面不重要;(3)表面分子数比内部分子少的多,表面效应不明显;(4)表面分子与内部分子状态一样。
2、 常温下非极性有机液体的表面张力σ (有)与水的表面张力σ (水)的关系存在:( )。
(1)σ (有) = σ (水);(2)σ (有) > σ (水);(3)σ (有) <σ (水) ;(4)不能确定。
4、今有一球形肥皂泡,半径为r ,肥皂水溶液的表面张力为σ,则肥皂泡内附加压力是:( )。
(1)r p σ2=Δ ;(2)r p 2σ=Δ;(3)rp σ4=Δ 。
九、计算题。
请计算下列各题。
( 本 大 题7分 )雾的粒子质量约为1×10-12 g ,试求20℃时其饱和蒸气压与平面水的饱和蒸气压之比。
已知20 ℃时水的表面张力为72.75×10 -3 N ·m -1,体积质量(密度)为0.9982 g ·cm -3,H 2O 的摩尔质量为18.02 g ·mol -1十、计算题。
请计算下列各题。
( 本 大 题9分 )200 ℃时测定O 2 在某催化剂上的吸附作用,当平衡压力为 0.1 MPa 及1 MPa 时,1 g催化剂吸附O 2的量分别为2.5 cm 3及 4.2cm 3 (STP) 设吸附作用服从朗缪尔公式,计算当O 2 的吸附量为饱和吸附量的一半时,平衡压力为多少。
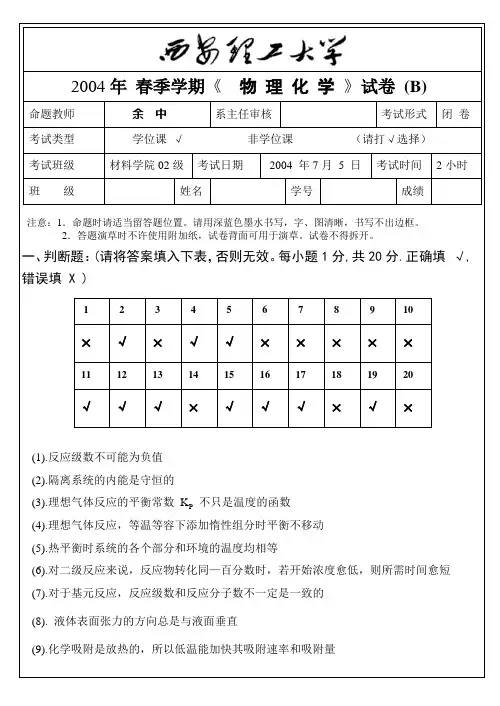
2004年春季学期《物理化学》试卷(B)命题教师余中系主任审核考试形式闭卷考试类型学位课√非学位课(请打√选择)考试班级材料学院02级考试日期2004 年7月 5 日考试时间2小时班级姓名学号成绩注意:1.命题时请适当留答题位置。
请用深蓝色墨水书写,字、图清晰,书写不出边框。
2.答题演草时不许使用附加纸,试卷背面可用于演草。
试卷不得拆开。
一、判断题:(请将答案填入下表,否则无效。
每小题1分,共20分.正确填√, 错误填 X )1 2 3 4 5 6 7 8 9 10⨯√⨯√√⨯⨯⨯⨯⨯11 12 13 14 15 16 17 18 19 20√√√⨯√√√⨯√⨯(1).反应级数不可能为负值(2).隔离系统的内能是守恒的(3).理想气体反应的平衡常数K P不只是温度的函数(4).理想气体反应,等温等容下添加惰性组分时平衡不移动(5).热平衡时系统的各个部分和环境的温度均相等(6).对二级反应来说,反应物转化同—百分数时,若开始浓度愈低,则所需时间愈短(7).对于基元反应,反应级数和反应分子数不一定是一致的(8). 液体表面张力的方向总是与液面垂直(9).化学吸附是放热的,所以低温能加快其吸附速率和吸附量教务处印制共 4 页(第 1 页)(C) K +和Cl -离子运动速度相近 (D) K +和Cl - 原子核半径小 (4). 在等温条件下,气体被固体吸附,气体在该过程的熵变化是(A) 减小 (B) 增大 (c) 不变 (D )无法确定(5).糖可以顺利溶解在水中,这说明固体糖的化学势比糖水中糖的化学势(A) 高 (B) 低 (c) 相等 (D )不可比较(6). 毛细管里装入润湿性液体,当毛细管右端加热时,管内液体将(A) 向右移动 (B) 向左移动 (C) 不移动 (D) 因失去平衡而左右来回移动 (7). 某反应的反应物消耗掉3/4的时间是其半衰期的2倍,则该反应的级数为 (A) 零 级 (B) 一 级 (C) 二 级 (D) 三 级 (8). 盐碱地的农作物长势不良,甚至枯萎,其主要原因是什么 (A) 天气太热 (B).很少下雨 (C) 肥料不足 (D) 水分倒流 (9). 憎液固体,其表面不能为液体所润湿,其相应的接触角θ是(A ) θ = 0˚ (B) θ < 90˚ (C) θ > 90˚ (D) θ可为任意角 (10). 下列几种水,哪种表面张力最大(A )雨 水 (B) 长江水 (C) 普通井水 (D) 海 水 (11). 基元反应:Cl HCl Cl H 2+→+ 的反应分子数是(A) 单分子反应 (B) 双分子反应 (C) 三分子反应 (D )四分子反应(12) 100˚C ,101325 Pa 时H 2O ( l )变为同温同压下的H 2O ( g ),该过程的ΔG 为(A) ΔG > 0 (B) ΔG < 0 (C) ΔG = 0 (D) 无法判断(13). 反应: )g (CO 2)g (O )g (CO 222=+,符合 )CO (C k ⋅=ν,则该反应级数是 (A) 四级 (B) 三 级 (C) 二级 (D) 一级(14).某反应在一定条件下的平衡转化率为30.6%,当有催化剂存在时,其转化率应当是教务处印制共 4 页(第 2 页)教务处印制共 4 页(第 3 页)。
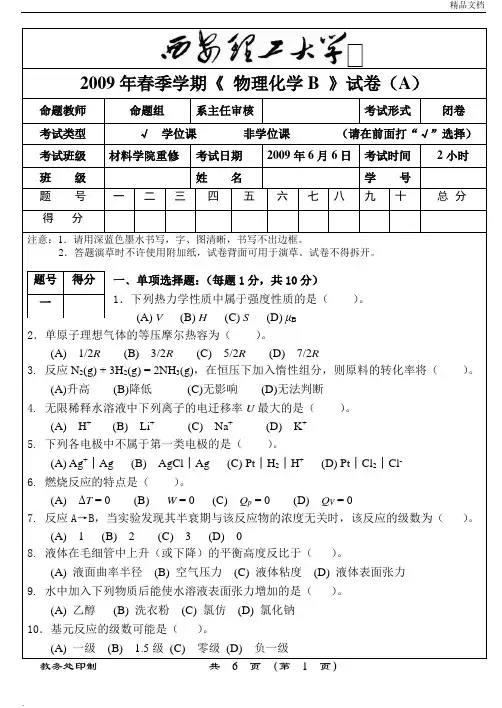
2009年春季学期《 物理化学B 》试卷(A )命题教师 命题组系主任审核考试形式闭卷考试类型 √ 学位课 非学位课 (请在前面打“√”选择) 考试班级 材料学院重修 考试日期 2009年6月6日 考试时间 2小时班 级 姓 名 学 号题 号 一 二 三 四 五 六 七 八 九 十 总 分得 分注意:1.请用深蓝色墨水书写,字、图清晰,书写不出边框。
2.答题演草时不许使用附加纸,试卷背面可用于演草。
试卷不得拆开。
一﹑单项选择题:(每题1分,共10分) 1.下列热力学性质中属于强度性质的是( )。
(A) V (B) H (C) S (D) μB2.单原子理想气体的等压摩尔热容为( )。
(A) 1/2R (B) 3/2R (C) 5/2R (D) 7/2R3. 反应N 2(g) + 3H 2(g) = 2NH 3(g),在恒压下加入惰性组分,则原料的转化率将( )。
(A)升高 (B)降低 (C)无影响 (D)无法判断4. 无限稀释水溶液中下列离子的电迁移率U 最大的是( )。
(A) H + (B) Li + (C) Na + (D) K + 5. 下列各电极中不属于第一类电极的是( )。
(A) Ag +│Ag (B) AgCl │Ag (C) Pt │H 2│H + (D) Pt │Cl 2│Cl - 6. 燃烧反应的特点是( )。
(A) ΔT = 0 (B) W = 0 (C) Q p = 0 (D) Q V = 07. 反应A→B,当实验发现其半衰期与该反应物的浓度无关时,该反应的级数为( )。
(A) 1 (B) 2 (C) 3 (D) 08. 液体在毛细管中上升(或下降)的平衡高度反比于( )。
(A) 液面曲率半径 (B) 空气压力 (C) 液体粘度 (D) 液体表面张力 9. 水中加入下列物质后能使水溶液表面张力增加的是( )。
(A) 乙醇 (B) 洗衣粉 (C) 氯仿 (D) 氯化钠 10.基元反应的级数可能是( )。
**大学学年第二学期期末考试卷(B)4.两个互相平行的无限大均匀带电平板A、B,A板电荷面密度为σ,B板电荷面密度为-3σ,则A板外侧场强大小为___________、B板外侧场强大小为___________、AB之间场强大小为___________。
5. 四分之三的圆弧带电体,半径为R,线电荷密度为λ,求圆心处的电势为__________________。
6.图示BCD是以O为圆心、以R为半径的半圆弧,在A点、O点分别放置电量为+q、-q的点电荷,线段AB=R。
将单位正电荷从B点沿半圆弧轨道BCD移到D点,则电场所作的功为__________________,D点和B点的电势差U D- U B=__________________。
7.如图所示,边长为a的正三角形导线中通有电流,则图中P处的磁感应强度的大小为,方向。
8.二线圈自感系数分别为L1和L2、互感系数为M。
若L1线圈中通电流I1,则通过L2线圈中的磁通量2mϕ = ,通过L1线圈中的磁通量1mϕ=。
9. 在均匀磁场中,有两个平面线圈,其面积A1=3A2,电流I1=I2/2,它们所受最大磁力矩之比M1/M2为。
10.在半径为R的圆柱形区域内,磁感应强度保持均匀,并以dBdt的速率增加,则在离轴线a(a<R)的a处的感生电场的大小E a= ;在离轴线b(b>R)的b处的感生电场的大小E b = ;计算题(每题10分,共60分)二.如图所示,一定质量的理想气体由状态a经b到达c,图中abc为一直线。
求此过程中:(1)气体对外做的功;(2)气体内能的增加;(3)气体吸收的热量。
得分评卷人三.某热机循环过程如图所示,其中Ⅰ—Ⅱ过程是绝热过程,Ⅱ—Ⅲ过程是等温过程,Ⅲ—Ⅰ过程是等压过程,工作物质为双原子气体。
已知:V1=4L,V2=1L,V3=7L, T1=320k,P1=105Pa,求该循环过程的效率。
得分评卷人五. 一球形真空电容器内外球面的半径分别为R1=2cm和R2=4cm,内外两球面的电势差为U0=100V。


物理化学试卷Bdoc含答案2022/2022学年第2学期期末考试化学专业2022级物理化学试卷(B卷)题号得分一二三四五六七总分一、判断题(每小题1.5,共15分)()1.对二组分体系能平衡共存的最多相数为4。
()2.在相图中,相点就是物系点。
()3.状态改变后,状态函数一定都改变。
()4.理想气体绝热变化过程中,W可逆CVT,W不可逆CVT,所以W 绝热可逆W绝热不可逆。
()5.不可逆过程的熵永不减少。
()6.在同一稀溶液中组分B的浓度可用某B,mB,cB表示,其标准态的选择不同,但相应的化学势相同。
()7.在298K时,0.01mol/kg糖水的渗透压与0.01mol/kg食盐水的渗透压相等。
()8.在一定温度、压力下,某反应的rGm0,所以要选择合适的催化剂,使反应得以进行。
()9.Dalton分压定律能应用于实际气体。
()10.在分子速率的三个统计平均值—最概然速率、数学平均速率与根均方速率中,最概然速率最小。
二、单项选择题(每小题2分,共30分)1.范德华状态方程为:()(A)nRT(pn2a/V2)(Vb)(B)nRT(pn2a/V2)(Vnb)(C)nRT(pn2a/V2)(Vnb)(D)nRT(pn2a/V2)(Vnb)2.对实际气体的节流膨胀过程,有:()(A)U0(B)H0(C)T0(D)P03.两个体积相同的烧瓶中间用玻璃管相通,通入0.7mol氮气后,使整个系统密封。
今若将一个烧瓶保持400K温度不变,另一个烧瓶保持300K温度不变,则两瓶中氮气的物质的量之比为:()(A)3:7(B)1:1(C)3:4(D)4:74.在101.325kPa下,385K的水变为同温下的水蒸气,对该变化过程,下列各式中哪个正确:()(A)S体+S环0(B)S体+S环0(C)S体+S环0(D)S体+S环的值不能确定5.对于理想气体,下述结论中正确的是:()T(C)HT(A)HV0p0HVHVTT0(D)HV0(B)HTp00THpHp00TT6.下述说法中,哪一个错误:()(A)体系放出的热量一定等于环境吸收的热量(B)体系温度的降低值一定等于环境温度的升高值(C)热力学平衡时体系的温度与环境的温度相等(D)若体系1与体系2分别与环境达成热平衡,则此两体系的温度相同7.欲测定有机物燃烧热Qp,一般使反应在氧弹中进行,实测得热效应为QV。

陕西物理化学试题及答案一、选择题(每题3分,共30分)1. 下列关于光的描述中,不正确的是()A. 光在真空中传播速度最快B. 光在不同介质中的传播速度不同C. 光在空气中的传播速度与温度无关D. 光的传播不需要介质答案:C2. 根据热力学第一定律,下列说法正确的是()A. 能量守恒B. 能量可以被创造C. 能量可以被消灭D. 能量不能被创造或消灭答案:A3. 以下关于电磁波的描述中,错误的是()A. 电磁波是由变化的电场和磁场交替产生的B. 电磁波可以在真空中传播C. 电磁波的传播速度与光速相同D. 电磁波的传播需要介质答案:D4. 在下列化学反应中,属于放热反应的是()A. 碳燃烧B. 硝酸铵溶于水C. 氢氧化钠溶于水D. 碳酸钙分解答案:A5. 根据布朗运动,下列说法正确的是()A. 布朗运动是液体分子的无规则运动B. 布朗运动是固体颗粒的无规则运动C. 布朗运动是气体分子的无规则运动D. 布朗运动是液体分子的有序运动答案:B6. 下列关于原子结构的描述中,正确的是()A. 原子核由质子和电子组成B. 原子核由质子和中子组成C. 原子核由质子和原子组成D. 原子核由电子和中子组成答案:B7. 下列关于化学键的描述中,错误的是()A. 离子键是由正负离子间的静电作用力形成的B. 共价键是由原子间共享电子对形成的C. 金属键是由金属原子间的电子云形成的D. 分子间作用力是由原子间的化学键形成的答案:D8. 下列关于物质的三态变化的描述中,正确的是()A. 物质的三态变化是物理变化B. 物质的三态变化是化学变化C. 物质的三态变化是核反应D. 物质的三态变化是能量变化答案:A9. 下列关于热力学第二定律的描述中,不正确的是()A. 热能自发地从高温物体传向低温物体B. 热能自发地从低温物体传向高温物体C. 热能不可能自发地从低温物体传向高温物体而不引起其他变化D. 热能不可能自发地从低温物体传向高温物体答案:B10. 下列关于物质的溶解度的描述中,正确的是()A. 溶解度与温度无关B. 溶解度与温度有关C. 溶解度与压力无关D. 溶解度与压力有关答案:B二、填空题(每题5分,共20分)1. 光的三原色是红、绿、______。

学院试卷系别班级姓名准考证号………………………………密………………………………封………………………………线………………………………学院2005—2006学年第一学期期末考试专业级物理化学试卷题号一二三四总分得分得分评卷人一、选择题(每小题2分, 共36分)1、凡是在孤立体系中进行的变化, 其∆U 和∆H 的值一定是:( D)(A)∆U >0, ∆H >0 (B)∆U =0, ∆H =0(C)∆U <0, ∆H <0 (D)∆U =0, ∆H 大于、小于或等于零不能确定。
2、对于吉布斯-杜亥姆公式, 下列叙述不正确的是:(C)(A) X = ∑n B X B(B) ∑n B d X B = 0 (C) ∑n B X B = 0 (D) 表明各物质偏摩尔之间有关系3.在一绝热恒容箱中, 将NO(g)和O2(g)混合,•假定气体都是理想的, 达到平衡后肯定都不为零的量是: (C)(A) Q, W, ΔU (B) Q, ΔU, ΔH(C) ΔH, ΔS, ΔG (D) ΔS, ΔU, W4.在N2和O2混和气体的绝热可逆压缩过程中, 体系的热力学函数变化值在下列结论中正确的是: (C)(A)ΔU=0 (B)ΔF=0 (C)ΔS=0 (D)ΔG=05.关于熵的说法正确的是: (D)(A) 每单位温度的改变所交换的热为熵(B) 可逆过程熵变为零(C) 不可逆过程熵将增加(D) 熵与系统的微观状态数有关6.下列各式哪个表示了偏摩尔量: (A)7、下列叙述中不正确的是: (D)(A) 标准平衡常数仅是温度的函数(B) 催化剂不能改变平衡常数的大小(C) 平衡常数发生变化, 化学平衡必定发生移动, 达到新的平衡(D) 化学平衡发生新的移动, 平衡常数必发生变化8、298K、101.325kPa下, 将50ml与100ml浓度均为1mol·dm-3 萘的苯溶液混合, 混合液的化学势μ为:(C)(A) μ = μ1 + μ2 (B) μ = μ1 + 2μ2(C) μ = μ1 = μ2(D) μ= ⅓μ1+ ⅔μ29、某高压容器中盛有的气体可能是O2.Ar 、CO2.NH3中一种, 在298K 时由5dm3 绝热可逆膨胀到6dm3, 温度降低21K, 则容器中的气体是: (A)(A) O 2 (B) CO 2 (C) NH 3 (D) Ar 10、对于亨利定律, 下列表述中不正确的是: (C )(A) 仅适用于溶质在气相和溶液相分子状态相同的非电解质稀溶液 (B) 其表达式中的浓度可用xB, cB, mB (C) 其表达式中的压力p 是指溶液面上的混合气体总压 (D) 对于非理想溶液 , 只有理想溶液有 11、H2O 、K+、Na+、Cl- 、I- 体系的组分数是: (C) (A) 3 (B) 5 (C) 4 (D) 2 12.恒压下纯物质当温度升高时其吉布斯自由能: ( B )(A )上升 (B )下降 (C )不变 (D )无法确定13.由A 及B 二种液体组成理想溶液, A.B 的饱和蒸气压分别为p*A.p*B, x 为液相组成, y 为气相组成, 若p*A > p*B( * 表示纯态), 则: (D )(A) x A > x B (B) x A > y A (C) 无法确定 (D) x A < y A 14.下列叙述中错误的是: (A)(A) 水的三相点的温度是273.15K, 压力是610.62 Pa (B) 三相点的温度和压力仅由系统决定, 不能任意改变 (C) 水的冰点温度是0℃(273.15K), 压力是101325 Pa (D) 水的三相点f = 0, 而冰点f = 115、273K, 2P0下液态水和固态水的化学势分别为µ(l )和µ(s )两者的关系是:(C )(A )µ(l )大于µ(s ) (B )µ(l )等于µ(s ) (C )µ(l )小于µ(s ) (D )不能确定16.已知下列反应的平衡常数: H2(g) + S(s) = H2S(s) ① K1 ;S(s) + O2(g) = SO2(g) ② K2 。
2020年春季学期《大学物理A (下)/A (下)卓》试卷A 命题教师国家题库 系主任审核 侯磊 考试形式 开卷 考试类型 √ 学位课 非学位课 (请在前面打“√”选择)考试班级 重修 考试日期 20年6月13日 考试时间 2小时 注意:1.请用深蓝色、黑色笔书写,字、图清晰,答卷手机竖立拍照,照片清晰可打印。
2.答题时请按照答卷提示位置答题,并在每页注明班级、姓名、学号,以及共几页第几页)。
1、(本题10分)在双缝干涉实验中,波长λ=550 nm 的单色平行光垂直入射到缝间距a =2×10-4 m 的双缝上,屏到双缝的距离D =2 m 。
求:(1) 中央明纹两侧的两条第10级明纹中心的间距;(2) 用一厚度为e =6.6×10-6 m 、折射率为n =1.58的玻璃片覆盖一缝后,零级明纹将移到原来的第几级明纹处?(1 nm = 10-9 m)2、(本题10分)(1) 在单缝夫琅禾费衍射实验中,垂直入射的光有两种波长,λ1=400 nm ,λ2=760 nm 。
已知单缝宽度a =1.0×10-2 cm ,透镜焦距f =50 cm 。
求两种光第一级衍射明纹中心之间的距离。
(2) 若用光栅常数d =1.0×10-3 cm 的光栅替换单缝,其他条件和上一问相同,求两种光第一级主极大之间的距离。
3、(本题10分)电荷线密度为λ的“无限长”均匀带电细线,弯成图示形状。
若半圆弧 AB 的半径为R ,试求圆心O 点的场强。
共 3 页 (第1 页)4、(本题10分)如图所示,一内半径为a 、外半径为b 的金属球壳,带有电荷Q ,在球壳空腔内距离球心r 处有一点电荷q 。
设无限远处为电势零点,试求:(1) 球壳内外表面上的电荷。
(2) 球心O 点处,由球壳内表面上电荷产生的电势。
(3) 球心O 点处的总电势。
5、(本题10分)已知一带电量为Q 的圆柱形电容器,由半径分别为R A 、R B ,长度为L 的两个同轴金属圆柱面构成,L >> R B ,忽略边缘效应。

,考试作弊将带来严重后果!华南理工大学期末考试《物理化学》(48、56、64学时)试卷(B)1. 考前请将密封线内填写清楚;2. 所有答案请直接答在试卷上;3.考试形式:闭卷;选择题.(每题2分,10题共20分)1. 已知反应CO(g)+1/2O2(g) →CO2(g) 的焓变为△H,下列说法中何者是不正确?A. △H是CO2(g) 的生成焓B. △H是CO(g)的燃烧焓C. △H是负值D. △H与反应△U的数值不等2. 室温下,10 p O-的理想气体绝热节流膨胀至5p O-的过程有:(1) W < 0 ;(2) T1> T2;(3) Q = 0 ;(4) △S > 0A. (3)、(4)B. (2)、(3)C. (1)、(3)D. (1)、(2)3. 反应N2(g) + 3H2(g) = 2NH3(g) 可视为理想气体间反应,在反应达平衡后,若维持系A. K pθ不变,平衡时N2和H2的量将增加,而NH3的量减少B. K pθ不变,且N2,H2,NH3的量均不变C. K pθ不变,平衡时N2和H2的量将减少,而NH3的量增加D. K pθ 增加,平衡时N2和H2的量将减少,NH3的量增加4. 298K时A和B两种气体在某一溶剂中溶解的享利系数分别为k A和k B,且知k A>k B,A和B压力相同时,在该溶剂中所溶解的量是( )A. A的量大于B的量B. A的量小于B的量C. A的量等于B的量 C. A的量与B的量无法比较5. NH4HS(s) 和任意量的NH3(g) 及H2S(g) 达平衡时有( )A. C = 2,P = 2,F = 2;B. C = 1,P = 2,F = 1;C. C = 2,P = 3,F = 2;D. C = 3,P = 2,F = 3;6. 下列纯物质两相平衡有关的描述,不正确的是( )A.沸点将随压力增加而升高B. 熔点将随压力增加而升高C.蒸气压将随温度升高而加大D. 升华温度将随压力增大而升高7. 同一温度、压力下,一定量某纯物质的熵值______________ 。
《物理化学》试卷及答案解析一、填空题(每小题2分,共20分)1、状态函数可分为两类:其数值在系统中具有加和性的是,请举三个这类函数的例子;其数值取决于系统自身而与系统中物质数量无关的是,请举三个这类函数的例子。
2、写出Joule-Thomson系数的定义式:。
若Joule-Thomson系数大于0,则该气体经节流过程后,随压力降低,温度。
3、可逆热机的效率与两热源温度的关系是;在其他条件都相同的前提下,用可逆热机去牵引机车,机车的速度将会是。
4、Zn与稀硫酸作用,其他条件相同的情况下,分别在敞口容器中进行和在密闭容器中进行,所放出的热量进行比较,前者后者。
(填“<”、“>”或“=”)5、NH4Cl(s)在真空容器中分解生成NH3(g)和HCl(g)达平衡,该系统的组分数为,相数为,自由度数为。
6、某分解反应为A(s) = 2B(g)+C(g) ,气体视为理想气体,其标准平衡常数K o与解离压力P 之间的关系是。
7、双变量体系的热力学基本公式:dU= PdV ;dG= VdP。
8、在200℃和25℃之间工作的卡诺热机,其效率为%。
9、纯物质混合形成理想液态混合物时,△mix V 0,△mix H 0,△mix S 0,△mix G 0。
(填“<”、“>”或“=”)10、理想气体反应,标准平衡常数K o与用分压表示的经验平衡常数K p之间的关系是;标准平衡常数K o与用物质的量分数表示的经验平衡常数K x之间的关系是。
二、选择题(每小题2分,共20分)1、某气体的压缩因子Z> 1,表示该气体比理想气体()(A)容易压缩(B)不易压缩(C)容易液化(D)不易液化2、关于气体的隙流,下列说法错误的是()(A)气体隙流速度与摩尔质量的平方根成正比(B)隙流定律可以用来求气体的摩尔质量(C)利用隙流作用可以分离摩尔质量不同的气体(D)气体分子运动论是隙流定律的理论依据3、系统从一个状态经不可逆过程到达另一状态,系统的ΔS ()(A)大于零(B)小于零(C)等于零(D)无法确定4、碳酸钠和水可以形成Na2CO3·H2O,Na2CO3·7H2O,Na2CO3·10H2O三种水合物,在101.3kPa 时该物系共存的相数最多为()(A)2 (B)3 (C)4 (D)55、常压下-10℃过冷水变成-10℃的冰,此过程的()(A)ΔG<0 ,ΔH>0 (B)ΔG>0 ,ΔH>0(C)ΔG=0 ,ΔH=0 (D)ΔG<0 ,ΔH<06、A、B两组分的气液平衡T-x图上,有一最低恒沸点,恒沸物组成为x A=0.7。
装订钱(答案不得超过此线)3. 在25℃的标准状态下C 2H 6(g)的 c m H ∆-c m U ∆=( ) kJ 4.根据d G =V d p -S d T 可知任一化学反应的r m pV T ∂∆⎛⎫⎪∂⎝⎭=( )。
5.在温度T 时,理想稀溶液中溶剂A 的化学势可表示为:μA =( )。
6.在某一温度T 的抽空容器中,NH 4HCO 3(s )进行分解反应NH 4HCO 3(s)=NH 3(g)+CO 2(g)+H 2O(g)达到平衡时所产生气体的总压力为60 kPa ,则此热分解反应的标准平衡常数K =( )。
7.某反应的r m H ∆与T 的关系为 r m H ∆/(J ⋅mol -1)=83.145 T / K -0.83145则此反应的d 1n K /d T =( )。
8. 在80℃下,将过量的NH 4HCO 3(s)放入真空密闭容器内,NH 4HCO 3(s)按下式进行分解:NH 4HCO 3(s)= NH 3(g)+CO 2(g)+H 2O(g) 达平衡后,系统的C =( ); F =( )。
9.有原电池如下:Ag(s) | AgCl 2(s)|Cl{a (Cl -1)=0.1}¦¦Br -1{a (Br -1)=0.2}|AgBr(s) | Ag(s)若已知25℃时难溶盐AgCl 及AgBr 的溶度积K sp 分别为1.0 ×10-10与2.0×10-13,则上述原电池在25℃时的标准电动势E =( )V 。
10. 分散在大气中的小液滴和小气泡,或者毛细管中的凸液面和凹液面,所产生的附加压力的方向均指向于( ) 12.胶体的动力性质包括有( )等。
13. NaNO 3 , NaC1, MgC12和AlC13四种电解质对某溶胶的聚沉值(mmol ⋅dm -3)分别为300, 295, 25和0.5,根据以上数据可以说明该溶胶的胶粒是带( )电荷。
12020-2021《物理化学》期末课程考试试卷B2适用专业: 试卷所需时间:120分钟 闭卷 试卷总分 :100分 考试说明:自带计算器 一、 选择题 (2.5×16=40分)1、溶剂服从拉乌尔定律,溶质服从亨利定律的二元溶液是: A 、理想稀溶液 B 、理想溶液 C 、实际溶液 D 、一切溶液2、某一个二组分溶液由2.0 mol A 和1.5 mol B 混合而成,其体积V 为425 cm 3。
已知组分B 的偏摩尔体积V B =250 cm 3mol -1,则组分 A 的偏摩尔体积 V A 为:A 、20 cm 3mol -1B 、25 cm 3mol -1C 、10 cm 3mol -1D 、15 cm 3mol -1 3、298K 时,要使下列电池成为自发电池:Na(Hg)(a 1) ∣Na +(aq) ∣Na(Hg)(a 2),则必须使两个活度的关系为:A 、a 1 < a 2B 、a 1 = a 2C 、a 1 > a 2D 、a 1 , a 2可取任意值 4、对于一个一级反应,如其半衰期t 1/2在 0.01s 以下即称为快速反应,此时它的速率常数k 值在:A 、69.32 s -1以上B 、6.932 s -1以上C 、0.06932 s -1以上D 、6.932 s -1以下 5、理想气体的自由膨胀过程为:A 、Q>0B 、ΔU<0C 、W<0D 、ΔH=0 6、在高原地带敞开体系中,水的沸点比地面: A 、高 B 、低 C 、相同 D 、不能确定7、工作于100℃ 和25℃ 的两个大热源之间的可逆机,其效率是 A 、20% B 、30% C 、50% D 、75%8、刚性密闭容器中,理想气体A(g) + B(g) = Y(g)达到平衡时,若在一定温度下加入定量的惰性气体,平衡将:A 、向右移动B 、向左移动C 、不移动D 、无法确定 9、ΔH 是指体系的什么:A 、反应热B 、吸收的热量C 、焓的增量D 、生成热 10、溶剂服从拉乌尔定律,溶质服从亨利定律的二元溶液是:A 、理想稀溶液B 、理想溶液C 、实际溶液D 、一切溶液 11. 物质量为n 的理想气体,该气体的哪一组强度物理量确定后其他状态函数方有定值的是:A 、P ,TB 、VC 、T ,VD 、P12、以一定速度发生变化的孤立体系,其总熵变: A 、不变 B 、可能增大也可能减少 C 、总是增大 D 、增大或不变13、总压为101.3kPa 的容器中装有基本混合气体实验测得其中O 2的分压为20.26kPa ,则氧所占摩尔分数为:A 、0.20B 、0.50C 、0.60D 、0.80 14、浓度为 0.1mol ·kg 的 MgCl 2水溶液,其离子强度为: A 、0.1 mol ·kg B 、0.15 mol ·kg C 、0.3 mol ·kg D 、0.2 mol ·kg 15、克劳修斯-克拉贝龙方程可用于:A 、液-气两相平衡B 、液-液两相平衡C 、固-液两相平衡D 、固-固两相平衡院系: 专业班级: 姓名: 学号: 装 订 线16、反应2NO (g) + O2(g) = 2 NO2 (g)是放热的,当反应在某温度、压力下达到平衡时,若使平衡向右移动,则应采取的措施是:A、降低温度和减小压力B、降低温度和增大压力C、升高温度和减小压力D、升高温度和增大压力二、填空题(每空2分,共10分)1、非理想气体进行绝热自由膨胀,则△U,W,△H中哪个不为0;2、热力学第三定律数学表示方法:;3、绝热箱中装有水,水中绕有电阻丝,由电池供给电流,设电池在放电时无热效应,通电后电阻丝和水的温度都上升,若以电池为体系,以水和电池为环境,则Q O(大于,等于, 小于),W0(小于,等于,小于), △U0(大于,等于,小于)三、计算题(每题10分,共50分)1、已知25℃时反应N 2O 4 ( g ) = 2 NO2 ( g ) 的K P=0.141,求25℃时①N 2O 4 ( g , P =1大气压) = 2 NO2 ( g , P =1大气压) 的△G?②1/2 N 2O 4 ( g ,P =1大气压) = NO2 ( g ,P =1大气压) 反应的K P?2、某物质按一级反应分解,已知反应完成40%需时50min,求(1)以秒(s)为单位的速率常数;(2)完成80%反应所需时间。
2012~2013学年第二学期化学与材料学院10级应用化学专业《物理化学(下)》期末试卷B 答案注意事项:考生信息必须填入信息栏内指定位置。
题号 一 二(1) 二(2) 三(1) 三(2) 三(3) 三(4) 四 总分 复核人得分评卷人一、选择题(共20题,每题2分,共40分)1.下列电解质溶液中,离子平均活度系数r ±最小的是(设浓度均为0.01mol·kg -1) (D ) A. ZnSO 4 B. CaCl 2 C. KCl D. LaCl 32. 298 K 时,电池Ag(s)|AgI(s)|KI(0.02 mol·kg -1,γ±= 0.905)||KOH(0.05mol·kg -1,γ±= 0.820)|Ag 2O(s)|Ag(s) 的电动势为0.456 V ,当电池反应进行至电子传输量为1mol 时,这时电池反应的平衡常数为 (C ) A .5.16×107 B.1.9×10-8 C. 1.17×108 D.1.22×1093.25℃,将含有Fe 2+和Fe 3+的水溶液与Fe 粉一起振荡,使其达平衡,求出K= [Fe 2+]3[Fe 3+]-2=8.98×1040,其φө(Fe 2+|Fe) = -0.4402 V ,则下列答案正确的是: (C ) A. φө(Fe 3+|Fe 2+) = 0.771 V , φө(Fe 3+|Fe) = 0.3308 V B. φө(Fe 3+|Fe 2+) = 1.6514 V , φө(Fe 3+|Fe) = 0.8439 V C. φө(Fe 3|Fe 2+) = 0.771 V , φө(Fe 3+|Fe) =-0.0365 V D. φө(Fe 3+|Fe 2+) = 1.6514 V , φө(Fe 3+|Fe) =-0.0365 V4. 对于混合电解质溶液中,下列表征导电性的量中不具有加和性的是 (A ) A. 电导 B. 电导率 C. 摩尔电导率 D. 极限摩尔电导率5. 丹聂耳电池(铜-锌电池)在充电和放电时锌电极被称为 (C ) A. 负极和阴极 B. 正极和阳极 C. 负极和阳极 D. 正极和阴极6. 某一反应在有限时间内可完全反应,所需时间为c o /k ,该反应级数是 (A ) A. 0级 B. 一级 C. 二级 D. 三级7. 某反应速率常数k =2.31×10-2mol -1·dm 3·s -1,反应起始浓度1.0mol·dm -3,则其反应半衰期是(A ) A. 43.29s B. 15s C. 30s D. 21.65s 8. 乙酸高温分解时,实验测得CH 3COOH (A )、CO (B )、CH=CO (C )的浓度随时间的变化曲线如图所示,由此可以断定该反应是 (C )A. 基元反应B. 对峙反应C. 平行反应D. 连串反应9. 为了测定吸附剂的比表面,要求吸附剂和吸附质之间最好的情况是什么? (A ) A. 只有物理吸附 B. 只有化学吸附 C. 既有物理又有化学吸附 D. 没有吸附 10. 关于绝对反应速率理论的叙述中,不正确的是 (D ) A. 反应分子组实际经历途径中每个状态的能量都是最低B. 势能垒是活化络合物分子在马鞍点的能量与反应物分子的平均能量之差C. 活化络合物在马鞍点的能量最高D. 反应分子组越过马鞍点后可能返回始态11. 体温计打碎后,落在水泥地面上的水银基本呈球形,这说明 (D ) A. r 汞+ r 汞-水泥地面< r 水泥地面 B. r 汞> r 水泥地面 C. r 汞< r 水泥地面 D. r 汞+ r 汞-水泥地面> r 水泥地面12. 某温度压力下,有大小相同的水滴、水泡和气泡,其气相部分相同,见图,它们三者表面Gibbs 自由能大小是 (B ) A. G a =G c <G b B. G a =G b <G c C. G a <G b <G c D. G a =G b =G c13, 下列摩尔浓度相同的各物质的稀水溶液中,哪一种溶液的表面发生负吸附? (A ) A. 硫酸 B. 己酸 C. 硬脂酸 D. 苯甲酸 14. 一根毛细管插入水中,液面上升的高度为h ,若在水中加入少量的NaCl 后,这时毛细管中液面上升的高度为 (C )A. 等于hB. 小于hC. 大于hD. 无法确定考生信息栏院(系) 班级 姓名 学号………………………………………………装……………………订……………………线……………………………………15. 有机液体与水形成W/O 型还是O/W 型乳状液与乳化剂的HLB 值有关,一般是 (C ) A. HLB 值大,易形成W/O 型 B. HLB 值小,易形成O/W 型 C. HLB 值大,易形成O/W 型 D. HLB 值小,不易形成W/O 型 16. 将不同蛋白质分子分离,工业上通常采用的方法是利用溶胶性质中的 (A ) A. 电泳 B.电渗 C. 沉降 D. 扩散 17. 对于AgI 水溶胶,当以KI 为稳定剂时,其结构式可以表示为:[(AgI)m · nI -·(n-x )K +]x-·x K +,则被称为胶核的是指 (C )A. (AgI)m · nI -B. [(AgI)m · nI -·(n-x )K +]x-C. (AgI)mD. [(AgI)m · nI -·(n-x )K +]x-·x K + 18. 对于Donnan 平衡, 下列说法正确的是 (A ) A. 膜两边同一电解质化学势相同 B. 膜两边带电粒子的总数相同 C. 膜两边同一电解质浓度相同 D. 膜两边的离子强度相同19. 胶体粒子的Zeta 电势是指 (D ) A. 固体表面处与本体溶液之间的电势差 B. 扩散层处与本体溶液之间的电势差 C. 紧密层、扩散层分界处与本体溶液之间的电势差 D. 固液之间可以相对移动处与本体溶液之间的电势差20. 使用瑞利(Reyleigh)散射光强度公式,下列问题中可以解决的是 (A ) A. 溶胶粒子的大小 B. 溶胶粒子的形状 C. 散射光的振幅 D.散射光的波长二、简答题(共两题,每题5分,共10分)1. 等体积的0.10mol.dm -3KCl 和0.08mol.dm -3的AgNO 3溶液混合以制成AgCl 溶胶。
一、选择题(每小题2分,共24分)1. 某真实气体的压缩因子Z <1,则表示该气体比理想气体( )。
① 易被压缩 ② 难被压缩 ③ 易液化 ④ 难液化2. 凡是在孤立系统中进行的变化,其ΔU 和ΔH 的值一定是( )。
① ΔU >0,ΔH >0 ② ΔU =0,ΔH =0③ ΔU <0,ΔH <0 ④ ΔU =0,ΔH 不确定3. 当理想气体反抗一定的压力作绝热膨胀时,则( )。
① 焓总是不变 ② 内能总是增加 ③ 焓总是增加 ④ 内能总是减少4. 理想气体在等温条件下反抗恒定外压膨胀,该变化过程中系统的熵变sys S Δs 及环境的熵变amb ΔS 应为( )。
① sys S Δ>0, amb ΔS =0 ② sys S Δ<0,amb ΔS =0③ sys S Δ>0,amb ΔS <0 ④ sys S Δ<0,amb ΔS >05. 四份质量相等的水中,分别加入相等质量的下列物质,水溶液凝固点最低的是( )。
① 葡萄糖(式量180) ② 甘油(式量92)③ 蔗糖(式量342) ④ 尿素(式量60)6. 电池在恒温、恒压下可逆放电时,与环境交换的热等于( )① 0 ② ΔH ③ T ΔS ④ -ZFE7. 下列偏导数中哪个不是偏摩尔量?( )。
① C T,P,n B n V ⎪⎪⎭⎫ ⎝⎛∂∂ ②C T,P,n B n G ⎪⎪⎭⎫ ⎝⎛∂∂ ③,,C C B T p n n μ⎛⎫∂ ⎪∂⎝⎭ ④CT,P,n B n A ⎪⎪⎭⎫ ⎝⎛∂∂ 8. 恒温恒压下B 、C 两物质在α和β两相中达分配平衡,下列何式能成立( )。
①)()(βμαμC B = ②)()(βμαμB B = ③ )()(βμβμC B = ④)()(αμαμC B =9. 水、苯、苯甲酸系统,当指定温度后,系统最多可能有几个相平衡共存?( )。
① 1 ②2 ③ 3 ④ 410. 在一个绝热刚瓶中,发生一个放热的分子数增加的化学反应,那么( )。
2009年春季学期《 物理化学B 》试卷(A )
命题教师 命题组
系主任审核
考试形式
闭卷
考试类型 √ 学位课 非学位课 (请在前面打“√”选择) 考试班级 材料学院重修 考试日期 2009年6月6日 考试时间 2小时
班 级 姓 名 学 号
题 号 一 二 三 四 五 六 七 八 九 十 总 分
得 分
注意:1.请用深蓝色墨水书写,字、图清晰,书写不出边框。
2.答题演草时不许使用附加纸,试卷背面可用于演草。
试卷不得拆开。
一﹑单项选择题:(每题1分,共10分) 1.下列热力学性质中属于强度性质的是( )。
(A) V (B) H (C) S (D) μB
2.单原子理想气体的等压摩尔热容为( )。
(A) 1/2R (B) 3/2R (C) 5/2R (D) 7/2R
3. 反应N 2(g) + 3H 2(g) = 2NH 3(g),在恒压下加入惰性组分,则原料的转化率将( )。
(A)升高 (B)降低 (C)无影响 (D)无法判断
4. 无限稀释水溶液中下列离子的电迁移率U 最大的是( )。
(A) H + (B) Li + (C) Na + (D) K + 5. 下列各电极中不属于第一类电极的是( )。
(A) Ag +│Ag (B) AgCl │Ag (C) Pt │H 2│H + (D) Pt │Cl 2│Cl - 6. 燃烧反应的特点是( )。
(A) ΔT = 0 (B) W = 0 (C) Q p = 0 (D) Q V = 0
7. 反应A→B,当实验发现其半衰期与该反应物的浓度无关时,该反应的级数为( )。
(A) 1 (B) 2 (C) 3 (D) 0
8. 液体在毛细管中上升(或下降)的平衡高度反比于( )。
(A) 液面曲率半径 (B) 空气压力 (C) 液体粘度 (D) 液体表面张力 9. 水中加入下列物质后能使水溶液表面张力增加的是( )。
(A) 乙醇 (B) 洗衣粉 (C) 氯仿 (D) 氯化钠 10.基元反应的级数可能是( )。
(A) 一级 (B) 1.5级 (C) 零级 (D) 负一级
题号 得分 一
五、问答题(每题4分,共20分)
1.某理想气体从T 1变化到T 2,请推导出ΔH -ΔU 的关系式。
2. 用E θ(Cu +/Cu)和E θ(Cu 2+/Cu)表示E θ(Cu 2+/Cu +)。
3.今有下列气相复合反应
其中C 是活性中间体。
用稳态近似法导出速率d c D /d t 的表示式。
题号 得分 五。