选修3-分子的结构与性质
- 格式:docx
- 大小:875.33 KB
- 文档页数:16





分子的结构与性质分子是由原子通过化学键连接而成的,是化学物质的最小单位。
分子的结构决定着其性质,包括物理性质如熔点、沸点、密度等,以及化学性质如反应性、稳定性等。
首先,原子的种类对分子的特性有很大影响。
不同的原子有不同的电子层结构和化学性质,这会直接影响到分子的化学反应和性质。
例如,氧原子具有较强的电负性,能够与其他原子共享电子形成氧化键,使得含氧原子的分子具有电负性,容易与其他物质发生反应。
另外,原子的核电荷与电子云之间的相互作用也会影响到分子的结构和性质。
其次,原子之间的键是分子结构的基础。
分子中的原子通过化学键连接在一起,常见的化学键包括共价键、离子键和金属键。
其中,共价键是最常见的一种键,分子中的原子通过共享电子形成共价键。
共价键的强弱直接影响到分子的结构和性质。
共价键强一般会导致分子结构紧密,分子相对稳定,例如一氧化碳(CO)分子中的碳氧非常稳定;相反,共价键弱会导致分子结构松散,分子相对较不稳定,容易发生反应。
此外,分子中原子之间的键的排布也会直接影响到分子的性质。
根据分子的排布形式,分子可以分为线性分子、非线性分子和扭曲分子等不同类型。
线性分子中原子排列成一条直线,如一氧化碳(CO)分子;非线性分子中原子排列呈现非直线形状,如水(H2O)分子;扭曲分子则是由于原子间的键角度不均匀而形成的分子,如甲烷(CH4)分子。
分子的性质主要包括物理性质和化学性质。
物理性质是描述物质在物理条件下的特性,如熔点、沸点、密度等。
分子的物理性质受分子结构的影响。
例如,分子结构复杂、分子间力较强的分子通常具有较高的熔点和沸点,如聚乙烯蜡;而分子结构简单、分子间力较弱的分子则通常具有较低的熔点和沸点,如乙醚。
化学性质是描述物质在化学反应中的特性,如反应性、稳定性等。
分子的化学性质受分子结构和化学键的影响。
例如,含有活泼的化学键或不稳定原子的分子通常会具有较高的反应活性,容易发生化学反应。
另外,分子中的官能团也会影响到其化学性质,不同的官能团会引起不同的化学反应。

高中化学选修3物质结构与性质知识点总结主要知识要点:1、原子结构2、元素周期表和元素周期律3、共价键4、分子的空间构型5、分子的性质6、晶体的结构和性质(一)原子结构1、能层和能级(1)能层和能级的划分①在同一个原子中,离核越近能层能量越低。
②同一个能层的电子,能量也可能不同,还可以把它们分成能级s、p、d、f,能量由低到高依次为s、p、d、f。
③任一能层,能级数等于能层序数。
④s、p、d、f……可容纳的电子数依次是1、3、5、7……的两倍。
⑤能层不同能级相同,所容纳的最多电子数相同。
(2)能层、能级、原子轨道之间的关系每能层所容纳的最多电子数是:2n2(n:能层的序数)。
2、构造原理(1)构造原理是电子排入轨道的顺序,构造原理揭示了原子核外电子的能级分布。
(2)构造原理是书写基态原子电子排布式的依据,也是绘制基态原子轨道表示式的主要依据之一。
(3)不同能层的能级有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、E (5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。
原子轨道的能量关系是:ns<(n-2)f <(n-1)d <np(4)能级组序数对应着元素周期表的周期序数,能级组原子轨道所容纳电子数目对应着每个周期的元素数目。
根据构造原理,在多电子原子的电子排布中:各能层最多容纳的电子数为2n2 ;最外层不超过8个电子;次外层不超过18个电子;倒数第三层不超过32个电子。
(5)基态和激发态①基态:最低能量状态。
处于最低能量状态的原子称为基态原子。
②激发态:较高能量状态(相对基态而言)。
基态原子的电子吸收能量后,电子跃迁至较高能级时的状态。
处于激发态的原子称为激发态原子。
③原子光谱:不同元素的原子发生电子跃迁时会吸收(基态→激发态)和放出(激发态→较低激发态或基态)不同的能量(主要是光能),产生不同的光谱——原子光谱(吸收光谱和发射光谱)。
利用光谱分析可以发现新元素或利用特征谱线鉴定元素。
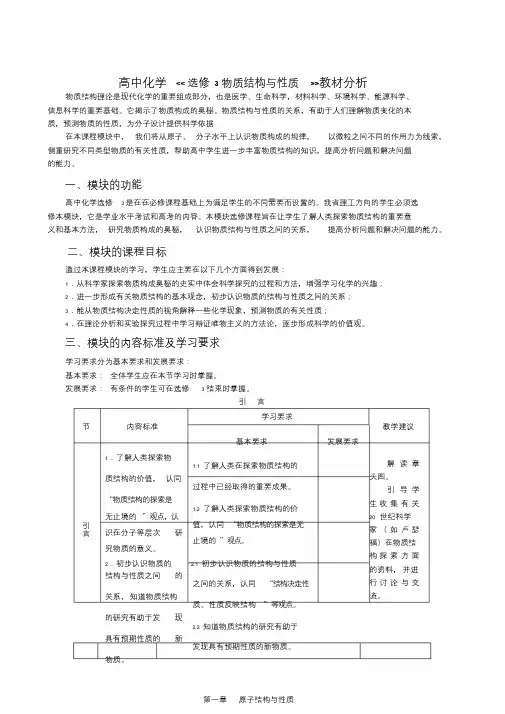
高中化学<< 选修3物质结构与性质>>教材分析物质结构理论是现代化学的重要组成部分,也是医学、生命科学,材料科学、环境科学、能源科学、信息科学的重要基础。
它揭示了物质构成的奥秘。
物质结构与性质的关系,有助于人们理解物质变化的本质,预测物质的性质,为分子设计提供科学依据在本课程模块中,我们将从原子、分子水平上认识物质构成的规律,以微粒之间不同的作用力为线索,侧重研究不同类型物质的有关性质,帮助高中学生进一步丰富物质结构的知识,提高分析问题和解决问题的能力。
一、模块的功能高中化学选修 3 是在在必修课程基础上为满足学生的不同需要而设置的。
我省理工方向的学生必须选修本模块,它是学业水平考试和高考的内容。
本模块选修课程旨在让学生了解人类探索物质结构的重要意义和基本方法,研究物质构成的奥秘,认识物质结构与性质之间的关系,提高分析问题和解决问题的能力。
二、模块的课程目标通过本课程模块的学习,学生应主要在以下几个方面得到发展:1.从科学家探索物质构成奥秘的史实中体会科学探究的过程和方法,增强学习化学的兴趣;2.进一步形成有关物质结构的基本观念,初步认识物质的结构与性质之间的关系;3.能从物质结构决定性质的视角解释一些化学现象,预测物质的有关性质;4.在理论分析和实验探究过程中学习辩证唯物主义的方法论,逐步形成科学的价值观。
三、模块的内容标准及学习要求学习要求分为基本要求和发展要求:基本要求:全体学生应在本节学习时掌握。
发展要求:有条件的学生可在选修 3 结束时掌握。
引言学习要求节内容标准教学建议基本要求发展要求引言1.了解人类探索物1.1 了解人类在探索物质结构的质结构的价值,认同过程中已经取得的重要成果。
“物质结构的探索是1.2 了解人类探索物质结构的价无止境的”观点,认值,认同“物质结构的探索是无识在分子等层次研止境的”观点。
究物质的意义。
2.初步认识物质的 2.1 初步认识物质的结构与性质结构与性质之间的之间的关系,认同“结构决定性关系,知道物质结构质、性质反映结构”等观点。

第2节分子结构与性质考纲点击1.了解共价键的主要类型σ键和π键,能用键能、键长、键角等说明简单分子的某些性质。
2.了解杂化轨道理论及常见的杂化轨道类型(sp、sp2、sp3),能用价层电子对互斥理论或者杂化轨道理论推测常见的简单分子或离子的空间结构。
3.了解简单配合物的成键情况。
4.了解化学键和分子间作用力的区别。
5.了解氢键的存在对物质性质的影响,能列举含有氢键的物质。
一、共价键1.本质在原子之间形成____________。
2.基本特征具有________性和________性。
3.共价键的类型分类依据类型形成共价键的原子轨道重叠方式[来源学+科+网Z+X+X+K]σ键电子云“__________”重叠[来源:1][来源:]π键电子云“__________”重叠形成共价键的电子对是否偏移极性键共用电子对______偏移非极性键共用电子对________偏移4(1)σ键与π键①依据强度判断:σ键的强度较________,较稳定,π键强度较________,比较容易断裂。
注意N≡N中的π键强度大。
②共价单键是σ键,共价双键中含有____个σ键____个π键;共价三键中含有____个σ键____个π键。
(2)极性键与非极性键看形成共价键的两原子:不同种元素的原子之间形成的是____性共价键;同种元素的原子之间形成的是__________性共价键。
5.键参数(1)键能________________原子形成__________化学键释放的最低能量。
键能越____________,化学键越稳定。
(2)键长形成共价键的两个原子之间的____________。
键长越__________,共价键越稳定。
(3)键角在原子数超过2的分子中,两个共价键之间的夹角。
如O===C===O键角为________,H—O—H键角为__________。
6.等电子原理______________相同、______________相同的分子(即等电子体)具有相似的化学键特征,它们的许多性质____________,如CO和________。

高中化学人教版选修三第2章分子结构与性质杂化轨道理论选择题下列关于杂化轨道的叙述正确的是(? )A.杂化轨道可用于形成σ键,也可用于形成π键B.杂化轨道可用来容纳未参与成键的孤电子对C.NH3中N原子的sp3杂化轨道是由N原子的3个p轨道与H 原子的s轨道杂化而成的D.在乙烯分子中,1个碳原子的3个sp2杂化轨道与3个氢原子的s轨道重叠形成3个C?H σ键【答案】B【解析】杂化轨道只用于形成σ键,或用来容纳未参与成键的孤电子对,不能用来形成π键,故B项正确,A项不正确;NH3中N原子的sp3杂化轨道是由N原子的1个s轨道和3个p轨道杂化而成的,C项不正确;乙烯分子中的C原子采用sp2杂化,1个碳原子中的2个sp2杂化轨道与2个氢原子的s轨道重叠形成2个C?H σ键,剩下的1个sp2杂化轨道与另一个碳原子的sp2杂化轨道重叠形成1个C?C σ键,D项不正确。
选择题对H3O+的说法正确的是(? )A.O原子采取sp2杂化B.O原子采取sp3杂化C.离子中无配位键D.离子中配体为O原子【答案】B【解析】H3O+的中心原子的价层电子对数是4,采取的是sp3杂化,H2O和H+之间形成配位键。
选择题下列烃分子中,每个碳原子的杂化轨道数最多的是(? )A.C6H6B.C2H6C.C2H4D.C2H2【答案】B【解析】苯分子和乙烯分子中的C原子都是采取sp2杂化,生成3个杂化轨道;乙烷分子中的C原子采取sp3杂化,生成4个杂化轨道;乙炔分子的C原子采取sp杂化,生成2个杂化轨道。
选择题鲍林被认为是20世纪对化学科学影响最大的人之一,他也是两位获得诺贝尔奖不同奖项的人之一。
杂化轨道是鲍林为了解释分子的立体构型提出的,下列对sp3、sp2、sp杂化轨道的夹角的比较,得出结论正确的是(? )A.sp杂化轨道的夹角最大B.sp2杂化轨道的夹角最大C.sp3杂化轨道的夹角最大D.sp3、sp2、sp杂化轨道的夹角相等【答案】A【解析】sp3、sp2、sp杂化轨道的夹角分别为109°28’、120°、180°。


(人教版选修3)第二章《分子结构与性质》教学设计第三节分子的性质(第二课时范德华力和氢键)影响物质的化学性质。
那么,物质的溶沸点、溶解性等物理性质又受什么影响呢?这节课我们就来研究解决这一问题。
【板书】活动一、范德华力及其对物质性质的影响【思考】阅读教材P47页内容,思考范德华力含义、特征分别是什么?【交流1】(1)定义:范德华力是分子之间普遍存在的相互作用力,它使得许多物质能以一定的凝聚态(固态液态)存在。
【交流2】(2)特征:①范德华力约比化学键能小1~2个数量级;②无方向性和饱和性,只要分子周围空间允许,分子总是尽可能多地吸引其他分子。
【讨论1】(1)仔细观察分析教材P47页表2-7,结合分子结构的特点和数据,能得出什么结论?【交流1】①分子的极性越大,范德华力越大。
【交流2】②结构和组成相似的物质,相对分子质量越大,范德华力越大。
【讨论2】(2)根据教材P47页“学与问”,能得出什么结论?【交流1】范德华力主要影响物质的物理性质,如熔点、沸点;化学键主要影响物质的化学性质。
范德华力越大,物质熔沸点越高。
【交流2】当分子结构相似时,相对分子质量越大,范德华力越大。
因此,由于F2~I2的相对分子质量逐渐增大,范德华力也逐渐增大,使F2~I2的熔、沸点越来越高。
【问题探究1】(1)Cl2、Br2、I2三者的组成和化学性质均相似,但状态却为气、液、固的原因是什么?【交流】Cl2、Br2、I2的组成和结构相似,由于相对分子质量逐渐增大,所以范德华力逐渐增大,故熔、沸点升高,状态由气体变为液体、固体。
如下图:【投影】【问题探究2】(2)CCl4、SiCl4、SnCl4的稳定性为什么逐渐减弱?而它们的沸点逐渐升高?【交流1】分子稳定性取决于键长和键能,CCl4、SiCl4、SnCl4中的键长逐渐变长,键能逐渐减小,分子稳定性减弱;【交流2】由分子构成的物质的沸点取决于分子间作用力的大小,CCl4、SiCl4、SnCl4的组成和结构相似,随相对分子质量的增大,它们分子间的作用力逐渐增大,沸点逐渐升高。
一、原子结构和元素性质方面1. 原子一般由质子、中子和核外电子构成。
但却只由质子和电子构成。
2. 金属元素原子的最外层电子数一般小于4,而非金属元素原子的最外层电子数一般大于或等于4。
但H、He、B的最外层电子数均小于4,其中H、B为非金属元素,而He为稀有气体元素;虽然Ge、Sn、Pb、Bi的最外层电子数均大于或等于4,但它们却为金属元素。
3. 稀有气体元素原子的最外层一般为8个电子的稳定结构。
但He的最外层为2个电子的稳定结构。
4. 主族元素的原子得失电子所形成的阴阳离子最外层一般具有8个电子的稳定结构。
但对核外只有一个电子层的离子来说,最外层却只有2个电子,如;而则是一个氢原子核。
5. 含金属元素的离子一般为阳离子。
但也存在某些阴离子,如等。
6. 只含非金属元素的离子一般为阴离子。
但也存在某些阳离子,如等。
7. 一种非金属元素一般形成一种阴离子。
但氧元素形成的离子除,还有。
8. 主族元素的最高化合价一般等于原子的最外层电子数。
但氟元素和氧元素的最高化合价却都不等于原子的最外层电子数,其中氟元素的最高化合价为0价(氟无正价),而氧的最高价为+2价(在OF2中)。
9. 氢元素在化合物中一般为+1价。
但在金属氢化物中却为-1价。
10. 氧元素在化合物中一般为-2价。
但在过氧化物(如等)中为-1价;在OF2中为+2价。
11. 对于对应阴阳离子具有相同的电子层结构的金属元素和非金属元素而言,金属元素的最高化合价一般低于非金属元素的最高化合价。
而和虽然电子层结构相同。
但钠、镁、铝的最高价(分别为+1、+2、+3价)却高于氟的最高价(0价)。
12. 原子的相对原子质量一般为保留一定位数的小数有效数字。
但12C的相对原子质量却为整数,并且是精确值。
13. 某原子的相对原子质量一般并不等同于对应元素的相对原子质量。
但对于某些只有一种核素的元素而言,原子的相对原子质量就是元素的相对原子质量,如:钠元素就只有一种核素,因此,Na原子的相对原子质量就是钠元素的相对原子质量。
人教版选修三物质结构与性质——分子结构与性质之判断键角1、为什么NH3的键角是107°, NF3的键角是102.5°?答题思考方向——配原子电负性对键角的影响,相邻的两个成键电子对远离中心原子时、相互间的斥力会变小。
2、为什么NH3的键角是107°,PH3的键角是93.6°?答题思考方向——中心原子电负性对键角的影响,成键电子对更靠近中心原子,成键电子对间的斥力要变大。
老师归纳:影响分子中键角大小的因素键角为某原子与另两个原子所成共价键间的夹角。
一、中心原子杂化类型对键角大小有决定性的影响上表由前(左)到后(右)的顺序就基本是一个键角逐渐减小的顺序。
例1,对CH4、BF3、CO2这一分子序列,中心原子分别为sp3、sp2和sp杂化,它们对应的键角为109°28’、120°、180°键角会依次增大。
二、中心原子孤电子对数目对键角的影响由于中心原子的孤对电子的电子云肥大,对成键电子对有较大的排斥力,所以孤对电子能使成键电子对彼此离得更近,键角被压缩而变小。
且中心原子的孤电子对数越多,键角会变得越小[2]。
例2,对H2O、NH3、CH4分子系列。
这3个分子的中心原子采取的都是sp3杂化,但孤电子对数不同。
其孤电子对数分别为2、1、0。
在H20分子中,键角要受2个孤电子对的压缩,键角应该会最小。
这就导致出推断:该序列是一个键角逐渐增大的序列。
可查得它们的键角分别是104.5、107.1°、109.5°。
三、配原子电负性对键角的影响当同一种原子中心原子种类相同、杂化类型也相同,而配原子种类不同时,由于配原子的电负性不同,会使键角有区别。
因为当相邻的两个成键电子对更靠近中心原子时、相互间的斥力会增大。
反之,当相邻的两个成键电子对远离近中心原子时、相互间的斥力会变小。
例3,将NF3与NH3比较,中心原子都是N原子、且都为sp 杂化,但因为F原子的电负性大于H原子,使成键电子离N原子更:远,两个N-F键间的斥力减小、可以靠的更近,所以其键角更小。
第二章分子结构与性质第一节共价键【教学目标】1、复习化学键的概念,能用电子式表示常见物质的离子键或共价键的形成过程。
2、知道共价键的主要类型δ键和π键。
3、说出δ键和π键的明显差别和一般规律。
4、认识键能、键长、键角等键参数的概念5、能用键参数――键能、键长、键角说明简单分子的某些性质6、知道等电子原理,结合实例说明“等电子原理的应用”【教学重点、难点】1、价层电子对互斥模型2、键参数的概念,等电子原理【教学过程】复习引入:NaCl、HCl的形成过程离子键:阴阳离子间的相互作用。
共价键:原子间通过共用电子对形成的相互作用。
使离子相结合或原子相结合的作用力通称为化学键。
共价键是现代化学键理论的核心。
第一节共价键一、共价键1、定义:原子间通过共用电子对形成的相互作用。
练习:用电子式表示H2、HCl、Cl2的形成过程H2HClCl2思:为什么H2、Cl2 是双原子分子,而稀有气体是单原子分子?2、形成共价键的条件:两原子都有单电子讨论:按共价键的共用电子对理论,是否有H3、H2Cl、Cl3的分子存在?3、共价键的特性一:饱和性讲:对于主族元素而言,内层电子一般都成对,单电子在最外层。
如:H 1s1 、Cl 1s22s22p63s23p5H、Cl最外层各缺一个电子,于是两原子各拿一电子形成一对共用电子对共用,由于Cl吸引电子对能力稍强,电子对偏向Cl(并非完全占有),Cl略带部分负电荷,H略带部分正电荷。
讨论:共用电子对中H、Cl的两单电子自旋方向是相同还是相反?设问:前面学习了电子云和轨道理论,对于HCl中H、Cl原子形成共价键时,电子云如何重叠?例:H 2的形成1s1 相互靠拢1s1 电子云相互重叠形成H2分子的共价键(H-H)由此可见,共价键可看成是电子云重叠的结果。
电子云重叠程度越大,则形成的共价键越牢固。
H2里的共价键称为δ键。
形成δ键的电子称为δ电子。
4、共价键的种类(1)δ键:(以“头碰头”重叠形式)a、特征:以形成化学键的两原子核的连线为轴作旋转操作,共价键电子云的图形不变,这种特征称为轴对称。
选修三——分子的结构与性质 考点1:共价键 一、概念:原子间形成共用电子对,具有方向性和饱和性。 类型:单键、双键、三键(按共用电子对数目); 极性和非极性(按共用电子对是否偏移) σ键(轴对称),π键(镜像对称) 二、键参数 键能:气态基态原子形成1mol化学键释放的最低能量,键能越大,化学键越稳定。 键长:形成共价键的两个原子的核间距,键长越短,共价键越稳定。 键角:在两个以上原子的分子中,两个共价键的夹角。
三、σ键和π键的对比
四、等电子原理:原子总数相同、价电子总数相同的分子,物理性质相似(N2和CO),化学性质不同。 常见等电子体汇总 练习 1.判断题 (1)分子中一定有化学键。( ) (2)乙炔分子中既有极性键又有非极性键,既有σ键又有π键。( ) (3)正四面体结构的分子键角一定是109°28′。( ) 2.下列对HCl、Cl2、H2O、NH3、CH4一组分子中共价键形成方式正确的是( ) A.都是σ键,没有π键 B.都是π键,没有σ键 C.既有σ键,又有π键 D.除了CH4,都是σ键 3.下列分子中存在π键的( ) A.H2 B.Cl2 C.N2 D.HCl 4.有以下物质:①HF ②Cl2 ③H2O ④N2 ⑤C2H4
(1)只含有极性键的 。
(2)只含有非极性键的 。 (3)既有极性键又有非极性键的 。 (4)只含有σ键的 。 (5)既有σ键又有π键的 。
5.COCl2分子结构为,COCl2分子内含有( ) A.4个σ键 B.2个σ键,2个π键 C.2个σ键,1个π键 D.3个σ键,1个π键 6.下列粒子不能互为等电子体的是( ) A.CO32-和NO32- B.O3和SO2 C.CO2和NO22- D.SCN-和N3-
微粒 通式 价电子总数 立体构型 CO2、CNS-、NO+2、N-3 AX2 16e- 直线形 CO2-3、NO-3、SO3 AX3 24e- 平面三角形 SO2、O3、NO-2 AX2 18e- V形 SO2-4、PO3-4 AX4 32e- 正四面体形 PO3-3、SO2-3、ClO-3 AX3 26e- 三角锥形 CO、NO2 AX 10e- 直线形 CH4、NH+4 AX4 8e- 正四面体形 考点2:价层电子互斥模型(VSEPR模型)、杂化轨道和分子空间构型的关系 一、价层电子互斥模型(VSEPR模型) 如何计算ABm型分子(或离子)价层电子对数: (1)先算中心原子成σ键电子数,即m值。 (2)再算中心原子孤电子对数=1/2(a-xb), a为中心原子A的最外层电子数,若为阳离子,要减去电荷数;若为阳离子,要加上电荷数 x为m,b为成键原子B达到稳定结构所需要的电子数。 (3)价层电子对数=成σ键电子数+孤电子对数。 如何根据价层电子对数和孤电子数来判断分子空间结构
二、杂化轨道理论 如何计算分子(或离子)的杂化轨道: 先算:杂化轨道数=中心原子成σ键电子数+中心原子孤电子对数。 结果=2,为sp杂化;结果=3,为sp2杂化;结果=4,为sp3杂化。 如何根据杂化轨道类型来判断分子空间结构 杂化类型 孤电子对数 空间结构 实例 sp 0 直线型 CO2
sp2 0 平面三角形 SO3 1 V型 SO2
sp3 0 四面体 CH4 1 三角锥型 NH3 2 V型 H2O 常见有机物中的C原子杂化轨道类型 杂化类型 共价键类型 空间结构 实例 sp 1个σ键,2个π键 直线型 HC≡CH
sp2 2个σ键,1个π键 平面三角形 H2C=CH2 苯环 H2C=O
sp3 4个σ键 四面体 CH4
练习 1. 判断题: (1)氯化亚砜(SOCl2)分子空间构型为三角锥形,中心原子S采用sp2杂化。( ) (2)CS2为V型极性分子。( ) (3)SiF4和SO32-的中心原子均为sp3杂化。( ) (4)BF3是三角锥形分子。( ) 2.在乙烯分子中有5个σ键、一个π键,它们分别是( ) A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键 B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键 C.C-H之间是sp2形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键 D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键 3.用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是( ) A.SO2、CS2、HI都是直线形的分子 B.BF3键角为120°,SnBr2键角大于120° C.COCl2、BF3、SO3都是平面三角形的分子 D.PCl3、NH3、PCl5都是三角锥形的分子 4.X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为 ,中心原子的杂化类型为 。 5.经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。 ①从结构角度分析,R中两种阳离子的相同之处为 ,不同之处为 。 A. 中心原子的杂化轨道类型 B.中心原子的价层电子对数 B. C.立体结构 D.共价键类型 ②R中阴离子N5-中的σ键总数为________个。分子中的大π键可用符号IInm表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为II66),则N5-中的大π键应表示为____________。 ③图(b)中虚线代表氢键,其表示式为(NH4+)N-H┄Cl、____________、____________。 6. (1)CS2分子中,C原子的杂化轨道类型为 。 (2)F2通入稀NaOH溶液中可生成OF2,OF2的分子空间构型为 ,其中O原子的杂化轨道类型为 。 (3)乙酸分子中C原子的杂化轨道类型为 。 (4)醛基中C原子的杂化轨道类型为 。 (5)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键.从原子结构角度分析,原因是 。Ge单晶体具有金刚石型结构,其中Ge的原子杂化方式为 ,微粒之间存在的作用力为 。
考点3:配位键 定义:成键的两个原子一方提供孤电子对,一方提供空轨道而形成的共价键,是一种特殊的共价键,可以用A→B表示,A为提供孤电子对的原子,B为接受电子对的原子。 配合物组成:由中心原子(提供空轨道)和配体(提供孤电子对)组成,分为内界和外界,以[Cu(NH3)4]SO4为例: 练习 1. 铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。 (1)Cu位于元素周期表第IB族。Cu2+的核外电子排布式为______________________ (2)胆矾CuSO4·5H2O可写成[Cu(H2O)]SO4·H2O,其结构示意图如下
(3)下列说法正确的是______________(填字母)。 A. 在上述结构示意图中,所有氧原子都采用sp3杂化 B. 在上述结构示意图中,存在配位键、共价键和离子键 C. 胆矾是分子晶体,分子间存在氢键 D. 胆矾中的水在不同温度下会分步失去 (4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 。 2. 经研究表明,Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3 的个数比配合,还可以其他个数比配合.请按要求填空: (1)若所得Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子显血红色.该离子的离子符号是 。 (2)若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为 。 3. 硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液
①[Ni(NH3)6]SO4中阴离子的立体构型是 。 ②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为 ,提供孤电子对的成键原子是 。 ③氨的沸点 (“高于”或“低于”)膦(PH3),原因是 ;氨是 分子(填“极性”或“非极性”),中心原子的轨道杂化类型为 。 考点4:分子的性质 一、如何判断分子的极性 1.化合价法:分子的中心原子化合价的绝对值等于其原子的价层电子,该分子为非极性分子;不等则为极性分子。 2.空间构型法:直线型、平面三角形、平面正四边形、正四面体型分子均为非极性分子;其他构型均为极性分子。 二、相似相溶原理 极性相似的分子之间溶解性更好;分子结构相似的分子间溶解性更好;两种分子之间能形成氢键,则溶解性更好。 三、手性分子:具有完全相同的组成和原子排列的一对分子,互为镜像但在三维空间里不能重叠(左手与右手)。手性分子结构不同,性质也不同。 判断手性C原子的方法:同一个C原子上连有四个不同的官能团。 四、无机含氧酸分子的酸性 无机含氧酸可写成(HO)mROn,如果成酸元素R相同,则n越大,R的正电性越高,使R-O-H中O的电子向R偏移,在水中越易电离出H+,酸性越强。 n=0为弱酸,n=1为中强酸,n=2为强酸,n=3为最强酸。 五、氢键、范德华力、共价键之间的关系 范德华力 氢键 共价键
概念 物质分子之间普遍存在的一种相互作用力,又称分子间作用力 由已经与电负性很强(N、O、F)的原子形成共价键的氢原子与另一个分子中电负性很强的原子之间形成的作用力 原子间通过共用电子对所形成的相互作用 分类 —— 分子内氢键、分子间氢键 极性共价键、非极性共价键 作用微粒 分子或原子(稀有气体) 氢原子、其他原子 原子 特征 无方向性、无饱和性 有方向性、有饱和性 有方向性、有饱和性 强度比较 共价键>氢键>范德华力
影响强度因素 ①随着分子极性和相对分子质量的增大而增大 ②组成和结构相似的物质,相对分子质量越大,分子间作用力越大
对于A—H…B—,A、B的电负性越大,B原子的半径越小,键能越大 成键原子半径越小,键长越短,键能越大,共价键越稳定