备战高考化学复习《硅及其化合物推断题》专项综合练习含答案解析
- 格式:doc
- 大小:309.00 KB
- 文档页数:9

高考化学复习硅及其化合物推断题专项综合练附答案一、硅及其化合物1.现有如图所示的转化关系,水和部分产物已略去。
已知:①X和Z是两种透明、不溶于水的坚硬固体,其中Z无固定熔点,是现代建筑不可缺少的装饰和采光材料;②无色气体A是引起温室效应的主要气体;③B、D均为难溶于水的白色固体;④高纯度的F是使用最广泛的半导体材料。
据此回答下列问题:(1)Z的名称是________,工艺师在Z表面刻蚀花纹图案需用的试剂为________(填名称)。
(2)由X、Y制F的化学方程式为________________________,此反应中Y作________剂(填“氧化”或“还原”)。
(3)转化①的化学方程式为________________________;转化②(A少量)的离子方程式为______________________。
【答案】玻璃氢氟酸SiO2+2CO2CO2+Si还原SiO2+2NaOH===Na2SiO3+H2OSiO+CO 2+H2O===H2SiO3↓+CO【解析】【分析】①X为不溶于水的坚硬固体,Z无固定熔点,是现代建筑中不可缺少的装饰材料,判断为玻璃,说明X为SiO2;②无色气体A是引起温室效应的主要气体为CO2;③B、D均为难溶于水的白色固体,流程分析可知B为CaCO3,;④高纯度的F是制造电脑芯片的一种非金属单质为Si;结合流程分析判断可知X为SiO2,B为CaCO3,C为Na2SiO3,D为H2SiO3,E为Na2CO3,Z 为玻璃,Y为CO,F为Si.【详解】由以上分析:(1)Z无固定熔点,是现代建筑中不可缺少的装饰材料,判断为玻璃;工艺师在Z表面刻蚀花纹图案需用的试剂为氢氟酸。
(2)由X、Y制F的过程为SiO2+2CO2CO2+Si,CO做还原剂。
(3)转化①的化学方程式为SiO2+2NaOH===Na2SiO3+H2O;无色气体A是引起温室效应的主要气体,则A为CO 2,转化②(A少量)的离子方程式为SiO+CO2+H2O===H2SiO3↓+CO。
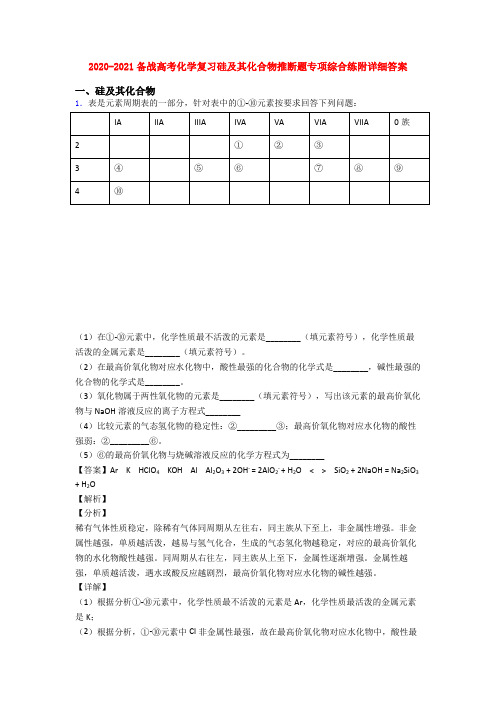
2020-2021备战高考化学复习硅及其化合物推断题专项综合练附详细答案一、硅及其化合物1.表是元素周期表的一部分,针对表中的①-⑩元素按要求回答下列问题:(1)在①-⑩元素中,化学性质最不活泼的元素是________(填元素符号),化学性质最活泼的金属元素是________(填元素符号)。
(2)在最高价氧化物对应水化物中,酸性最强的化合物的化学式是________,碱性最强的化合物的化学式是________。
(3)氧化物属于两性氧化物的元素是________(填元素符号),写出该元素的最高价氧化物与NaOH溶液反应的离子方程式________(4)比较元素的气态氢化物的稳定性:②_________③;最高价氧化物对应水化物的酸性强弱:②_________⑥。
(5)⑥的最高价氧化物与烧碱溶液反应的化学方程式为________【答案】Ar K HClO4 KOH Al Al2O3 + 2OH- = 2AlO2- + H2O < > SiO2 + 2NaOH = Na2SiO3 + H2O【解析】【分析】稀有气体性质稳定,除稀有气体同周期从左往右,同主族从下至上,非金属性增强。
非金属性越强,单质越活泼,越易与氢气化合,生成的气态氢化物越稳定,对应的最高价氧化物的水化物酸性越强。
同周期从右往左,同主族从上至下,金属性逐渐增强。
金属性越强,单质越活泼,遇水或酸反应越剧烈,最高价氧化物对应水化物的碱性越强。
【详解】(1)根据分析①-⑩元素中,化学性质最不活泼的元素是Ar,化学性质最活泼的金属元素是K;(2)根据分析,①-⑩元素中Cl非金属性最强,故在最高价氧化物对应水化物中,酸性最强的化合物的化学式是HClO4,K金属性最强,碱性最强的化合物的化学式是KOH;(3)铝、氧化铝、氢氧化率均属于两性物质,则氧化物属于两性氧化物的元素是Al,该元素的氧化物与NaOH溶液反应的离子方程式Al2O3 + 2OH- = 2AlO2- + H2O;(4)非金属性越强,气态氢化物的稳定性越强,氧的非金属较强,故水比氨气稳定,②<③;非金属性越强,最高价氧化物对应的水化物的酸性越强,N非金属性强于Si,则HNO3酸性强于H2SiO3,故最高价氧化物对应水化物的酸性强弱:②>⑥;(5)硅的最高价氧化物SiO2与烧碱溶液反应的化学方程式为:SiO2 + 2NaOH = Na2SiO3 +H2O。

高考化学复习硅及其化合物推断题专项综合练附答案解析一、硅及其化合物1.A 、B 、C 、D 、E 五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R 表示)的单质能与NaOH 溶液反应生成盐(Na 2RO 3)和氢气。
请回答下列问题:(1)写出各物质的化学式:A ________;B ________;C ________;D ________;E ________。
(2)写出反应①的化学方程式:______________________________________,该反应中氧化剂与还原剂的物质的量之比为________。
(3)写出反应④的离子方程式:______________________________________。
(4)写出反应⑤的离子方程式:______________________________________。
(5)H 2CO 3的酸性强于E 的,请用离子方程式予以证明:________________________________。
【答案】SiO 2 CaSiO 3 Na 2SiO 3 Si H 2SiO 3 SiO 2+2CSi +2CO ↑ 1∶2 Si +2OH -+H 2O =SiO 32-+2H 2↑ SiO 32-+Ca 2+=CaSiO 3↓ SiO 32-+CO 2+H 2O =H 2SiO 3↓+CO 32- 【解析】【分析】A 、B 、C 、D 、E 五种物质中均含有同一种非金属元素,该元素(用R 表示)的单质能与NaOH 溶液反应生成盐(Na 2RO 3)和氢气,则可推知该元素为硅元素,根据题中各物质转化关系,结合硅及其化合物相关知识可知,A 与焦碳高温下生成D ,则A 为SiO 2,D 为Si ,C 为Na 2SiO 3,根据反应②或反应⑤都可推得B 为CaSiO 3,根据反应⑥推知E 为H 2SiO 3。
【详解】(1)根据上面的分析可知,A 为SiO 2,B 为CaSiO 3,C 为Na 2SiO 3,D 为Si ,E 为H 2SiO 3; (2)反应①的化学方程式为SiO 2+2C Si +2CO ↑,根据方程式可知,该反应中氧化剂是个与还原剂碳的物质的量之比为1:2;(3)反应④的离子方程式为Si +2OH -+H 2O =SiO 32-+2H 2↑;(4)反应⑤的离子方程式为SiO 32-+Ca 2+=CaSiO 3↓;(5)H 2CO 3的酸性强于H 2SiO 3,根据复分解反应的规律:强酸制取弱酸,则可以向Na 2SiO 3的水溶液中通入CO 2气体,发生反应产生硅酸和碳酸钠,反应的离子方程式是:SiO 32-+CO 2+H 2O =H 2SiO 3↓+CO 32-。
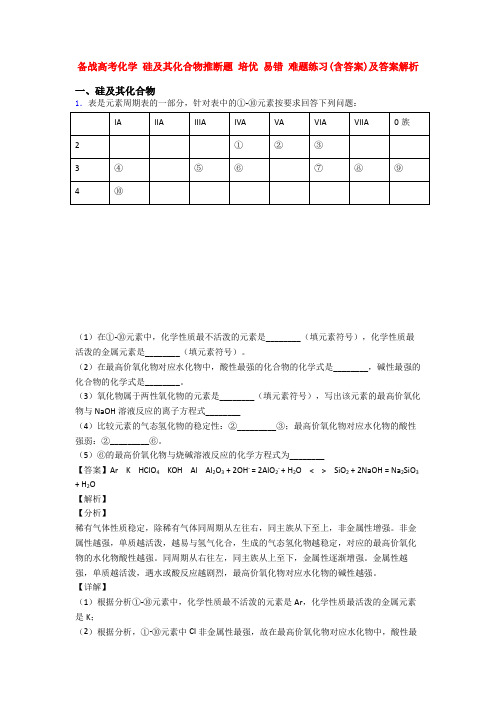
备战高考化学硅及其化合物推断题培优易错难题练习(含答案)及答案解析一、硅及其化合物1.表是元素周期表的一部分,针对表中的①-⑩元素按要求回答下列问题:(1)在①-⑩元素中,化学性质最不活泼的元素是________(填元素符号),化学性质最活泼的金属元素是________(填元素符号)。
(2)在最高价氧化物对应水化物中,酸性最强的化合物的化学式是________,碱性最强的化合物的化学式是________。
(3)氧化物属于两性氧化物的元素是________(填元素符号),写出该元素的最高价氧化物与NaOH溶液反应的离子方程式________(4)比较元素的气态氢化物的稳定性:②_________③;最高价氧化物对应水化物的酸性强弱:②_________⑥。
(5)⑥的最高价氧化物与烧碱溶液反应的化学方程式为________【答案】Ar K HClO4 KOH Al Al2O3 + 2OH- = 2AlO2- + H2O < > SiO2 + 2NaOH = Na2SiO3 + H2O【解析】【分析】稀有气体性质稳定,除稀有气体同周期从左往右,同主族从下至上,非金属性增强。
非金属性越强,单质越活泼,越易与氢气化合,生成的气态氢化物越稳定,对应的最高价氧化物的水化物酸性越强。
同周期从右往左,同主族从上至下,金属性逐渐增强。
金属性越强,单质越活泼,遇水或酸反应越剧烈,最高价氧化物对应水化物的碱性越强。
【详解】(1)根据分析①-⑩元素中,化学性质最不活泼的元素是Ar,化学性质最活泼的金属元素是K;(2)根据分析,①-⑩元素中Cl非金属性最强,故在最高价氧化物对应水化物中,酸性最强的化合物的化学式是HClO4,K金属性最强,碱性最强的化合物的化学式是KOH;(3)铝、氧化铝、氢氧化率均属于两性物质,则氧化物属于两性氧化物的元素是Al,该元素的氧化物与NaOH溶液反应的离子方程式Al2O3 + 2OH- = 2AlO2- + H2O;(4)非金属性越强,气态氢化物的稳定性越强,氧的非金属较强,故水比氨气稳定,②<③;非金属性越强,最高价氧化物对应的水化物的酸性越强,N非金属性强于Si,则HNO3酸性强于H2SiO3,故最高价氧化物对应水化物的酸性强弱:②>⑥;(5)硅的最高价氧化物SiO2与烧碱溶液反应的化学方程式为:SiO2 + 2NaOH = Na2SiO3 +H2O。
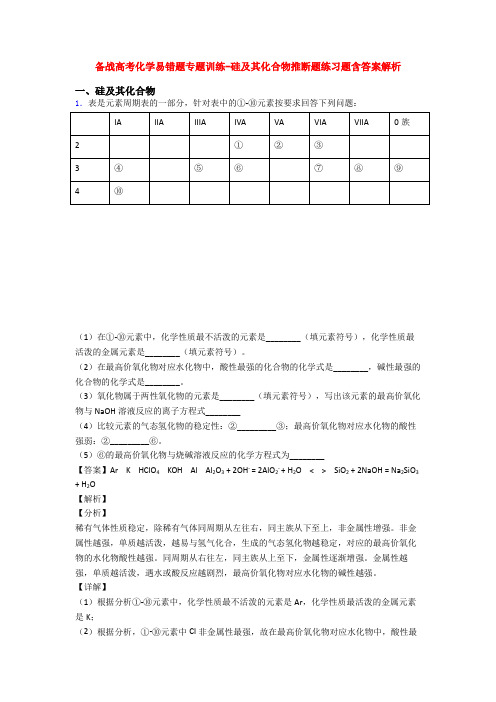
备战高考化学易错题专题训练-硅及其化合物推断题练习题含答案解析一、硅及其化合物1.表是元素周期表的一部分,针对表中的①-⑩元素按要求回答下列问题:(1)在①-⑩元素中,化学性质最不活泼的元素是________(填元素符号),化学性质最活泼的金属元素是________(填元素符号)。
(2)在最高价氧化物对应水化物中,酸性最强的化合物的化学式是________,碱性最强的化合物的化学式是________。
(3)氧化物属于两性氧化物的元素是________(填元素符号),写出该元素的最高价氧化物与NaOH溶液反应的离子方程式________(4)比较元素的气态氢化物的稳定性:②_________③;最高价氧化物对应水化物的酸性强弱:②_________⑥。
(5)⑥的最高价氧化物与烧碱溶液反应的化学方程式为________【答案】Ar K HClO4 KOH Al Al2O3 + 2OH- = 2AlO2- + H2O < > SiO2 + 2NaOH = Na2SiO3 + H2O【解析】【分析】稀有气体性质稳定,除稀有气体同周期从左往右,同主族从下至上,非金属性增强。
非金属性越强,单质越活泼,越易与氢气化合,生成的气态氢化物越稳定,对应的最高价氧化物的水化物酸性越强。
同周期从右往左,同主族从上至下,金属性逐渐增强。
金属性越强,单质越活泼,遇水或酸反应越剧烈,最高价氧化物对应水化物的碱性越强。
【详解】(1)根据分析①-⑩元素中,化学性质最不活泼的元素是Ar,化学性质最活泼的金属元素是K;(2)根据分析,①-⑩元素中Cl非金属性最强,故在最高价氧化物对应水化物中,酸性最强的化合物的化学式是HClO4,K金属性最强,碱性最强的化合物的化学式是KOH;(3)铝、氧化铝、氢氧化率均属于两性物质,则氧化物属于两性氧化物的元素是Al,该元素的氧化物与NaOH溶液反应的离子方程式Al2O3 + 2OH- = 2AlO2- + H2O;(4)非金属性越强,气态氢化物的稳定性越强,氧的非金属较强,故水比氨气稳定,②<③;非金属性越强,最高价氧化物对应的水化物的酸性越强,N非金属性强于Si,则HNO3酸性强于H2SiO3,故最高价氧化物对应水化物的酸性强弱:②>⑥;(5)硅的最高价氧化物SiO2与烧碱溶液反应的化学方程式为:SiO2 + 2NaOH = Na2SiO3 + H2O。

2020-2021备战高考化学复习硅及其化合物推断题专项综合练含详细答案一、硅及其化合物1.A、B、C均为中学化学常见的纯净物,它们之间存在如下转化关系:其中①②③均为有单质参与的反应。
(1)若A是常见的金属,①③中均有同一种黄绿色气体参与反应,B溶液遇KSCN显血红色,且②为化合反应,写出反应②的离子方程式_________________________。
(2)如何检验上述C溶液中的阳离子?______________________。
(3)若B是太阳能电池用的光伏材料,①②③为工业制备B的反应。
C的化学式是____________,属于置换反应____________,(填序号)写出反应①的化学方程式____________________。
【答案】Fe+2Fe3+=3Fe2+取少量溶液于试管,加KSCN溶液,无明显现象,再加氯水,溶液变成血红色,则证明含Fe2+ SiCl4①③ 2C+SiO2Si+2CO↑【解析】【分析】(1)由转化关系可知A为变价金属,则A应为Fe,B为氯化铁,C为氯化亚铁,②为Fe与氯化铁的反应;(3)B是太阳能电池用的光伏材料,可知B为Si,①为C与二氧化硅的反应,①②③为工业制备B的反应,则C为SiCl4,③中SiCl4与氢气反应,提纯Si,以此解答该题。
【详解】(1)A是常见的金属,①③中均有同一种气态非金属单质参与反应,且②为化合反应,则该非金属气体为Cl2,B为氯化铁,则反应②的离子方程式为2Fe3++Fe=3Fe2+;(2)由分析知C为氯化亚铁,检验Fe2+的操作方法是取少量溶液于试管,加KSCN溶液,无明显现象,再加氯水,溶液变成血红色,则证明含Fe2+;(3)B是太阳能电池用的光伏材料,可知B为Si,①为C与二氧化硅的反应,①②③为工业制备B的反应,则C为SiCl4,其中②为Si和Cl2化合生成SiCl4,③中SiCl4与氢气反应,提纯Si,则反应①的化学方程式为SiO2+2C Si+2CO↑,其中属于置换反应的有①③。
备战高考化学二模试题分类汇编——硅及其化合物推断题综合含答案解析一、硅及其化合物1.在下列物质的转化关系中,A是一种固体物质,E是一种白色沉淀,据此填写下列空白:(1)B的化学式是________,B在固态时属于________晶体,1mol 含有的共价键数目是______N A。
(2)E的化学式是_________。
(3)B和a溶液反应的离子方程式是_______________________________(4)A和a溶液反应的化学方程式是___________________________________【答案】SiO2原子4H2SiO3SiO2+2OH-=SiO32-+H2O Si+2NaOH+H2O=Na2SiO3+2H2↑【解析】【分析】A是一种固体单质,与氧气反应得到B为氧化物,E是一种白色沉淀且不溶于盐酸,E加热分解得到B,所以E为H2SiO3,结合转化关系,可知A为Si,B为SiO2,a为强碱溶液,如NaOH溶液,G为Na2SiO3,D为H2O,F为H2。
【详解】(1)由上述分析可知,B是SiO2,SiO2由硅原子和氧原子通过共用电子对形成空间网状结构,在固态时属于原子晶体,每个硅原子和四个氧原子形成四个共价键,1mol 含有的共价键数目是4N A。
故答案为:SiO2;原子;4;(2)由上述分析可知,E为H2SiO3,故答案为:H2SiO3;(3)二氧化硅与强碱溶液反应生成硅酸盐与水,反应的离子方程式为:SiO2+2OH-=SiO32-+H2O;故答案为:SiO2+2OH-=SiO32-+H2O;(4)Si与氢氧化钠反应生成硅酸钠与氢气,反应方程式为:Si+2NaOH+H2O=Na2SiO3+2H2↑,故答案为:Si+2NaOH+H2O=Na2SiO3+2H2↑。
【点睛】本题考查无机物推断,B为氧化物、E为不溶于盐酸的白色沉淀为推断突破口,需要学生熟练掌握元素化合物性质。
2.A、B、C、D、E五种物质中均含有同一种非金属元素,他们能发生如图所示的转化关系。
备战高考化学硅及其化合物推断题综合题及答案解析一、硅及其化合物1.有A、B、C三种不溶于水的固体。
A是某元素的一种单质,它在氧气中完全燃烧得到一种无色气体,此气体能使澄清石灰水变浑浊,另外测得这种气体密度为同温、同压下氧气密度的1.375倍。
B固体能溶于热氢氧化钠溶液,再往所得溶液中加入过量盐酸时,析出白色胶状沉淀D。
此沉淀干燥后,成为不溶于水的白色粉末,这是一种比碳酸酸性还弱的酸。
将B与石灰石、纯碱按比例混合加热得到C,C在高温时软化,无固定熔点。
(1)根据以上事实,形成单质A的元素名称为__, C的名称为__。
(2)B固体溶于热氢氧化钠溶液的化学方程式是__。
(3)生成白色胶状沉淀D的化学方程式是__。
(4)由B制取C的化学方程式是__。
【答案】碳普通玻璃 SiO2+2NaOH=Na2SiO3+H2O Na2SiO3+2HCl=2NaCl+H2SiO3↓Na2CO3+SiO2Na2SiO3+CO2↑、CaCO3+SiO2CaSiO3+CO2↑【解析】【分析】A是某元素的一种单质,它在氧气中完全燃烧得到一种无色气体,此气体能使澄清石灰水变浑浊,这种气体为氧气密度的1.375倍(标准状况)的气体,则该气体的相对分子质量=32×1.375=44,应是CO2,所以A为碳,B固体能溶于热氢氧化钠溶液,再往所得溶液中加入过量盐酸时,析出白色胶状沉淀,此沉淀干燥后,成为不溶于水的白色粉末,这是一种比碳酸酸性还弱的酸,则该酸应为硅酸,将B与石灰石、纯碱按比例混合加热得到C,C 在高温时软化,无固定熔点,该反应为工业制普通玻璃的反应,所以B为SiO2,C为普通玻璃,据此答题。
【详解】A燃烧后生成的气体的相对分子质量为32×1.375=44,且能使澄清石灰水变浑浊,该气体是二氧化碳,则A为碳元素的一种单质。
B物质能与氢氧化钠反应,且能继续与过量的盐酸反应生成一种比碳酸还弱的酸,则B为二氧化硅。
备战高考化学硅及其化合物推断题综合试题及答案解析一、硅及其化合物1.如图为一定量饱和Ca(OH)2溶液中通入CO2气体后,产生CaCO3白色沉淀的质量与通入的CO2体积之间的关系曲线。
请回答:①OA段曲线所表示的化学反应方程式:_________,A点处已参加反应的CO2与Ca(OH)2的物质的量之比为________。
②B处溶液中存在的浓度较大的两种离子是________和________(填离子符号),将B处生成的溶液煮沸,可见到的现象是_____________。
【答案】Ca(OH)2+CO2=CaCO3↓+H2O 1∶1 Ca2+ HCO3—溶液变浑浊(或产生白色沉淀) 【解析】【分析】二氧化碳与氢氧化钙饱和溶液的反应与二氧化碳的量有关,少量二氧化碳与氢氧化钙反应生成碳酸钙和水,反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O,过量二氧化碳与氢氧化钙反应生成碳酸氢钙,反应的化学方程式为2CO2+Ca(OH)2=Ca(HCO3)2,由图可知OA段随着CO2通入CaCO3的量逐渐增大,A点达到沉淀最大值,AB段随CO2的通入,生成的CaCO3不断溶解转化为Ca(HCO3)2,B点CaCO3全溶解,溶液又变得澄清。
【详解】①由图可知OA段随着CO2通入CaCO3的量逐渐增大,A点达到沉淀最大值,则OA段发生的反应为二氧化碳与氢氧化钙反应生成碳酸钙和水,反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O,由方程式可知A点处已参加反应的二氧化碳和氢氧化钙的物质的量比为1:1,故答案为:CO2+Ca(OH)2=CaCO3↓+H2O;1:1;②由图可知AB段随CO2的通入,生成的CaCO3不断溶解,发生的反应为二氧化碳与碳酸钙反应生成碳酸氢钙,则溶液中存在的浓度较大的两种离子是钙离子和碳酸氢根离子;将碳酸氢钙溶液煮沸,碳酸氢钙受热分解生成难溶的碳酸钙、二氧化碳和水,则可见到的现象是澄清溶液变浑浊,故答案为:Ca2+;HCO3—;溶液变浑浊(或产生白色沉淀)。
2020-2021备战高考化学压轴题专题复习——硅及其化合物推断题的综合及详细答案一、硅及其化合物1.A、B、C、D、E五种物质之间的相互转换关系如图所示。
已知:A为单质,可用于制造计算机芯片,E为无色有毒气体。
回答下列问题:(1)B在物质分类上属于___(填“酸性氧化物”或“碱性氧化物”)。
(2)反应①的化学方程式为___。
(3)反应②的化学方程式为___。
(4)在D的溶液中通入过量CO2气体的离子方程式为___。
【答案】酸性氧化物 SiO2+2C 高温Si+2CO↑ SiO2+CaO高温CaSiO3 SiO32-+2H2O+2CO2=2HCO3-+H2SiO3↓【解析】【分析】A为单质,可用于制造计算机芯片,则A为Si,E为无色有毒气体,结合转化关系可知,B 为SiO2,SiO2与碳反应生成Si、CO,所以E为CO;SiO2与CaO反应生成C为CaSiO3;SiO2与NaOH反应生成Na2SiO3和水。
据此解答。
【详解】(1)B为SiO2,能与碱反应生成盐和水,属于酸性氧化物,故答案为:酸性氧化物;(2)反应①是SiO2与C反应生成Si、CO,其化学反应方程式为:SiO2+2C 高温Si+2CO↑,故答案为:SiO2+2C 高温Si+2CO↑;(3)反应②是SiO2与CaO反应生成CaSiO3,其化学反应方程式为:SiO2+CaO 高温CaSiO3,故答案为:SiO2+CaO高温CaSiO3;(4)D为Na2SiO3,其溶液中通入过量CO2,其化学反应方程式为:Na2SiO3+2H2O+2CO2=2NaHCO3+H2SiO3↓,其离子方程式为:SiO32-+2H2O+2CO2=2HCO3-+H2SiO3↓,故答案为:SiO32-+2H2O+2CO2=2HCO3-+H2SiO3↓。
2.如图五角星上排列的A、B、C、D、E五种物质均为中学化学中常见的化合物,相互之间的连线表示两种物质能发生化学反应。
备战高考化学复习《硅及其化合物推断题》专项综合练习含答案解析 一、硅及其化合物 1.在下列物质的转化关系中,A是一种固体物质,E是一种白色沉淀,据此填写下列空白:
(1)B的化学式是________,B在固态时属于________晶体,1mol 含有的共价键数目是
______NA。
(2)E的化学式是_________。
(3)B和a溶液反应的离子方程式是_______________________________ (4)A和a溶液反应的化学方程式是___________________________________ 【答案】SiO2 原子 4 H2SiO3 SiO2+2OH-=SiO32-+H2O Si+2NaOH+H2O=Na2SiO3+2H2↑
【解析】 【分析】 A是一种固体单质,与氧气反应得到B为氧化物,E是一种白色沉淀且不溶于盐酸,E加
热分解得到B,所以E为H2SiO3,结合转化关系,可知A为Si,B为SiO2,a为强碱溶液,如NaOH溶液,G为Na2SiO3,D为H2O,F为H2。 【详解】 (1)由上述分析可知,B是SiO2,SiO2由硅原子和氧原子通过共用电子对形成空间网状结构,在固态时属于原子晶体,每个硅原子和四个氧原子形成四个共价键,1mol 含有的共价键数目是4NA。故答案为:SiO2;原子;4; (2)由上述分析可知,E为H2SiO3,故答案为:H2SiO3; (3)二氧化硅与强碱溶液反应生成硅酸盐与水,反应的离子方程式为:SiO2+2OH-=SiO32
-+H2O;
故答案为:SiO2+2OH-=SiO32-+H2O; (4)Si与氢氧化钠反应生成硅酸钠与氢气,反应方程式为:Si+2NaOH+H2O=Na2SiO3+2H2↑,
故答案为:Si+2NaOH+H2O=Na2SiO3+2H2↑。 【点睛】 本题考查无机物推断,B为氧化物、E为不溶于盐酸的白色沉淀为推断突破口,需要学生熟练掌握元素化合物性质。
2.在下列物质的转化关系中,A是一种固体单质,且常作半导体材料,E是一种白色沉淀,F是最轻的气体单质。 据此填写: (1)B的化学式是____________,目前在现代通迅方面B已被用作_____________主要原料。 (2)B和a溶液反应的离子方程式是_____________________。 (3)A和a溶液反应的离子方程式是_____________________。 (4)C和过量盐酸反应的离子方程式是____________________。 【答案】SiO2 制光导纤维 SiO2+2OH-=SiO32-+H2O Si+2OH-+H2O=SiO32-+2H2↑ SiO32-+2H+=H2SiO3↓ 【解析】 【分析】 A是一种固体单质,且常作半导体材料,则A是Si,所以B为SiO2,由图中转化关系可知
E为H2SiO3,a为NaOH,C为Na2SiO3,D为H2O,由于 F是最轻的气体单质,则F为H2。
【详解】 A是一种固体单质,且常作半导体材料,则A是Si,所以B为SiO2,由图中转化关系可知
E为H2SiO3,a为NaOH,C为Na2SiO3,D为H2O,由于 F是最轻的气体单质,则F为H2,
(1)B的化学式是SiO2,目前在现代通迅方面B已被用作光导纤维主要原料; (2)B和a溶液反应的离子方程式是SiO2+2OH-=SiO32-+H2O; (3)A和a溶液反应的离子方程式是Si+2OH-+H2O=SiO32-+2H2↑; (4)C和过量盐酸反应的离子方程式是SiO32-+2H+=H2SiO3↓。
3.已知A是一种不溶于水的固体非金属氧化物,根据图中的转化关系,回答:
(1)A是______,B是_____,D是_____。 (2)写化学方程式: ①_________; ⑤_________。 (3)写离子方程式: ②__________; ③________; ④________。 【答案】SiO2 Na2SiO3 H2SiO3 Na2CO3+SiO2Na2SiO3+CO2↑ H2SiO3H2O+SiO2 CO2+H2O+SiO32-=CO32-+H2SiO3↓ SiO2+2OH-=SiO32-+H2O SiO32-+2H+=H2SiO3↓ 【解析】 【分析】 由“A是一种不溶于水的固体非金属氧化物”可推知A为SiO2,再结合SiO2的相关性质:SiO2跟Na2CO3在高温下反应生成Na2SiO3和CO2,二者在水中会反应生成H2SiO3沉淀,则
D为H2SiO3,H2SiO3受热分解生成SiO2和H2O,说明A为SiO2是正确的,③为SiO2和
NaOH的反应,可知B为Na2SiO3,则C为CO2,Na2SiO3可与酸反应生成硅酸,据此答题。
【详解】 由以上分析可知A为SiO2,B为Na2SiO3,C为CO2,D为H2SiO3。 (1)由以上分析可知A为SiO2,B为Na2SiO3,D为H2SiO3,故答案为:SiO2;Na2SiO3; H2SiO3。
(2)①SiO2和碳酸钠在高温下反应生成硅酸钠和二氧化碳,反应的方程式为SiO2+Na2CO3Na2SiO3+CO2↑,故答案为:SiO2+Na2CO3Na2SiO3+CO2↑。
⑤H2SiO3受热分解生成SiO2和H2O,反应方程式为:H2SiO3H2O+SiO2,故答案为:H2SiO3H2O+SiO2。
(3)②硅酸酸性比碳酸弱,硅酸钠和二氧化碳、水反应可生成硅酸,反应的方程式为Na2SiO3+CO2+H2O═H2SiO3↓+Na2CO3,离子方程式为:CO2+H2O+SiO32-=CO32-+H2SiO3↓,
故答案为:CO2+H2O+SiO32-=CO32-+H2SiO3↓。 ③二氧化硅和氢氧化钠反应生成硅酸钠和水,反应的化学方程式为SiO2+2NaOH═Na2SiO3+H2O,离子方程式为SiO2+2OH-═SiO32-+H2O,故答案为:SiO2+2OH-═SiO32-+H2O。
④Na2SiO3可与盐酸反应生成硅酸,方程式为Na2SiO3+2HCl═2NaCl+H2SiO3↓,离子方程式为:SiO32-+2H+=H2SiO3↓,故答案为:SiO32-+2H+=H2SiO3↓。 【点睛】 解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等,本题的突破口为:“A是一种不溶于水的固体非金属氧化物”。
4.探究无机盐 X(仅含三种短周期元素)的组成和性质,设计并完成如下实验:
请回答: (1)X 的化学式是__________。 (2)白色粉末溶于氢氧化钠溶液的离子方程式是__________。 (3)白色沉淀用途广泛,请列举一例:__________。 【答案】Mg2SiO4 或 2MgO·SiO2 SiO2+2OH-=SiO32-+H2O 优良的阻燃剂等
【解析】 【详解】 无机盐X(仅含三种短周期元素),加入过量盐酸溶解,离心分离得到白色胶状物沉淀和无色溶液,白色胶状沉淀为硅酸,白色沉淀充分灼烧得到白色粉末1.80g为SiO2,物质的量=1.8g÷60g/mol=0.03mol,溶于氢氧化钠溶液得到无色溶液为硅酸钠溶液,说明无机盐中含硅酸根离子或原硅酸根离子,物质的量为0.03mol,若为硅酸根离子其质量=0.03mol×76g/mol=2.28g,金属质量=4.20g-2.28g=1.92g,无色溶液中加入过量氢氧化
钠溶液生成白色沉淀则判断为Mg(OH)2,金属离子物质的量=0.06mol,质量为0.06mol×24g/mol=1.44g,不符合,则为原硅酸根,物质的量为0.03mol,质量=
0.03mol×92g/mol=2.76g,金属质量4.20g-2.76g=1.44g,物质的量=1.44g÷24g/mol=0.06mol,得到X为Mg2SiO4。 (1)X的化学式为,Mg2SiO4; (2)白色粉末溶于氢氧化钠溶液的离子方程式是SiO2+2OH-=SiO32-+H2O; (3)氢氧化镁是优良的阻燃剂。
5.现有如图所示的转化关系,水和部分产物已略去。
已知:①X和Z是两种透明、不溶于水的坚硬固体,其中Z无固定熔点,是现代建筑不可缺少的装饰和采光材料;②无色气体A是引起温室效应的主要气体; ③B、D均为难溶于水的白色固体;④高纯度的F是使用最广泛的半导体材料。 据此回答下列问题: (1)Z的名称是________,工艺师在Z表面刻蚀花纹图案需用的试剂为________(填名称)。 (2)由X、Y制F的化学方程式为________________________,此反应中Y作________剂(填“氧化”或“还原”)。 (3)转化①的化学方程式为________________________;转化②(A少量)的离子方程式为______________________。
【答案】玻璃 氢氟酸 SiO2+2CO2CO2+Si 还原 SiO2+2NaOH===Na2SiO3+H2O
SiO+CO2+H2O===H2SiO3↓+CO
【解析】 【分析】