实验室制备氯化氢气体并做喷泉实验
- 格式:ppt
- 大小:16.96 MB
- 文档页数:17

第1篇一、实验目的1. 理解喷泉实验的原理,即气体溶解或化学反应导致烧瓶内气体压强变化,形成液体喷泉。
2. 掌握喷泉实验的操作步骤,包括装置搭建、气体收集、液体喷泉现象观察等。
3. 通过实验观察不同气体与液体之间的溶解和反应,验证气体溶解度及化学反应对喷泉现象的影响。
二、实验原理喷泉实验基于气体溶解或化学反应导致烧瓶内气体压强变化而形成液体喷泉的原理。
具体过程如下:1. 将干燥气体充满烧瓶,并通过导管连接至盛有液体的容器。
2. 当烧瓶中的气体溶解于液体或与液体发生化学反应时,烧瓶内气体压强降低。
3. 外界大气压将液体压入烧瓶,形成液体喷泉。
三、实验材料与仪器1. 仪器:烧瓶、胶头滴管、直导管、烧杯、锥形瓶、玻璃棒等。
2. 液体:水、酚酞试液、氯化铁溶液、NaOH溶液等。
3. 气体:氨气、HCl气体、NO气体、CO2气体等。
四、实验步骤1. 将烧瓶与导管连接,并检验装置的气密性。
2. 将烧瓶底朝上,导管朝下,插入盛有液体的烧杯中。
3. 通过胶头滴管向烧瓶中充入干燥气体,直至烧瓶内充满气体。
4. 观察气体溶解或与液体反应,导致烧瓶内气体压强降低,形成液体喷泉。
5. 根据实验现象,分析气体溶解度及化学反应对喷泉现象的影响。
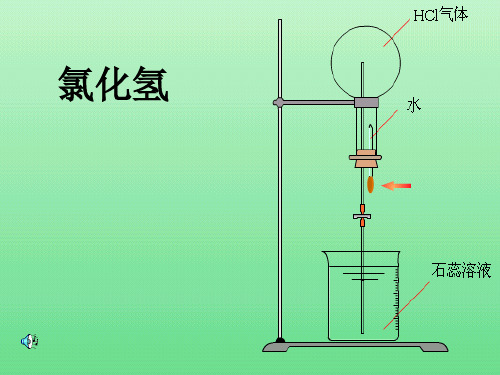
五、实验现象与结果1. 氨气溶解于水,形成红色喷泉,溶液呈碱性。
2. HCl气体溶解于水,形成无色喷泉。
3. NO气体不溶于水,不形成喷泉。
4. CO2气体与NaOH溶液反应,形成无色喷泉。
六、分析与讨论1. 氨气在水中的溶解度较大,因此形成红色喷泉。
2. HCl气体溶解于水,导致烧瓶内气体压强降低,形成无色喷泉。
3. NO气体不溶于水,因此不形成喷泉。
4. CO2气体与NaOH溶液反应,生成碳酸钠,导致烧瓶内气体压强降低,形成无色喷泉。
七、结论1. 喷泉实验原理是基于气体溶解或化学反应导致烧瓶内气体压强变化而形成液体喷泉。
2. 通过实验观察不同气体与液体之间的溶解和反应,可以验证气体溶解度及化学反应对喷泉现象的影响。


hcl喷泉实验原理HCL喷泉实验原理一、引言HCL喷泉实验是一种常见的化学实验,它能够生动形象地展示气体溶解度和反应速率等化学基本概念,并且在教学中被广泛应用。
本文将从实验装置、实验原理、实验步骤和注意事项四个方面详细介绍HCL 喷泉实验的原理。
二、实验装置HCL喷泉实验主要需要以下装置:1. HCL气体源:可以使用玻璃瓶或者气瓶来存储HCL气体。
2. 水槽:用于接收产生的气体和水。
3. 管道:连接HCL气体源和水槽,使气体能够进入水中。
4. 水龙头:调节水流量,控制反应速率。
5. 红色试纸:用于检测产生的HCL酸性。
三、实验原理1. 溶解度溶解度是指在特定温度下单位质量溶剂中所能溶解的物质的最大量。
在这个实验中,当HCL气体进入水中时,会发生反应生成HCI分子。
由于HCI分子是极性分子,可以与水分子形成氢键,因此会在水中溶解。
2. 酸碱反应当HCI分子溶解在水中时,会与水分子发生酸碱反应生成H3O+离子和CI-离子。
H3O+离子是酸性离子,可以使红色试纸变红。
3. 反应速率反应速率是指化学反应单位时间内消耗或生成物质的量。
在这个实验中,当HCL气体进入水中时,由于气泡的存在,会增大接触面积,加快反应速率。
四、实验步骤1. 将水槽填满冷水,并放置在桌面上。
2. 将HCL气体源连接到管道上,并将管道插入水槽中。
3. 打开气瓶或者玻璃瓶的开关,让HCL气体进入水槽中产生气泡。
4. 调节水龙头的流量,使得产生的气泡能够被完全覆盖。
5. 在产生的气泡周围放置红色试纸,并观察试纸变化。
6. 关闭HCL气体源和水龙头,并将装置清洗干净。
五、注意事项1. 实验时要佩戴防护眼镜和手套,避免化学品溅入眼睛和皮肤。
2. HCL气体具有刺激性气味,实验时应保持通风良好。
3. 实验后应及时清洗装置,避免化学品残留造成危害。
4. 实验过程中要注意控制水龙头的流量,避免产生过多的气泡影响实验效果。
总结:HCL喷泉实验是一种生动形象的化学实验,通过观察产生的气泡和红色试纸变化可以直观地了解溶解度、酸碱反应和反应速率等基本概念。


氯化氢的实验室制取
教学目标
1.知识与技能
了解氯化氢的物理化学性质
掌握氯化氢的实验是制法
2.过程与方法
通过观察演示实验,提高学生的观察能力,准确应用化学语言纪录实验现象从喷泉实验的演示到尾气吸收装置,学生学会知识的迁移
3.情感态度价值观
通过实验活动,提高学生的实验设计能力以及创新精神.
教学重点
氯化氢的实验室制法
教学难点
实验室制取氯化氢气体的实验设计
板书
氧气的实验室制取 化学方程式:
二氧化碳的实验室制取 化学方程式:
氯化氢气体的物理性质 无色气体 熔、沸点较低
密度略大于空气 是空气的1.26倍 有刺激性气味 溶解性? 极易溶于水
溶解比例 1:500
运用 氯化氢的尾气吸收
3O 2
2KCl + 2KClO CaCO 3+2HCl CaCl 2+H 2O+CO 2。
hcl喷泉实验原理一、概述HCL喷泉实验是一种常见的化学实验,通过通过喷射氯化氢气体产生的喷泉现象,展示气体的性质和反应特点。
本文将详细讨论HCL喷泉实验原理及其背后的化学原理。
二、实验原理HCL喷泉实验是基于以下两个化学反应:第一反应:2HCl(aq) + CaCO3(s) -> CaCl2(aq) + H2O(l) + CO2(g)第二反应:CaCl2(aq) + 2NaHCO3(aq) -> 2NaCl(aq) + CaCO3(s) + H2O(l) + CO2(g)综合以上两个反应,可以得到实验中观察到的HCL喷泉现象。
三、实验步骤HCL喷泉实验的步骤如下:1.准备一个蒸发皿或小槽,并在其中加入适量的氯化氢溶液(HCL)。
溶液浓度可根据需要调整。
2.将酸性溶液中加入一小块碳酸钙(CaCO3)固体。
3.观察观察现象:当HCL与CaCO3反应时,会产生大量气体(二氧化碳)。
气体的喷射会推动溶液形成喷泉的现象。
四、实验原理解析1. 第一反应第一反应是氯化氢溶液(HCL)与碳酸钙(CaCO3)固体反应的产物反应方程。
在反应过程中,HCL中的氯离子(Cl-)与碳酸钙中的钙离子(Ca2+)结合形成无色的氯化钙溶液(CaCl2)。
同时,反应中产生的水(H2O)和二氧化碳(CO2)也参与了喷泉现象的形成。
2. 第二反应第二反应是氯化钙溶液与碳酸氢钠溶液(NaHCO3)反应的产物反应方程。
在这个反应中,氯离子(Cl-)与碳酸氢钠中的钠离子(Na+)结合形成普通盐溶液(NaCl)。
同时,再次产生的水(H2O)和二氧化碳(CO2)也促进了喷泉现象的发生。
3. 喷泉现象在HCL喷泉实验中,当HCL溶液与CaCO3固体反应时,大量CO2气体会准备产生。
由于气体的体积较大,它会被迫从溶液中迅速释放出来。
由于气体的喷射,溶液呈现出喷泉的形式,迅速冲向上方。
这种现象是由于气体压力推动溶液产生的。
五、实验注意事项在进行HCL喷泉实验时,需要注意以下事项:1.实验操作时要佩戴防护手套和眼镜,避免与化学品接触。
喷泉实验实验报告高中化学实验——喷泉实验实验专题之四喷泉实验一. 关于喷泉实验氨气的喷泉实验是一个很基础也很有趣的演示实验,高考也经常考查与喷泉实验有关的知识,并且考查的内容越来越新颖多样。
喷泉实验利用氨气在水中溶解度很大(体积比1:700),在短时间内烧瓶内气压减小,从而使外界大气压大于瓶内气压,在打开活塞后,大气压将烧杯内的液体压入烧瓶中,在尖嘴导管口形成喷泉。
基于喷泉实验汇总的问题主要有以下几个:(1)这个喷泉实验的原理跟生活中见到的喷泉原理一样吗,不一样的话,能否将生活喷泉的原理搬到化学实验中,(2)老师在课堂演示时有时会出现实验失败,到底是什么原因导致的,有什么方法可以提高实验的成功率,(3)除了形成单一的红色喷泉,能不能形成其他颜色的喷泉呢,如果可以要选用什么药品,能不能设计出彩虹般的喷泉,(4)作为喷泉实验原料气的溶解度应是多少,难溶或不溶性气体能否形成喷泉,(5)喷泉实验的装置如何进行改进和创新,能不能设计出双喷泉甚至三喷泉,(6)实验中有哪些因素会对喷泉的效果有影响,如导管的高度,实验时的温度,吸收液的温度等等,由此拟定研究方向:?化学喷泉与生活喷泉的联系;?喷泉实验的改进研究;?彩色喷泉的探究。
让学生自由选择研究方向,设计实验对相关内容进行探究。
二.生活喷泉与化学喷泉课堂上演示的喷泉实验,是减小烧瓶内气压并在外界大气压的作用下,形成喷泉。
而广场上多姿多彩的喷泉原理是增大内部气压,在正常大气压下形成喷泉,原理与火山喷发类似。
于是,本课题将生活中形成喷泉的原理在实验室进行模拟。
实验一:利用MnO2加快H2O2分解氧气,加大烧瓶内压强,在空气中形成喷泉H2O22H20+O2图1图2步骤:1、先关闭导管上的止水夹,向烧瓶中放入MnO2,分液漏斗中装H2O2,快速塞紧胶塞,打开分液漏斗,使烧瓶中快速聚集氧气,气压增大;2、在一段时间后,打开止水夹,烧瓶中的水受到高压而喷出,在导管的出口处形成喷泉。