有机反应中的极性转化方法
- 格式:pdf
- 大小:191.60 KB
- 文档页数:6

羧酸和酯类化合物了解羧酸和酯类化合物的特点和制备方法羧酸和酯类化合物:特点和制备方法一、引言羧酸和酯类化合物是有机化学中重要的化合物。
本文将探讨羧酸和酯类化合物的特点和制备方法。
二、羧酸的特点羧酸是一种具有羧基(-COOH)的有机化合物。
它可以通过酸碱中和反应转化为盐和水。
羧酸具有以下几个特点:1. 极性:羧酸中的羧基带有电负性,使其具有较强的极性。
这使得羧酸能够与其他极性分子发生强烈的氢键作用。
2. 酸性:羧酸中的羧基可以释放H+离子,使其具有酸性。
常见的羧酸包括乙酸、苯甲酸等。
3. 溶解性:由于羧基的极性,羧酸在水中具有较好的溶解性。
然而,随着碳链的增长,羧酸的溶解性会降低。
三、酯的特点酯是由羧酸与醇反应生成的化合物,其结构中含有酯基(-COOR)。
酯类化合物具有以下几个特点:1. 香味:酯类化合物常常具有芳香而愉悦的气味。
例如,水果中的香气成分主要就是酯。
2. 低沸点:酯类分子间的范德华力较小,因此酯类化合物通常具有较低的沸点。
3. 溶解性:酯类化合物在非极性溶剂中具有良好的溶解性,如醚类、醇类等。
四、羧酸的制备方法羧酸可以通过多种方法进行制备,其中常见的有以下几种:1. 氧化法:将相应的醛或醇通过氧化反应转化为羧酸。
例如,乙醛可以通过氧化剂如高锰酸钾转化为乙酸。
2. 碳酸酯法:将碳酸酯与水反应生成对应的羧酸和醇。
这种方法可以以较高的收率获得羧酸。
3. 酸水解法:将酯与强酸反应,酯中的酯键被酸水解生成相应的羧酸和醇。
例如,苯甲酸甲酯可以通过硫酸的水解反应得到苯甲酸和甲醇。
五、酯的制备方法酯的制备可以通过以下几种方法实现:1. 酸催化酯化反应:将羧酸与醇在酸的催化下反应生成酯。
常用的催化剂有硫酸、废油酸等。
2. 酸氯化酯化反应:将羧酸与酰氯在碱的催化下反应,生成酰氯酯,然后与醇反应生成酯。
3. 酯交换反应:将一个酯与另一个醇在催化剂的存在下反应,生成新的酯化合物。
六、结论通过本文的探讨,我们了解了羧酸和酯类化合物的特点和制备方法。

有机溶剂的极性与溶解度的计算在化学领域中,溶解度是指在一定温度和压力下溶液中最大能溶解的物质量,常用质量分数或摩尔分数来表示。
溶解度的计算对于化学实验、工业生产以及药物研发具有重要意义。
本文将探讨有机溶剂的极性与溶解度之间的关系,并介绍一些计算溶解度的方法。
有机溶剂的极性是指溶剂分子中极性键的数量和强度。
极性键是由原子间的电荷差异引起的化学键,如两个原子间的电负性差异较大。
一般来说,带有电子云分布不均匀的分子更加极性。
极性溶剂可以与带电离子或者带电部分形成静电相互作用,从而溶解离子化合物或极性化合物。
相反,非极性溶剂则倾向于溶解非极性或者低极性的物质。
当我们需要计算有机溶剂的溶解度时,可以考虑以下几个因素:1. 溶剂极性与溶质极性的匹配:通常来说,极性溶剂更适合溶解极性溶质,而非极性溶剂更适合溶解非极性溶质。
这是因为溶剂和溶质之间极性相近时,静电相互作用更强,有利于溶解。
2. 溶剂分子的结构:溶剂分子的结构也会影响其溶解能力。
在一般情况下,较大的溶剂分子对溶解性的提高有利,因为它们具有更多的接触面积,可以与更多的溶质分子发生相互作用。
3. 温度和压力:温度和压力是影响溶解度的重要因素。
温度升高会增加溶质的动力学能量,有利于其在溶剂中溶解。
而压力的增加可以促进溶质与溶剂间的相互作用,从而提高溶解度。
在计算有机溶剂的溶解度时,可以使用一些常见的方法:1. 溶解度参数法:溶解度参数法是一种基于物质属性的经验方法,通过实验数据拟合得到溶剂和溶质的参数,从而预测溶解度。
这些参数包括极性参数、氢键参数和键键参数等。
2. 分子力场模拟:分子力场模拟是使用计算机模拟方法研究溶质和溶剂之间相互作用的方法。
通过构建溶质和溶剂分子的三维结构,并根据它们之间的相互作用力场进行计算,可以预测溶解度。
3. 溶解度预测软件:目前,有一些商业软件可以根据分子结构,使用量化构效关系(QSAR)的方法预测化合物的溶解度。
这些软件使用了大量的实验数据和统计学算法,提供了便捷且准确的溶解度预测。

有机溶剂极性的新定义与经验参数有机溶剂是化学领域中非常重要的一类化合物,在实验室和工业生产中有着广泛的应用。
有机溶剂的极性是其在化学反应和分离过程中至关重要的特性之一。
在过去的研究中,人们通常使用一些经验参数来描述有机溶剂的极性,例如溶剂极性参数(SP值),但这些参数并不能完全准确地描述有机溶剂的极性。
最近,科学家们提出了一种新的定义和经验参数来描述有机溶剂的极性,这为有机溶剂的选择和设计提供了新的思路。
有机溶剂是可以溶解有机化合物的化合物,通常由碳、氢和氧等元素构成。
在化学反应中,有机溶剂可以充当溶剂、催化剂或反应物的角色。
有机溶剂的选择对于化学反应的进行和产物的纯度都有着重要的影响。
而有机溶剂的极性则是决定其在化学反应中作用的一个关键因素。
在过去,人们通常使用SP值来描述有机溶剂的极性。
SP值是由溶剂在苯、甲苯和正庚烷中溶解度的对数组成的经验参数,其数值越大表示溶剂的极性越大。
然而,SP值并不能完全准确地描述溶剂的极性,因为它只是描述了溶剂和溶质之间的相互作用。
最近,科学家们提出了一种新的方法来定义有机溶剂的极性,即通过溶剂的极化率来描述其极性。
溶剂的极化率是溶剂分子在电场作用下发生极化的能力,它可以更准确地反映溶剂分子本身的极性。
对于有机溶剂的极化率可以通过电子亲和势和极化能来计算,这些参数可以通过理论计算或实验方法来获得。
使用溶剂的极化率来描述其极性可以更准确地预测溶剂在化学反应中的作用。
除了定义有机溶剂的极性之外,科学家们还提出了一些新的经验参数来描述有机溶剂的极性。
其中最重要的参数之一是溶剂的极化指数。
溶剂的极化指数是描述溶剂分子极性大小的一个参数,它可以帮助人们更好地理解溶剂在化学反应中的作用。
另外,溶剂的极化指数还可以通过实验方法来测定,这为人们选择和设计有机溶剂提供了一种简便的途径。
通过新的定义和经验参数,人们可以更准确地描述有机溶剂的极性,这为有机溶剂的选择和设计提供了新的思路。

有机合成A 组1.已知①卤代烃(或-Br )可以和金属反应生成烃基金属有机化合物。
后者又能与含羰基化合物反应生成醇:RBr +Mg ()−−−→−O H C 252RMgBr −−→−O CH 2RCH 2OMgBr −−−→−+H O H /2RCH 2OH ②有机酸和PCl 3反应可以得到羧酸的衍生物酰卤:③苯在AlCl 3催化下能与卤代烃作用生成烃基苯: 有机物A 、B 分子式均为C 10H 14O ,与钠反应放出氢气并均可经上述反应合成,但却又不能从羰基化合物直接加氢还原得到。
A 与硫酸并热可得到C 和C ’,而B 得到D 和D’。
C 、D 分子中所有碳原子均可共处于同一平面上,而C’和D’却不可。
请以最基础的石油产品(乙烯、丙烯、丙烷、苯等)并任选无机试剂为原料依下列路线合成B ,并给出A 、C ’、D 的结构简式及下述指定结构简式。
合成B 的路线:2.茚是一种碳氢化合物,其结构为,茚有一种同分异构体A ,A 分子中的碳原子不完全在同一平面上,且A 分子中含有一个苯环,A 有如下变化关系:已知:①R -X −−−−→− 加热NaOH R -OH +HX ②一个碳原子上同时连两个羟基不稳定,会失水形成羰基③B 、C 、D 、E 、F 的分子结构中均有一个苯环根据变化关系和已知条件,试回答(1)A 是 ,B 是 (均填结构简式);(2)写出E 经缩聚生成高聚物的化学方程式: ;(3)写出F 经加聚生成高聚物的化学方程式: ;(4)E →F 的反应类型是 反应;(5)茚与硫酚-SH 反应生成的反应类型是 反应。
3.由指定原料及其他必要的无机及有机试剂会成下列化合物:(1)由丙烯合成甘油。
(2)由丙酮合成叔丁醇。
(3)由1-戊醇合成2-戊炔。
(4)由乙炔合成CH 3CH 2CH 2CH 2CH 2CH 2CH 3。
(5)由CH 3CH 2CH 2CHO 合成4.已知苯磺酸在稀硫酸中可以水解而除去磺酸基:又知苯酚与浓硫酸易发生磺化反应:请用化学方程式表示苯、水、溴、铁、浓硫酸及烧碱等为原料,合成的过程。

千里之行,始于足下。
有机化学基础知识点归纳总结有机化学是研究有机化合物的合成、结构、性质和反应机理的一门科学。
下面是有机化学的一些基础知识点的归纳总结:1. 有机化合物的命名:有机化合物的命名采用一定的规则,常用的命名方法包括命名法、官能团法和系统命名法等。
2. 共价键的构成和特性:在有机化合物中,碳和其他元素通过共享电子而形成共价键,共价键的构成和特性直接影响着有机化合物的性质和反应。
3. 极性和分子极性:极性是指分子中带电离子或极性键所引起的整体效应,分子极性可以通过碳原子上的电负性来决定。
4. 有机反应机理:有机反应的机理研究是有机化学的核心内容,常见的反应机理有亲核取代反应、亲电取代反应、加成和消除等。
5. 功能团的化学性质和反应:有机化合物中的功能团可以决定化合物的性质和反应,例如羧基、酮基、烯烃等。
6. 共轭体系和共轭体系对反应的影响:共轭体系是指一系列连续的共轭双键或共轭环的结构,共轭体系可以影响有机化合物的稳定性和反应性。
7. 反应速率和平衡常数:反应速率和平衡常数是衡量有机反应速率和平衡状态的重要指标,可以通过温度、浓度和催化剂等来控制。
8. 有机分子的空间构型:有机分子的空间构型对于反应的进行起着重要的作用,有机分子的空间构型可以通过各种分析方法来确定。
第1页/共2页锲而不舍,金石可镂。
9. 有机合成策略:有机化学的最终目标是合成特定的有机分子,有机合成策略包括选择合适的起始物质、反应条件和合成路径等。
10. 确定有机化合物的结构:确定有机化合物的结构是有机化学研究的重要内容,常用的方法包括质谱、红外光谱、核磁共振谱等。
以上是有机化学的一些基础知识点的归纳总结,有机化学涉及的内容非常广泛和深入,可以作为初学者入门的参考,同时也是有机化学研究的基础。

了解有机反应的分类和机理有机反应是有机化学领域中的重要内容,它研究的是有机物与其他物质之间的化学变化过程。
有机反应可以根据反应类型和反应机理进行分类。
了解有机反应的分类和机理对深入理解有机化学的基本原理和应用有着重要意义。
一、有机反应的分类有机反应可以按照反应类型分为酯化反应、醚化反应、加成反应、消除反应、重排反应以及取代反应等。
1. 酯化反应酯化反应是指醇与酸酐或酸的酯化反应。
它是一个羧酸衍生物化学反应,常用于有机合成中。
2. 醚化反应醚化反应是指醇与醇或卤代烷烃的缩合反应,形成醚。
醚是一类重要的有机溶剂和极性物质。
3. 加成反应加成反应是指两个或多个有机物的反应,形成一个新的化合物。
包括烯烃的加成反应、芳香化合物的加成反应等。
4. 消除反应消除反应是指有机物中的两个官能团发生分子内或分子间的消除反应,去除原子或官能团。
常见的消除反应有脱水反应、脱卤反应等。
5. 重排反应重排反应是指有机化合物的结构发生重新排列的反应。
它可以通过原子或官能团的迁移来实现。
6. 取代反应取代反应是指有机物中某些原子或基团被其他原子或基团取代的反应。
它是有机化学中最基本和最常见的反应类型。
二、有机反应的机理有机反应的机理描述了反应的步骤和反应物之间的相互作用。
常见的有机反应机理包括自由基机理、电子云机理、阳离子机理和配位机理等。
1. 自由基机理自由基机理是指反应发生过程中涉及到自由基的生成和转化。
自由基反应是一类重要的有机反应,如自由基取代反应、自由基加成反应等。
2. 电子云机理电子云机理是指反应发生时参与反应的电子云的重新排列和共享。
电子云机理适用于大多数有机反应,如酯化反应、醚化反应等。
3. 阳离子机理阳离子机理是指反应物中产生阳离子中间体,并通过中间体的转化完成反应。
阳离子机理适用于许多有机反应,如酯水解反应、醇酸酯化反应等。
4. 配位机理配位机理是指反应物中涉及到配体和配位物的形成和断裂过程。
配位机理适用于一些有机金属络合物的反应。

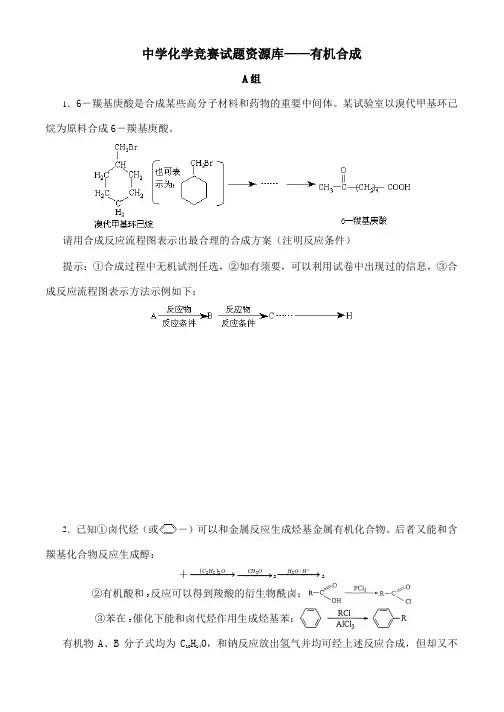
中学化学竞赛试题资源库——有机合成A 组1.6-羰基庚酸是合成某些高分子材料和药物的重要中间体。
某试验室以溴代甲基环己烷为原料合成6-羰基庚酸。
请用合成反应流程图表示出最合理的合成方案(注明反应条件)提示:①合成过程中无机试剂任选,②如有须要,可以利用试卷中出现过的信息,③合成反应流程图表示方法示例如下:2.已知①卤代烃(或-)可以和金属反应生成烃基金属有机化合物。
后者又能和含羰基化合物反应生成醇:+()−−−→−OH C 252−−→−OCH 22−−−→−+H O H /22 ②有机酸和3反应可以得到羧酸的衍生物酰卤:③苯在3催化下能和卤代烃作用生成烃基苯:有机物A 、B 分子式均为C H O ,和钠反应放出氢气并均可经上述反应合成,但却又不能从羰基化合物干脆加氢还原得到。
A和硫酸并热可得到C和C’,而B得到D和D’。
C、D分子中全部碳原子均可共处于同一平面上,而C’和D’却不行。
请以最基础的石油产品(乙烯、丙烯、丙烷、苯等)并任选无机试剂为原料依下列路途合成B,并给出A、C’、D 的结构简式及下述指定结构简式。
合成B的路途:3.由指定原料及其他必要的无机及有机试剂会成下列化合物:(1)由丙烯合成甘油。
(2)由丙酮合成叔丁醇。
(3)由1-戊醇合成2-戊炔。
(4)由乙炔合成3222223(5)由322合成4.已知苯磺酸在稀硫酸中可以水解而除去磺酸基:又知苯酚和浓硫酸易发生磺化反应:请用化学方程式表示苯、水、溴、铁、浓硫酸及烧碱等为原料,合成的过程。
5.以2=2和H 218O 为原料,自选必要的其他无机试剂合成3--18O -C 2H 5,用化学方程式表示实现上述合成最志向的反应步骤。
6.已知甲烷高温下裂解反应的产物随温度不同而不同。
有好用价值的是以下两个反应:4−−−−→−-C o 15001000+2H 2 24−−→−〉C o15002H 2+3H 2试以自然气为唯一有机原料合成乙酸甲酯,写出方程式。


有机溶剂极性的新定义与经验参数有机溶剂在化学实验室和工业生产中起着非常重要的作用。
而有机溶剂的极性是其中一个关键的物理性质,对其它化学过程和物质溶解性都有着重要影响。
有机溶剂的极性不仅影响到其在化学合成中的运用,也直接关系到其在环境中的行为和生物毒性。
然而,对有机溶剂极性的定义和描述并非是一项简单的任务。
有机溶剂的极性是一个相对的概念,它是由溶剂分子的电性质、分子结构和相互作用等因素共同决定的。
在过去的研究中,有机溶剂的极性被定性地描述为溶剂分子中的极性键和非极性键之间的平衡。
然而,伴随着对溶剂极性研究的深入,这种描述已经显得不够准确和全面。
因此,为了更准确地描述和理解有机溶剂的极性,有必要对其进行重新定义和深入研究。
在这篇文章中,我们将从新的角度,结合经验参数,重新定义有机溶剂的极性,并尝试建立相关的理论基础。
我们将首先回顾有机溶剂极性的传统定义和描述,着重指出其存在的不足之处。
然后,我们将介绍一些常用的经验参数,它们可以帮助我们更准确地描述和量化有机溶剂的极性。
最后,我们将提出新的有机溶剂极性的定义,并探讨其在化学实验和工业应用中的意义。
一、传统有机溶剂极性的定义和描述在传统的有机溶剂极性定义中,人们通常将有机溶剂的极性描述为其分子中极性键和非极性键之间的平衡。
溶剂分子中的极性键通常是由含氧、氮、硫等元素组成的偶极分子或氢键分子。
而非极性键则是由碳和氢组成的烷基或环烷基等非极性基团。
溶剂极性的大小通常是通过其介电常数、极化率等物理性质来表征的。
例如,乙醇、二甲醚等极性溶剂的介电常数都较大,而正庚烷、苯等非极性溶剂的介电常数则较小。
然而,这种传统的描述方法存在一些明显的不足之处。
首先,它忽略了溶剂分子中的不同功能基团对其极性的不同贡献。
例如,在甲醇分子中,羟基的极性远远大于甲基的非极性。
然而,在传统的描述中,甲醇往往被简单地归类为极性溶剂,而没有对其内部结构的极性分布进行更细致的分析。
其次,传统的描述方法也忽略了溶剂极性与溶质极性之间相互作用的复杂性。
常见有机合成中的反应条件优化方法有机合成是有机化学的基础,用于合成新的有机化合物的过程。
在有机合成中,常常需要对反应条件进行优化,以获得高度选择性和高产率的反应。
本文将介绍几种常见的有机合成反应条件优化方法。
一、温度优化温度是影响有机反应速率和产率的重要因素之一。
过高或过低的温度都可能导致反应的不完全或不理想。
因此,对于有机反应的温度进行优化是非常关键的。
常见的温度优化方法包括:逐渐升温法、反应-蒸馏法和微波辅助法。
逐渐升温法是指在反应开始时使用较低温度,然后缓慢升温到较高温度,以使反应逐渐进行。
这种方法可以控制反应的速率和产率,减少副反应的发生。
反应-蒸馏法是指在反应进行的同时进行蒸馏,以将产生的揮发性物质随时从反应体系中分离出来。
这种方法可以减少产物的分解和副反应的发生,提高产率。
微波辅助法是指利用微波辐射对反应体系进行加热,从而提高反应速率和产率。
微波辐射可以导致反应混合物中的分子振动和摩擦,从而加速反应过程。
二、催化剂优化催化剂在有机合成中起到促进反应的作用。
选择合适的催化剂可以提高反应速率和选择性。
常见的催化剂优化方法包括:催化剂筛选法、催化剂配方优化法和催化剂再生法。
催化剂筛选法是指通过试验和比较不同催化剂的反应活性和选择性,选择出最适合的催化剂。
这种方法可以节省时间和资源,提高反应效果。
催化剂配方优化法是指通过调整或改变催化剂的配方,优化其反应活性和选择性。
这种方法可以提高催化剂的效果,提高反应产率。
催化剂再生法是指通过吸附剂或化学方法将失活的催化剂再生。
这种方法可以延长催化剂的使用寿命,降低成本。
三、溶剂优化溶剂在有机合成中起到溶解反应物和提供反应介质的作用。
选择合适的溶剂可以提高反应速率和选择性。
常见的溶剂优化方法包括:极性溶剂优化法、离子液体优化法和溶剂替代法。
极性溶剂优化法是指选择适合反应的具有适当极性的溶剂。
不同的反应需要不同极性的溶剂,通过选择合适的溶剂可以提高反应效果。
醛的极性反转及其在有机合成上的应用醛是有机物中的常见羰基,它具有重要的结构和反应性,被广泛用于有机合成和药物合成中。
醛的极性反转是指醛的电子结构从其原来的极性状态发生变化。
在有机合成中,醛的极性反转可以用来改变反应产物的性质,从而获得更好的产品。
醛的极性反转是基于其官能团分子间的相互作用,其官能团分子可以通过改变其电荷来改变其相互作用。
通常情况下,当醛的官能团分子的电荷从正变负时,其电子结构就会发生极性反转。
在有机合成中,醛的极性反转可以用来改变反应过程的结果。
在醛的极性反转的反应过程中,电子的移动可以使反应产物的电荷从正变负,从而改变反应产物的性质。
例如,在有机合成中,醛的极性反转可以使反应产物有更强的化学稳定性,这种反应过程被称为“极性反转加成反应”。
醛的极性反转是指在反应中,醛分子上的氢原子被去除或补充,从而使分子的电荷分布发生变化,醛的反应活性也发生相应的变化。
最常见的醛极性反转反应是氢化反应,即将氢原子添加到醛分子上,使醛变成醇。
这种反应比较简单,可以用铝热法、活性碳法或碱金属法实现,并且可以在室温下实现。
另一种醛极性反转反应是氧化反应,即将氧原子添加到醛分子上,使醛变成酮。
这种反应比较复杂,可以用铜氧化剂或过氧化物反应实现,并且可以在室温下实现。
醛的极性反转可以用于有机合成中,以改变醛分子的反应活性,获得不同的产物。
例如,以醇为原料,用氢化反应可以得到醛,而以醛为原料,用氧化反应可以得到酮。
这种方法可以用于合成某些重要的有机分子,如药物、抗生素、香料等。
此外,醛的极性反转也可以用于改变有机分子的结构,如变换胺的结构,以改变它的生物活性,或者改变烷酸的结构,以改变它的体系性质。
化学有机化学中的反应机理与合成方法在化学有机化学领域,研究有机化合物的反应机理以及合成方法是非常重要的。
有机化学是研究有机物的结构、性质和反应规律的学科,而反应机理则是揭示有机反应发生的步骤和原理,为有机合成提供理论依据和指导。
本文将探讨有机化学中的反应机理与合成方法的基本概念和应用。
一、反应机理1.1 共价键的形成和断裂在有机化学中,反应机理研究的基础是共价键的形成和断裂。
共价键的形成是由于原子之间的电子云重叠,而共价键的断裂则是由于电子的重新分配。
根据电子的重新分配方式,反应可以分为极性反应和非极性反应。
极性反应中,电子云产生偏移,形成正负电荷,而非极性反应中,电子云的重叠没有明显的偏移。
1.2 反应的速率和能垒反应机理中,我们还关注反应的速率和能垒。
反应速率是指单位时间内反应物消耗或产物生成的量,而能垒则是指反应进行所需的最小能量。
能垒越高,反应越困难,能垒越低,反应越容易进行。
理解反应速率和能垒有助于解释反应机理中的活化能和过渡态。
1.3 电子云的移动和中间体的形成在有机化学反应中,电子云的移动和中间体的形成是反应机理的重要内容。
电子云的移动通常通过电子的亲电性和亲核性来实现,亲电试剂具有亲电性,亲核试剂具有亲核性。
电子云的移动经过一系列的中间体,包括碳阳离子、碳负离子、自由基等。
中间体的形成是有机反应中的关键步骤。
二、合成方法2.1 反应类型有机化学合成方法多种多样,根据反应类型的不同可以分为加成反应、消除反应、取代反应、重排反应等。
加成反应是指有机物中两个或多个原子团结合成为一个新的化学键,消除反应是指有机物中的某种原子团与其他原子团的化学键断裂而形成新的化学键。
取代反应是指有机物中一个原子团被另一个原子团取代,重排反应是指有机物中化学键的重新排列。
2.2 确定反应路径和条件在设计和实施有机合成反应时,我们需要确定反应路径和反应条件。
反应路径是指从起始物质到目标产物的一系列反应步骤,通常需要考虑反应的选择性和收率。
光催化有机反应中电荷转移的研究光催化有机反应是一种利用可见光或紫外光激活催化剂,促使有机分子发生化学转化的方法。
它具有高效、环境友好等特点,因此近年来备受研究者的关注。
其中,电荷转移是光催化有机反应中的重要过程之一。
电荷转移是指光激发下,电子从一个分子传递到另一个分子的过程。
在光催化有机反应中,光激�活剂吸收光能,从基态激发至激发态,导致电子结构发生改变,形成电荷分离的离子对。
而这些电荷分离的离子对可以通过电荷转移的方式促使有机分子发生再结合或断裂反应,从而形成新的化学键。
电荷转移通常分为两种类型:偶极电荷转移和单向电荷转移。
偶极电荷转移是指电子和空穴同时从受体和供体分子之间传递的过程。
这种方式支持了许多重要的光催化反应,如偶极基团间的光催化反应和光诱导的电子转移反应。
单向电荷转移是指只有电子或空穴从供体分子传递到受体分子的过程。
由于电子或空穴只传递给一个分子,因此这种电荷转移方式可以针对具有特定反应性的有机基团,实现高选择性的反应。
这对于有机合成来说是非常有吸引力的。
在光催化有机反应中,电荷转移的速率和效率是极为关键的。
因此,研究者在不断探索新的光催化剂和反应体系,以提高电荷转移的效率。
例如,引入金属配位催化剂可以提高光催化反应的效率。
某些金属配位催化剂具有良好的光吸收性能和电子转移性质,能够有效促使电荷分离和转移。
此外,改变配位体的结构,调节配位体和金属之间的电子传输路径,也可以进一步提高电荷转移的速率和选择性。
除了光催化剂的作用,溶剂环境对于电荷转移也有重要影响。
选择合适的溶剂可以促进电子和空穴的传输,改善反应速率和效率。
例如,在极性溶剂中,电子和空穴的迁移速度较快,电子传输路径也相对简单,有利于电荷转移的发生。
而非极性溶剂则可以减少电子或空穴的复合,提高反应的收率。
此外,还有一些研究着眼于材料科学领域,以提高光催化反应中电荷转移的效率。
例如,利用纳米材料作为光催化剂,能够提供更大的比表面积和更多的活性位点,增加光吸收和电子转移的效率。
有机合成中的官能团转化反应官能团转化反应在有机化学中占有重要地位,它是合成有机化合物的关键步骤之一。
通过官能团转化反应,可以将一个有机化合物转化成具有不同官能团的另一个有机化合物,拓展化合物结构的多样性,并为进一步合成更复杂的有机分子奠定基础。
本文将介绍有机合成中常见的官能团转化反应,包括醇的氧化、脱羧、脱水等。
1. 醇的氧化反应醇的氧化反应是官能团转化反应中的重要一环。
常见的醇的氧化反应有以下几种:(1) 醇的烷氧化:将醇中的碳氢键氧化为羟基,得到醛或酮。
常用的氧化剂有高锰酸钾(KMnO4)、氯铬酸(H2Cr2O7)等。
(2) 醇的酯化:将醇中的羟基与酸酐反应,生成酯。
此反应通常需要酸性条件和催化剂,如硫酸。
(3) 醇的脱氧:通过脱除醇中的水分子,生成烯烃。
此反应通常需要较高的温度和催化剂,如磷酸或磷酸酯。
2. 脱羧反应脱羧反应是将羧酸中的羧基脱除,生成酰基化合物的反应。
常见的脱羧反应有以下几种:(1) 羧酸的酯化:通过与醇反应,将羧酸中的羧基转化为酯基。
此反应通常需要酸性条件和催化剂,如硫酸。
(2) 羧酸的酰卤化:通过与卤素酰化剂反应,将羧酸中的羧基转化为卤代酰基。
常用的酰卤化剂有氯化磷(PCl3)、氯化亚砜(SOCl2)等。
(3) 羧酸的脱羧:通过加热或与酸性催化剂反应,将羧酸中的羧基脱除,生成烯烃或炔烃。
此反应通常需要高温和催化剂,如磷酸或磷酸酯。
3. 脱水反应脱水反应是将有机化合物中的水分子脱除,生成双键或多键的反应。
常见的脱水反应有以下几种:(1) 醇的脱水:通过加热或与酸催化剂反应,将醇中的羟基和邻接的氢原子脱除,生成烯烃。
此反应通常需要高温和催化剂,如浓硫酸。
(2) 羧酸的脱水:通过加热或与酸催化剂反应,将羧酸中的羟基和羧基脱除,生成酰亚胺。
此反应通常需要高温和催化剂,如浓硫酸。
(3) 醛或酮的脱水:通过加热或与酸催化剂反应,将醛或酮中的羟基和邻接的氢原子脱除,生成烯烃。
此反应通常需要高温和催化剂,如浓硫酸。