二元气液相平衡数据测定处理结果
- 格式:docx
- 大小:48.86 KB
- 文档页数:4

实验一 二元气液相平衡数据的测定气液相平衡关系是精馏、吸收等单元操作的基础数据。
随着化工生产的不断发展,现有气液平衡数据远不能满足需要。
许多物质的平衡数据很难由理论计算直接得到,必须由实验测定。
平衡数据实验测定方法有两类,即直接法和间接法。
直接法中又有静态法、流动法和循环法等。
其中循环法应用最为广泛。
若要测定准确的气液平衡数据,平衡釜是关键。
现已采用的平衡釜形式有多种,且各有特点,应根据待测物系的特征选择适当的釜型。
用常规的平衡釜测定平衡数据,需样品量多,测定时间长。
本实验用的小型平衡釜主要特点是釜外有真空夹套保温,可观察釜内的实验现象,且样品用量少,达到平衡速度快,因而实验时间短。
一.实验目的1.测定正己烷-正庚烷二元体系在101.325kPa 下的气液平衡数据。
2.通过实验了解平衡釜的构造,掌握气液平衡数据的测定方法和技能。
3.应用Wilson 方程关联实验数据。
二.实验原理以循环法测定气液平衡数据的平衡釜类型虽多,但基本原理相同,如图1-1所示。
当体系达到平衡时,两个容器的组成不随时间变化,这时从A和B两容器中取样分析,即可得到一组平衡数据。
蒸汽循环线A B液体循环线图1-1平衡法测定气液平衡原理图当达到平衡时,除两相的温度和压力分别相等外,每一组分化学位也相等,即逸度相等,其热力学基本关系为:V i L i f f ˆˆ= i s i i i V i x f py γφ=ˆ (1)常压下,气相可视为理想气体,1ˆ=v i φ;再忽略压力对流体逸度的影响,isi p f =从而得出低压下气液平衡关系式为:py i =γisi p i x(2)式中,p ——体系压力(总压);s i p ——纯组分i 在平衡温度下的饱和蒸汽压,可用Antoine 公式计算; x i 、y i ——分别为组分i 在液相和气相中的摩尔分率; γi ——组分i 的活度系数由实验测得等压下气液平衡数据,则可用 s ii i i px py =γ (3)计算出不同组成下的活度系数。

实验三二元系统汽液平衡数据的测定实验概括在化学工业中,蒸馏、吸收过程的工艺和设备设计都需要准确的汽液平衡数据,本实验就是利用双循环汽液平衡器测定的二元汽液平衡数据。
它对提供最佳化的操作条件,减少能源消耗和降低成本等,都有重要意义。
A实验目的⏹了解和掌握用双循环汽液平衡器测定二元汽液平衡数据的方法。
⏹了解缔合系统汽-液平衡数据的关联方法,从实验测得的T-p-x-y数据计算各组分的活度系数。
⏹学会二元汽液平衡相图的绘制。
B 实验原理 蒸馏循环线循环法测定汽液平衡数据的基本原理示意图 当体系达到平衡时,a 、b 容器中的组成不随时间的变化而变化,这时从a 和b 两容器中取样分析,可得到一组汽液平衡试验数据。
baC预习与思考⏹为什么即使在常低压下,醋酸蒸气也不能当作理想气体看待?⏹本实验中气液两相达到平衡的判据是什么?⏹设计用0.1mol/LNaOH标准液测定气液两相组成的分析步骤、并推导平衡组成计算式?⏹如何计算醋酸-水二元系的活度系数?⏹为什么要对平衡温度作压力校正?⏹本实验装置如何防止汽液平衡釜闪蒸、精馏现象发生?如何防止暴沸发生?D实验装置与流程(一)本实验采用改进的Ellis气液两相双循环型蒸馏器,如图所示。
D实验装置与流程(二)⏹改进的Ellis蒸馏器测定汽液平衡数据较准确,操作也简单,但仅适用于液相和气相冷凝液都是均相的系统。
温度测量用分度为0.1℃的水银温度计。
⏹平衡釜加热下方是一个磁力搅拌器,用以加热时搅拌液体;另还有一个电子控制装置,用以调节加热电压及上下两组电热丝保温的加热电压。
⏹分析测试汽液组成时,用化学滴定法。
E实验步骤及方法(一)⏹(1)加料从加料口加入配制好的醋酸-水二元溶液。
⏹(2)加热调节电压150~200V左右,开启磁力搅拌器,缓慢加热至釜液至沸,分别接通上、下保温电源,电压调节在10~15V.⏹(3)控温溶液沸腾,气相冷凝液出现,直到冷凝回流。
气相温度控制在比平衡温度高0.5~1 ℃左右。


序号:40化工原理实验报告实验名称:二元系统气液平衡数据测定学院:化学工程学院专业:化学工程与工艺班级:化工095班姓名:何小龙学号 0940201051 同组者姓名:杨飞黄云张阳指导教师:周国权日期: 2012年3月29日一、实验目的1.了解和掌握用双循环汽液平衡器测定二元系统汽液平衡数据的方法。
2.了解缔合系统汽液平衡数据的关联方法,从实验测得的T-p-x-y数据计算个组分的活度系数。
3.通过实验了解平衡釜的构造,掌握汽液平衡数据的测定方法和技能。
4.掌握二元系统平衡相图的绘制。
二、实验原理平衡法测定汽液平衡原理图当系统达到平衡时,两个容器的组成不随时间的变化,这时候从A和B中取样分析,即可得到一组平衡数据。
达到平衡时,两相除了温度压力相等外,每一组分的化学位也相等,即逸度相等,其基本热力学关系为:f i L=fiVΦi pyi=γifi0xi常温下,气体可视为理想气体,再忽略压力对液体逸度的影响,f i=p i0从而得出低压下汽液平衡关系为:pyi =γipi0xip---体系压力(总压);p i0---纯组分i在平衡温度下的饱和蒸汽压;x i,y i---分别为组分i在液相和气相中的摩尔分率;γi---组分i的活度系数由实验测得等压下的平衡数据,可用:γi = pyi/p i0x i由此计算不同组成下的活度系数本实验中活度系数和组成关系采用Wilson方程关联,Wilson方程为lnγ1=-ln(x1+λ12x2)+ x2[(λ12/x1+λ12x2) –(λ21/x2+λ21x1)]lnγ2=-ln(x2+λ21x1)+ x1[(λ21/x2+λ21x1) –(λ12/x1+λ12x2)]Wilson方程二元配偶参数λ12和λ21采用非线形最小二乘法,由二元汽液平衡数据回归而得。
目标函数选为气相组成误差的平方和,即:F=Σj=1m(y1实-y1计)2j+( y2实-y2计)2j三、实验装置与试剂1.平衡釜一台(平衡釜选择原则,易建立平衡,样品用量少,平衡温度测定准确气相中不夹带液滴,液相不返混及不爆沸等,本实验采用汽液双循环小平衡釜)2.阿贝折射仪一台3.温度计4.1ml及5ml的注射器若干四、实验步骤及注意事项1.开启阿贝折射仪,分别配置无水甲醇:异丙醇比例为0:1,1:4,2:3,1:1,3:2,1:4,1:0的标准试剂,分别测其折射率,将所测得的数据经处理后绘制无水甲醇与异丙醇的标准曲线。

二元系统气液平衡数据测定实验报告实验目的:1. 了解气相和液相的特性和平衡状态;2. 熟悉使用实验仪器进行二元系统气液平衡数据测定;3. 掌握气液平衡实验的数据处理方法。
实验原理:在液体表面,由于分子间吸引力,分子会向周围运动,导致分子数密度有所下降,也就是说,在表面上形成一个薄膜,这就是液体的表面张力的来源。
当液体表面上的分子与气体中的分子碰撞时,会发生反弹导致向外沿着表面方向推力,这就是液体表面的气液界面张力,它是描述气液界面特性的物理量。
气液界面上的分子密度不均匀,会导致气相和液相之间的交换。
在一种给定的温度下,当气相和液相之间的交换达到一定的平衡状态时,称为气液平衡。
在这种状态下,气相和液相的分子数密度不再发生明显的变化。
通过气液平衡实验,可以测定气液界面张力和液体和气体之间的平衡常数,从而获得二元系统气液平衡的数据。
实验仪器:1. 二元系统气液平衡实验仪器;2. 水、乙醇等液体样品;3. 高钼酸钠、酚酞等试剂。
实验步骤:1. 清洗实验仪器:将实验仪器中的气路及液路中的管道和阀门进行清洗,保证实验测量时的通气畅通和样品无杂质。
2. 调整实验仪器:将待测液体注入样品瓶中,打开气路和液路中的阀门,进行预热和抽气,直至达到平衡状态。
3. 测量实验数据:通过测定不同温度下的液体和气体的平衡常数,获得二元系统气液平衡的数据。
4. 处理数据:将实验数据进行整理分析,得出二元系统气液平衡的相关参数。
实验结果:通过实验测量,得出了二元系统气液平衡的相关数据,具体如下:1. 温度:25℃液体样品:水气体样品:空气气液界面张力:72.2 mN/m液体与气体间的平衡常数:0.872. 温度:30℃液体样品:乙醇气体样品:空气气液界面张力:28.6 mN/m液体与气体间的平衡常数:0.65实验结论:通过本次实验的测量和分析,得出了二元系统气液平衡的相关参数。
在不同的温度下,不同的液体和气体之间会发生不同程度的平衡,液体之间和气体之间的分子密度也不同。
二元气液平衡数据的测定一、实验目的1.测定苯—正庚烷二元体系在常压下的气液平衡数据2.通过实验了平衡釜的结构,掌握气液平衡数据的测定方法和技能3.应用Wilson方程关联实验数据二、实验原理以循环法测定气液平衡数据的平衡釜基本原理大都相同,如下图所示,体系达到平衡时,两个容器的组成不随时间变化,这时从A和B 两容器中取样分析,可得到一组平衡数据。
液体循环线图1 平衡法测定汽液平衡原理图当达到平衡时,除了两相的压力和温度分别相等外,每一组分的化学位也相等,即逸度相等,其热力学基本关系为:f i L=f i V(1)φi py i=γi f i0x i常压下,气相可视为理想气体,φi=1;再忽略压力对液体逸度的影响,f i=p i0从而得出低压气液平衡关系为:p y i = r i f i0x i(2)p :体系压力(总压);p i0 :纯组分i在平衡温度下饱和蒸汽压,可用安托尼(Antoine)公式计算;x i :组分i在液相中的摩尔分率;y i :组分i在气相中的摩尔分率;γi :组分i 的活度系数由实验测得等压下气液平衡数据,则可用ii i i py x p γ=(3)计算出不同组成下的活度系数。
本实验中活度系数和组成关系采用Wilson 方程关联。
Wilson 方程为:ln γ1=-ln 22121)(x x x +Λ+)(121221212112x x x x Λ+Λ-Λ+Λ (4)ln γ2=-ln )()(21211212122111212x x x x x x x Λ+Λ-Λ+Λ+Λ+ (5)Wilson 方程二元配偶参数12Λ和21Λ采用非线形最小二乘法,由二元气液平衡数据回归而得.目标函数选为气相组成误差的平方和,即:F=∑=mj 1(y 1实-y 1计)2j +(y 2实-y 2计)2j (6)三、 实验装置和试剂图2 实验装置图1.平衡釜一台(本实验采用气液双循环的小平衡釜,其结构如下图)2.阿贝折射仪一台3.超级恒温槽一台4.50-100十分之一的标准温度计一支、0-50十分之一的标准温度计一支5.所用试剂(苯、正庚烷)为优极品6.1ml 注射器十支、5ml 注射器三支四、 实验步骤1.首先开启超级恒温槽,调节温度至测定折射率所需温度30℃;2.测温套管中倒入甘油,将标准温度计插入套管中,并在其露出部分中间固定一支温度计,对温度进行校正;3.检查整个系统的气密性。
实验二二元气液平衡数据的测定一、实验目的1(测定苯—正庚烷二元体系在常压下的气液平衡数据。
2(通过实验了解平衡釜的结构,掌握气液平衡数据的测定方法和技能。
3(应用Wilson方程关联实验数据。
二、实验原理气液平衡数据是化学工业发展新产品、开发新工艺、减少能耗、进行三废处理的重要基础数据之一。
化工生产中的蒸馏和吸收等分离过程设备的改造与设计、挖潜与革新以及对最佳工艺条件的选择,都需要精确可靠的气液平衡数据。
这是因为化工生产过程都要涉及相间的物质传递,故这种数据的重要性是显而易见的。
随着化工生产的不断发展,现有气液平衡数据远不能满足需要。
许多物系的平衡数据,很难由理论直接计算得到,必须由实验测定。
平衡数据实验测定方法有两类,即间接法和直接法。
直接法中又有静态法、流动法和循环法等。
其中循环法应用最为广泛。
若要测得准确的气液平衡数据,平衡釜是关键。
现已采用的平衡釜形式有多种,而且各有特点,应根据待测物系的特征,选择适当的釜型。
用常规的平衡釜测定平衡数据,需样品量多,测定时间长。
本实验用的小型平衡釜主要特点是釜外有真空夹套保温,釜内液体和气体分别形成循环系统,可观察釜内的实验现象,且样品用量少,达到平衡速度快,因而实验时间短。
以循环法测定气液平衡数据的平衡釜类型虽多,但基本原理相同,如图1所示。
当体系达到平衡时,两个容器的组成不随时间变化,这时从A和B两容器中取样分析,即可得到一组平衡数据。
当达到平衡时,除了两相的压力和温度分别相等外,每一组分的化学位也相等,即逸度相等,其热力学基本关系为:常压下,气相可视为理想气体,ф=1;再忽略压力对液体逸度的影响,i 0f=p从而得出低压下气液平衡关系式为: ii由实验测得等压下气液平衡数据,则可用:计算出不同组成下的活度系数。
本实验中活度系数和组成关系采用Wilson方程关联。
Wilson方程为:Wilson方程二元配偶参数Λ和Λ采用非线性最小二乘法,由二元1221气液平衡数据回归而得。
化工专业实验报告实验名称:二元气液平衡数据的测定实验人员:同组人实验地点:天大化工技术实验中心606 室实验时间:2015年4月20日下午14:00年级:2014硕;专业:工业催化;组号:10(装置2);学号:指导教师:______赵老师________实验成绩:_____________________一.实验目的(1)测定苯-正庚烷二元体系在常压下的气液平衡数据;(2)通过实验了解平衡釜的结构,掌握气液平衡数据的测定方法和技能;(3)应用Wilson 方程关联实验数据。
二.实验原理气液平衡数据是化学工业发展新产品、开发新工艺、减少能耗、进行三废处理的重要基础数据之一。
化工生产中的蒸馏和吸收等分离过程设备的改造与设计、挖潜与革新以及对最佳工艺条件的选择,都需要精确可靠的气液平衡数据。
这是因为化工生产过程都要涉及相间的物质传递,故这种数据的重要性是显而易见的。
平衡数据实验测定方法有两类,即间接法和直接法。
直接法中又有静态法、流动法和循环法等。
其中循环法应用最为广泛。
若要测得准确的气液平衡数据,平衡釜是关键。
现已采用的平衡釜形式有多种,而且各有特点,应根据待测物系的特征,选择适当的釜型。
用常规的平衡釜测定平衡数据,需样品量多,测定时间长。
所以,本实验用的小型平衡釜主要特点是釜外有真空夹套保温,釜内液体和气体分别形成循环系统,可观察釜内的实验现象,且样品用量少,达到平衡速度快,因而实验时间短。
以循环法测定气液平衡数据的平衡釜类型虽多,但基本原理相同,如图 1 所示。
当体系达到平衡时,两个容器的组成不随时间变化,这时从 A 和 B 两容器中取样分析,即可得到一组平衡数据。
图1 平衡法测定气液平衡原理图当达到平衡时,除了两相的压力和温度分别相等外,每一组分的化学位也相等,即逸度相等,其热力学基本关系为:常压下,气相可视为理想气体,Φ=1;再忽略压力对液体逸度的影响,f i=p i0,i从而得出低压下气液平衡关系式为:式中,p----------------体系压力(总压);p i0------------纯组分i在平衡温度下饱和蒸气压;x i、y i-------分别为组分i在液相和气相中的摩尔分率;r i-------------组分i的活度系数;由实验测得等压下气液平衡数据,则可用下式计算不同组成下的活度系数:计算出不同组成下的活度系数:本实验中活度系数和组成关系采用 Wilson 方程关联。
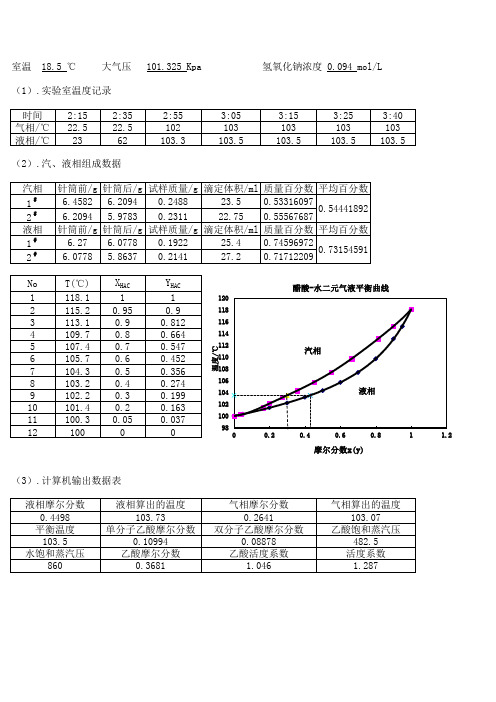
实验数据处理
(1) 乙醇浓度的计算
利用实验参考书提供的乙醇标准曲线数据,由折光率和乙醇摩尔百分率关系用内插法得到乙醇摩尔分率如表1. 计算示例:以第一组气相为例
第一组的气相折光率为1.3595落在折光率1.3594-1.3599之间,对应的乙醇摩尔分率为0.9379-0.8810.插值法计算如下: 1.3599−1.35950.8810−x =1.3599−1.3594
0.8810−0.9379
解出x=0.9265,水的气相摩尔分率=1-x-=0.0735.
(2) 温度计暴露温度校正
n=t 观-(50-1.6*6.7),t 室=25℃,t 实际=t 观+0.00016n(t 观-t 室);
tp=t 实际+0.000125(t 室+273)(P-760),因为本小组实验的P 大于标准大气压,所以用P-760。
计算示例:以第一组为例;
n=t 观-39.28=77.81-39.28=38.53,
t 实际=77.81+0.00016*38.53*(77.81-25)=78.14℃ 平衡温度计算:
tp=t 实际+0.000125(t 室+273)(P-760)=78.18+0.000125(25+273)(761.313-760)=78.19℃
(3) 实验测得的温度和压强以及摩尔分率如表1、表二。
(4) 由所得的二元气液平衡数据表记录如表二。
活度计算示例:以第一组气相为例
根据安托尼(Antoine)公式,lg(Ps)=A-B/(C + t/℃),求出不同平衡温度下乙醇和水的饱和气压,乙醇的安托尼(Antoine)参数:A=8.21330,B=1652.050,C=231.480,水的安托尼(Antoine)参数:A=7.96681,B=1668.21,C=228。
计算乙醇的饱和蒸汽压:
lgP=8.2133-1652.05/(231.48+78.19),得P=755.879mmHg; 计算水的饱和蒸汽压:
lgP=7.96681-1668.21/(228+78.19),得P=330.029mmHg; 计算活度系数:
由简化后的公式:0
i
p x py i i
i =
γ 乙醇的活度系数:
γA=(P*yA)/(xA*P0)=(761.313*0.9265)/(0.8718*755.879)=1.0704 水的活度系数:γB=(P*yB)/(xB*P0)=(761.313*0.0735)/(0.1282*330.029)=1.3225
(5) 由二元气液平衡数据绘制的相图如图2。
表一
表二
表三.乙醇气液相摩尔分率与平衡温度关系图
图一.乙醇折光率与与乙醇摩尔分数关系图
图二.乙醇气液相平衡温度与乙醇摩尔分数关系图
思考题
(1) 影响气液平衡测定准确度的因素有哪些?
答:影响准确度的因素有温度和压强,装置气密性,温度计灵敏度,折射仪读数准确性等。
(2) 为什么即使在常低压下,乙醇蒸汽也不能当做理想气体看待? 答:乙醇蒸汽之间存在氢键,存在多分子的缔合体,所以不能当做理想气体看待。
(3) 本实验装置如何防止气液平衡釜闪蒸、精馏现象发生?如何防止爆沸现象发生?
答:当加热功率过高时,溶液往往会产生完全汽化,将原组成溶液瞬间完全变为蒸气,即闪蒸。
显然,闪蒸得到的气液组成不是平衡的组成。
为此需要调节适当的加热功率,以控制蒸气冷凝液的回流速度。
蒸馏器所得的平衡数据是溶液一次汽化平衡的结果。
但蒸气在上升过程中又遇到液相冷凝液,则又可进行再次汽化,这样就形成了多次蒸馏的精馏操作。
其结果是得不到蒸馏器应得的平衡数据。
为此,在蒸馏器上部必须进行保温,使气相部位略高于液相,以防止蒸气过早的冷凝。
由于沸腾时气泡生成困难,暴沸现象常会发生。
避免的方法是提供气泡生成中心或造成溶液局部过热。
为此,可在实验中鼓入小气泡或在加热管的外壁造成粗糙表面以利于形成气穴;或将电热丝直接与溶液接触,造成局部过热。
(4) 如何计算乙醇-水二元系的活度系数?
答:根据安托尼(Antoine)公式,lg(Ps/kPa)=A-B/(C + t/℃),求出不同平衡温度下乙醇和水的饱和气压,乙醇的安托尼(Antoine)参数:A=8.21330,B=1652.050,C=231.480,水的安托尼(Antoine)参数:A=7.96681,B=1668.21,C=228。
当达到平衡时,除了两相的温度和压力分别相等外,每一组分化学位也相等,即逸度相等,其热力学基本关系为:
V
i L
i f f = (1)
i i i x f py 0
i i γφ=
常压下,气相可视为理想气体,再忽略压力对流体逸度的影响,0
i i p f =
从而得出低压
下气液平衡关系式为:
py i =γi 0
i p i x (2)
式中,p —体系压力(总压);
i p —纯组分i 在平衡温度下的饱和蒸汽压,可用Antoine 公式计算; x i 、y i —分别为组分i 在液相和气相中的摩尔分率; γi —组分i 的活度系数
由实验测得等压下气液平衡数据,则可用
i
p x py i i
i =
γ (3) 计算出不同组成下的活度系数。