基础化学配位化合物及配位平衡习题解答
- 格式:pdf
- 大小:164.04 KB
- 文档页数:3
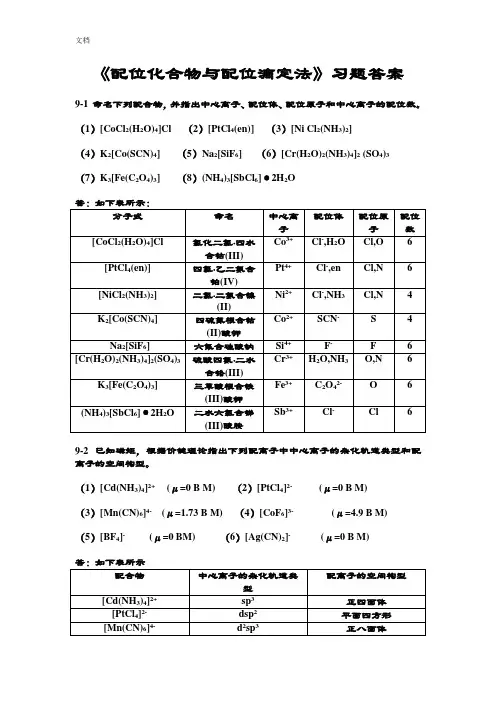
《配位化合物与配位滴定法》习题答案9-1 命名下列配合物,并指出中心离子、配位体、配位原子和中心离子的配位数。
(1)[CoCl2(H2O)4]Cl (2)[PtCl4(en)] (3)[Ni Cl2(NH3)2](4)K2[Co(SCN)4] (5)Na2[SiF6] (6)[Cr(H2O)2(NH3)4]2 (SO4)3(7)K3[Fe(C2O4)3] (8)(NH4)3[SbCl6]·2H2O9-2 已知磁矩,根据价键理论指出下列配离子中中心离子的杂化轨道类型和配离子的空间构型。
(1)[Cd(NH3)4]2+(μ=0 B M) (2)[PtCl4]2-(μ=0 B M)(3)[Mn(CN)6]4- (μ=1.73 B M) (4)[CoF6]3-(μ=4.9 B M)(5)[BF4]-(μ=0 BM) (6)[Ag(CN)2]-(μ=0 B M)9-3 解释下列名词(1)配位原子 (2)配离子 (3)配位数(4)多基(齿)配位体 (5)螯合效应 (6)轨型和外轨型配合物 (7)高自旋和低自旋配合物 (8)磁矩 答:见教材。
9-4 选择适当试剂,实现下列转化。
Ag →AgNO 3→AgCl ↓→[Ag(NH 3)2]Cl →AgBr ↓→Na 3[Ag(S 2O 3)2]→AgI ↓→K[Ag(CN)2] →Ag 2S ↓ 答:转化路线:↓−→−−−→−→−→−−−→−↓−→−−−−→−↓−→−−−→−-----⋅S Ag ]K[Ag(CN)AgI ])O [Ag(S Na AgBr ]Cl )[Ag(NH AgCl AgNO Ag 22232323NH 32232233S KCN I O S Br O H Cl HNO 要点:应记忆题给各常见配合物和沉淀物的稳定转化顺序。
9-11 用EDTA 标准溶液滴定金属离子M ,试证明在化学计量点时, (1)()'21MYpK pMY pM -=(2))(lg 2lg )(lg M c K MY c MY += 证明:(1)化学计量点处,由于EDTA 和金属离子都恰好完全反应,因此由EDTA 和金属离子引起的副反应效应非常小,可以忽略不计;此时的金属离子和EDTA 的浓度主要取决于配合物的解离。

《配位化合物》作业参考解析1. 下列说法正确的是A. 配合物的内界和外界之间主要以共价键相结合B. 中心原子与配体之间形成配位键C. 配合物的中心原子都是阳离子D. 螯合物中不含有离子键【B】A、D:一般认为配合物的内界和外界之间主要以离子键相结合,因此螯合物中内界和外界之间是可以存在离子键的;C:中心原子可以是阳离子,也可以是中性原子,例如[Ni(CO)4];B:中心原子与配体化合时,中心原子提供杂化过的空轨道,配体提供孤对电子,而形成配位键。
2. 下列配合物命名不正确的是A. [Co(H2O)(NH3)3Cl2]Cl 氯化二氯·三氨·一水合钴(Ⅲ)B. [Cr(NH3)6][Co(CN)6] 六氰合钴(Ⅲ)酸六氨合铬(Ⅲ)C. K[Co(NO2)3Cl3] 三硝基·三氯合钴(Ⅲ)酸钾D. H2[PtCl6] 六氯合铂(Ⅳ)酸【C】根据配体命名顺序,先无机后有机,先阴离子后中性分子,同类配体根据配位原子在字母表中的先后顺序进行命名。
对于C中的配合物而言,NO2-以N原子为配位原子时,命名为硝基,带一个负电荷,氯离子也是阴离子,同类配体,根据配位原子在字母表中的先后顺序,Cl-离子在前,NO2-离子在后,因此该配合物应该命名为“三氯·三硝基合钴(Ⅲ)酸钾”。
3. 下列配离子具有正方形或者八面体形结构,其中CO32-最有可能作为双齿配体的是A. [Co(NH3)4(CO3)]+B. [Co(NH3)5(CO3)]+C. [Pt(en)(NH3)(CO3)]D. [Pt(en)2(NH3)(CO3)]2+【A】根据题意,配离子具有正方形结构时,配位数为4,形成四个配位键;具有八面体结构时,配位数为6,形成6个配位键。
B:[Co(NH3)5(CO3)]+ 配离子中,已有5个氨作为配体,氨是单齿配体,形成5个配位键,因此该配离子中,CO32-离子只能是单齿配体,这样就形成了6个配位键;C:[Pt(en)(NH3)(CO3)] 配合物中,乙二胺(en)为双齿配体,形成2个配位键,氨为单齿配体,形成1个配位键,因此CO32-离子只能是单齿配体,这样就形成了4个配位键;D:[Pt(en)2(NH3)(CO3)]2+ 配离子中,乙二胺(en)为双齿配体,2个en形成4个配位键,氨为单齿配体,形成1个配位键,因此CO32-离子只能是单齿配体,这样就形成了6个配位键;A:[Co(NH3)4(CO3)]+ 配离子中有4个氨为配体,形成4个配位键,因此CO32-离子必须是双齿配体,这样就形成了4个配位键,如果CO32-离子是单齿配体,那么配离子的配位数为5,这与题意不符。

配位化合物习题及解析————————————————————————————————作者: ————————————————————————————————日期:《配位化合物》作业参考解析1. 下列说法正确的是A.配合物的内界和外界之间主要以共价键相结合B.中心原子与配体之间形成配位键C.配合物的中心原子都是阳离子D.螯合物中不含有离子键【B】A、D:一般认为配合物的内界和外界之间主要以离子键相结合,因此螯合物中内界和外界之间是可以存在离子键的;C:中心原子可以是阳离子,也可以是中性原子,例如[Ni(C O)4];B:中心原子与配体化合时,中心原子提供杂化过的空轨道,配体提供孤对电子,而形成配位键。
2. 下列配合物命名不正确的是A. [Co(H2O)(NH3)3Cl2]Cl氯化二氯·三氨·一水合钴(Ⅲ)B.[Cr(NH3)6][Co(CN)6] 六氰合钴(Ⅲ)酸六氨合铬(Ⅲ)C.K[Co(NO2)3Cl3]三硝基·三氯合钴(Ⅲ)酸钾D.H2[PtCl6]六氯合铂(Ⅳ)酸【C】根据配体命名顺序,先无机后有机,先阴离子后中性分子,同类配体根据配位原子在字母表中的先后顺序进行命名。
对于C中的配合物而言,NO2-以N原子为配位原子时,命名为硝基,带一个负电荷,氯离子也是阴离子,同类配体,根据配位原子在字母表中的先后顺序,Cl-离子在前,NO2-离子在后,因此该配合物应该命名为“三氯·三硝基合钴(Ⅲ)酸钾”。
3. 下列配离子具有正方形或者八面体形结构,其中CO32-最有可能作为双齿配体的是A. [Co(NH3)4(CO3)]+B. [Co(NH3)5(CO3)]+C.[Pt(en)(NH3)(CO3)] D.[Pt(en)2(NH3)(CO3)]2+【A】根据题意,配离子具有正方形结构时,配位数为4,形成四个配位键;具有八面体结构时,配位数为6,形成6个配位键。
B:[Co(NH3)5(CO3)]+配离子中,已有5个氨作为配体,氨是单齿配体,形成5个配位键,因此该配离子中,CO32-离子只能是单齿配体,这样就形成了6个配位键;C:[Pt(en)(NH3)(CO3)] 配合物中,乙二胺(en)为双齿配体,形成2个配位键,氨为单齿配体,形成1个配位键,因此CO32-离子只能是单齿配体,这样就形成了4个配位键;D:[Pt(en)2(NH3)(CO3)]2+ 配离子中,乙二胺(en)为双齿配体,2个en形成4个配位键,氨为单齿配体,形成1个配位键,因此CO32-离子只能是单齿配体,这样就形成了6个配位键;A:[Co(NH3)4(CO3)]+配离子中有4个氨为配体,形成4个配位键,因此CO32-离子必须是双齿配体,这样就形成了4个配位键,如果CO32-离子是单齿配体,那么配离子的配位数为5,这与题意不符。

第八章 配位化合物与配位滴定习题1:配位化合物部分1 无水CrCl 3和氨作用能形成两种配合物A 和B ,组成分别为CrCl 3·6NH 3和CrCl 3·5NH 3。
加入AgNO 3,A 溶液中几乎全部氯沉淀为AgCl ,而B 溶液中只有2/3的氯沉淀出来。
加入NaOH 并加热,两种溶液均无氨味。
试写出这两种配合物的化学式并命名。
解:因加入AgNO 3,A 溶液中几乎全部氯沉淀为AgCl ,可知A 中的三个Cl -全部为外界离子,B 溶液中只有2/3的氯沉淀出来,说明B 中有两个Cl -为外界,一个Cl -属内界。
加入NaOH ,两种溶液无氨味,可知氨为内界。
因此A 、B 的化学式和命名应为,A :[Cr(NH 3)6]Cl 3 三氯化六氨合铬(Ⅲ) B :[Cr(NH 3)5Cl]Cl 2 二氯化一氯五氨合铬(Ⅲ)2 指出下列配合物的中心离子、配体、配位数、配离子电荷数和配合物名称。
解:3 试用价键理论说明下列配离子的类型、空间构型和磁性。
解:(1)CoF 63-和Co(CN)63-CoF 63-为外轨型,空间构型为正八面体,顺磁性,磁矩=B μ90.4)24(4=+。
Co(CN)63-为内轨型,空间构型为正八面体,抗磁性,磁矩为零。
(2)Ni(NH 3)42+和Ni(CN)42-Ni(NH 3)42+为外轨型,正四面体型,顺磁性,磁矩=B μ83.2)22(2=+。
Ni(CN)42-为内轨型,平面正方型,抗磁性,磁矩为零。
4 将0.1mol·L -1ZnCl 2溶液与1.0 mol·L -1NH 3溶液等体积混合,求此溶液中Zn(NH 3)42+和Zn 2+的浓度。
解:等体积混合后,ZnCl 2和NH 3各自的浓度减半,生成的Zn(NH 3)42+的浓度为0.05 mol·L -1,剩余的NH 3的浓度为0.3 mol·L -1,设Zn 2+的浓度为x mol·L -1。
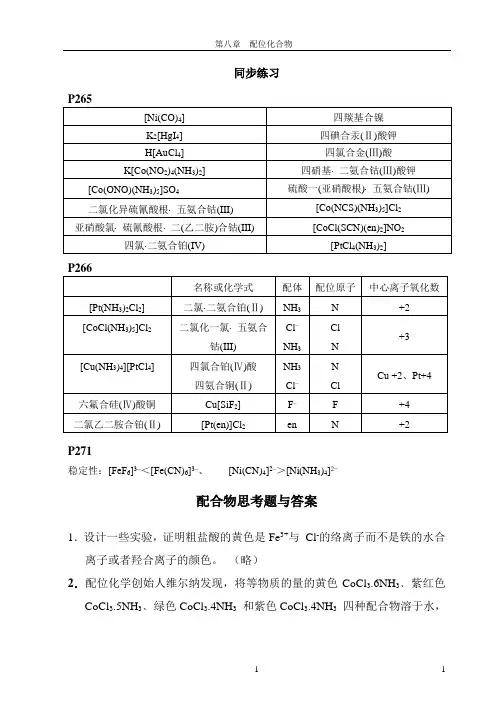
同步练习P265[Ni(CO)4]四羰基合镍K2[HgI4] 四碘合汞(Ⅱ)酸钾H[AuCl4]四氯合金(Ⅲ)酸K[Co(NO2)4(NH3)2] 四硝基⋅二氨合钴(Ⅲ)酸钾[Co(ONO)(NH3)5]SO4硫酸一(亚硝酸根)⋅五氨合钴(Ⅲ) 二氯化异硫氰酸根⋅五氨合钴(III) [Co(NCS)(NH3)5]Cl2亚硝酸氯⋅硫氰酸根⋅二(乙二胺)合钴(III)[CoCl(SCN)(en)2]NO2四氯⋅二氨合铂(IV)[PtCl4(NH3)2]P266名称或化学式配体配位原子中心离子氧化数[Pt(NH3)2Cl2] 二氯⋅二氨合铂(Ⅱ) NH3N +2[CoCl(NH3)5]Cl2二氯化一氯⋅五氨合钴(III) Cl–NH3ClN+3[Cu(NH3)4][PtCl4] 四氯合铂(Ⅳ)酸四氨合铜(Ⅱ) NH3Cl–NClCu +2、Pt+4六氟合硅(Ⅳ)酸铜Cu[SiF2] F– F +4二氯乙二胺合铂(Ⅱ) [Pt(en)]Cl2en N +2P271稳定性:[FeF6]3–<[Fe(CN)6]3–、[Ni(CN)4]2–>[Ni(NH3)4]2−配合物思考题与答案1.设计一些实验,证明粗盐酸的黄色是Fe3+与Cl-的络离子而不是铁的水合离子或者羟合离子的颜色。
(略)2.配位化学创始人维尔纳发现,将等物质的量的黄色CoCl3.6NH3﹑紫红色CoCl3.5NH3﹑绿色CoCl3.4NH3和紫色CoCl3.4NH3四种配合物溶于水,加入硝酸银,立即沉淀的氯化银分别为 3 ﹑2 ﹑1 ﹑1mol,请根据实验事实推断它们所含的配离子的组成。
答:配离子分别是[Co(NH3)6]3+, [Co(NH3)5Cl]2+ , [Co(NH3)4Cl2] +, [Co(NH3)4Cl2] +,颜色不同的原因是有同分异构体。
3.实验测得Fe(CN)64-和Co(NH3) 63+均为反磁性物质(磁矩等于零),问它们的杂化轨道类型。

习 题八一、选择题(将正确答案的序号填在括号内) 1.下列配合物中心离子的配位数有错误的是( )a.[Co(NO 2)3(NH 3)3];b.K 2[Fe(CN)5NO];c.[CoCl 2(NH 2)2(en)2];d.[Co(NH 3)4Cl 2]Cl 。
2.关于配合物,下列说法错误的是( )a.配体是一种可以给出孤对电子或π健电子的离子或分子;b.配位数是指直接同中心离子相连的配体总数;c.广义地讲,所有金属离子都可能生成配合物;d.配离子既可以存在于晶体中,也可以存在于溶液中。
3.关于外轨型与内转型配合物的区别,下列说法不正确的是( )a.外轨型配合物中配位原子的电负性比内轨型配合物中配位原子的电负性大;b.中心离子轨道杂化方式在外轨型配合物是ns 、np 、nd 轨道杂化,内轨型配合物是(n-1)d 、ns 、np 轨道杂化;c.一般外轨型配合物比内轨型配合物键能小;d.通常外轨型配合物比内轨型配合物磁矩小。
4.当下列配离子浓度及配体浓度均相等时,体系中Zn 2+离子浓度最小的是( )a.()+243NH Zn ; b.()+22en Zn ;c. ()-24CN Zn d.()-24OH Zn。
5.Fe(Ⅲ)形成配位数为6的外轨型配合物中,Fe 3+离子接受孤对电子的空轨道是( )a.d 2sp 3;b.sp 3d 2;c.p 3d 3d.sd 5 6.下列配离子能在强酸性介质中稳定存在的是( )a.()-3232O S Ag ; b.()+243NH Ni ; c.()-3342O C Fe ; d.-24HgCl 。
7.测得()+363NH Co 的磁矩µ=0.0B· M,可知Co 3+离子采取的杂化类型为( )a.d 2sp 3;b.sp 3d 2;c.sp 3 ;d.dsp 2 8.下列物质具有顺磁性的是( )a.()+23NH Ag ; b.()-46CN Fe ; c.()+243NH Cu ; d.()-24CN Zn9.下列物质中,能作为螯合剂的为( )a.HO-OH ;b.H 2N-NH 2;c.(CH 32)2N-NH 2;d.H 2N-CH 2-CH 2-NH 2。

配位化学习题答案配位化学是无机化学中的一个重要分支,它研究的是配合物的合成、结构和性质。
在学习配位化学的过程中,学生常常会遇到一些难题,需要进行深入的思考和探索。
本文将针对一些典型的配位化学学习题进行解答和讨论,希望能够帮助读者更好地理解和掌握这一领域的知识。
1. 题目:给出一个配合物的化学式,要求判断其属于哪种配位数。
解答:判断一个配合物的配位数,需要根据中心金属离子周围配体的数目来确定。
常见的配位数有2、4、6等。
例如,对于化学式[Co(NH3)6]Cl3,其中的Co离子周围有6个NH3配体,因此配位数为6。
而对于化学式[Fe(CN)6]3-,其中的Fe离子周围有6个CN配体,配位数同样为6。
2. 题目:给出一个配合物的化学式,要求判断其中的配体是何种配体。
解答:判断一个配合物中的配体种类,需要根据配体的化学式和结构来确定。
常见的配体有水分子(H2O)、氨分子(NH3)、氰根离子(CN-)等。
例如,对于化学式[Co(NH3)6]Cl3,其中的配体是氨分子。
而对于化学式[K4[Fe(CN)6]],其中的配体是氰根离子。
3. 题目:给出一个配合物的化学式,要求判断其中的配体是否具有配位异构体。
解答:配位异构体是指在同一配合物中,配体的排列方式不同所形成的异构体。
判断一个配合物是否具有配位异构体,需要分析配体的排列方式和配位数。
例如,对于化学式[Co(NH3)5Cl]Cl2,其中的配体氨分子和氯离子可以有不同的排列方式,形成配位异构体。
而对于化学式[Co(NH3)6]Cl3,其中的配体氨分子的排列方式只有一种,因此不具有配位异构体。
4. 题目:给出一个配合物的化学式,要求判断其中的配体是否具有手性。
解答:手性是指分子或配合物不重合于其镜像形式的性质。
判断一个配合物是否具有手性,需要分析配体的结构和对称性。
如果配体的结构中存在手性中心或手性轴,那么配合物就具有手性。
例如,对于化学式[Co(en)3]Cl3,其中的配体乙二胺(en)具有手性,因此配合物具有手性。