硝酸钾SDS
- 格式:docx
- 大小:19.57 KB
- 文档页数:4

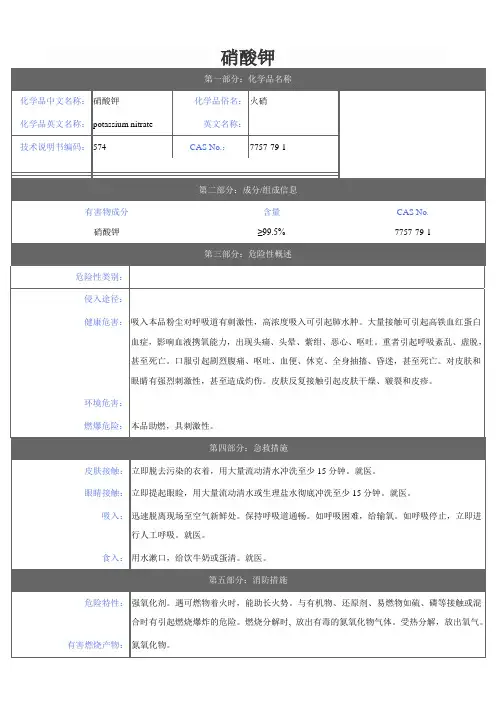
第一部分:化学品及企业标识化学品中文名:硝酸钾;火硝;硝石化学品英文名:potassium nitrate;saltpeter分子式:KNO3相对分子质量:140.21第二部分:成分/组成信息√纯品混合物有害物成分浓度 CAS No.硝酸钾 7757-79-1第三部分:危险性概述危险性类别:第5.1类氧化剂侵入途径:吸入、食入健康危害:吸入本品粉尘对呼吸道有刺激性,高浓度吸入可引起肺水肿。
大量接触可引起高铁血红蛋白症,影响血液携氧能力,出现头痛、头晕、紫绀、恶心、呕吐。
重者引起呼吸紊乱、虚脱,甚至死亡。
口服引起剧烈腹痛、呕吐、血便、休克、全身抽搐、昏迷,甚至死亡。
对皮肤和眼镜有强烈刺激性,甚至造成灼伤。
皮肤反复接触引起皮肤干燥、皲裂和皮疹。
环境危害:对水生生物是有毒的燃爆危险:助燃。
与可燃物混合能形成爆炸性混合物。
第四部分:急救措施皮肤接触:立即脱去污染的衣着,用大量流动清水冲洗20~30min。
如有不适感,就医。
眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗10~15min。
如有不适感,就医。
吸入:迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
呼吸、心跳停止,立即进行心肺复苏术。
就医。
食入:漱口。
就医。
第五部分:消防措施危险特性:强氧化剂。
遇可燃物着火时,能助长火势。
与有机物、还原剂、易燃物如硫、磷等接触或混合时有引起燃烧爆炸的危险。
受热分解,放出氧气。
有害燃烧产物:无意义灭火方法:本品不燃。
根据着火原因选择适当灭火剂灭火。
灭火注意事项及措施:消防人员必须佩戴空气呼吸器、穿全身防火防毒服,在上风向灭火。
尽可能将容器从火场移至空旷处。
喷水保持火场容器冷却,直至灭火结束。
切勿将水流直接射至熔融物,以免引起严重的流淌火灾或引起剧烈的沸溅。
第六部分:泄漏应急处理应急处理:隔离泄漏污染区,限制出入。
建议应急处理人员戴防尘口罩,穿防毒服,带氯丁橡胶手套。
勿使泄漏物与可燃物质(如木材、纸、油等)接触。

硝酸钾的作用硝酸钾是一种常见的化学物质,其化学式为KNO3,在实验室中常用作氧化剂和硝化剂。
以下将介绍硝酸钾在不同领域中的主要作用。
首先,在农业领域中,硝酸钾是一种重要的植物肥料。
作为一种含氮化合物,硝酸钾可以提供植物所需的氮元素,促进植物的生长发育。
此外,硝酸钾还具有一定的耐盐性,适用于一些土壤较贫瘠且盐碱化的地区。
因此,硝酸钾广泛用于农作物的肥料生产和土壤改良,提高农作物的产量和质量。
其次,在工业领域中,硝酸钾常作为炸药、火药等爆炸物的主要成分之一。
硝酸钾在高温或剧烈摩擦下会分解产生大量氧气,从而提供极其丰富的氧气供火焰燃烧,加速燃烧反应的速度和强度。
因此,硝酸钾在炸药和火药的制备中具有重要的作用,可用于军事、民用爆炸物的生产和应用。
此外,硝酸钾还常用于制备玻璃和陶瓷等工艺中。
硝酸钾在高温下可以促进石英等原料的熔化,并提高玻璃和陶瓷制品的透明度和光泽。
此外,硝酸钾还可以调节玻璃和陶瓷制品的熔点和热膨胀系数,从而增强材料的耐热性和抗冲击性能。
因此,硝酸钾在玻璃和陶瓷工业中被广泛应用于生产出高质量的玻璃器皿、器具和陶瓷制品等。
此外,硝酸钾还常用于无污染的水系统中的循环冷却剂。
硝酸钾作为一种无毒、无腐蚀性物质,可以降低水的冰点和沸点,从而提高水的冷却效果。
因此,硝酸钾常用于制冷设备、空调系统和冷却塔等循环冷却系统的工作液中,从而提高系统的冷却效果和节约能源。
综上所述,硝酸钾在农业、工业、玻璃陶瓷制造和循环冷却系统等领域中具有重要的作用。
无论是作为植物肥料、爆炸物的主要成分、玻璃陶瓷的制备剂还是循环冷却系统中的工作液,硝酸钾都发挥着重要的作用,为人们的生产生活提供了极大的便利和效益。
然而,在使用硝酸钾的过程中,我们必须注意遵循安全操作规程,以防止意外事故的发生。

化学式硝酸钾
化学式硝酸钾:KNO3
1.化学成分:
硝酸钾是一种离子化合物,其分子式为KNO3,也可以写作NO3K。
2.物理性质:
硝酸钾的外观为无色或白色晶体,具有独特的酸性气味。
它可以溶解
于水,但不溶于乙醇和乙醚等非极性溶剂。
硝酸钾在高温下可以分解,产生氧气。
3.化学性质:
硝酸钾是一种氧化剂,它可以与还原剂发生剧烈反应。
当硝酸钾加热
至高温时,它会分解成氧气和二氧化氮。
硝酸钾还可以被还原为氮气
和水。
4.应用领域:
硝酸钾是一种重要的化工原料,广泛用于火药、烟火、肥料、玻璃等
行业。
硝酸钾和硫磺、木炭混合后可以制成黑火药;硝酸钾和铁粉混合可以制成红火药;硝酸钾还可以用于制备医药和食品添加剂等。
5.安全注意事项:
硝酸钾是一种强氧化剂,具有一定的危险性,要注意以下事项:
(1)避免硝酸钾与还原剂混合,避免火灾和爆炸等意外事故。
(2)硝酸钾具有腐蚀性,要注意避免与皮肤和眼睛接触,发生刺激和灼伤。
(3)硝酸钾遇热分解时会产生有毒气体,要加强通风以避免中毒。
以上就是硝酸钾的相关内容介绍,希望能对大家有所帮助。

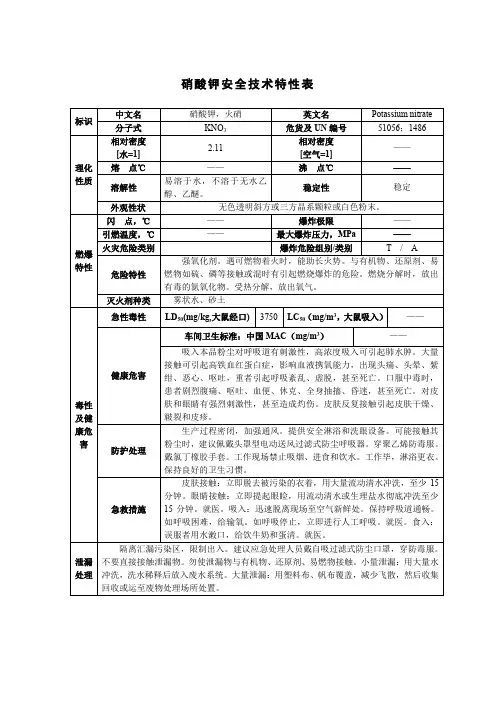
硝酸钾的理化性质及危险特性表MSDS标识英文名:potassium分子式:KNO3分子量:101.10危险货物编号:51056UN编号:1486RTECS号:TT3700000IMDG规则页码:CAS号:7757-79-1理化性质外观与性状:无色透明斜方或三方晶系颗粒或白色粉末。
主要用途:用于制造烟火、火药、火柴、医药,以及玻璃工业。
熔点(℃)334相对密度(空气=1)--沸点(℃)--相对密度(水=1) 2.11临界温度(℃)--临界压力(Mpa)--饱和蒸汽压(Kpa)--燃烧热(kJ/mol)--最小引燃热量(mJ)--溶解性:易溶于水,不溶于无水乙醇、乙醚。
毒性与健康危害及急救措施接触限值(mg/m3)中国MAC:未制定标准美国TLV-TWA::未制定标准前苏联MAC:5美国TLV-STEL::未制定标准侵入途径吸入,食入,经皮吸收毒性LD503750mg/kg(大鼠经口)LC50无资料健康危害吸入本品粉尘对呼吸道有刺激性,高浓度吸入可引起肺水肿。
大量接触可引起高铁血红蛋白血症,影响血液携氧能力,出现头痛、头晕、恶心、呕吐。
重者引起呼吸紊乱,虚脱甚至死亡。
口服引起剧烈腹痛、呕吐、血便、休克、全身抽搐、昏迷,甚至死亡。
对皮肤和眼睛有强烈刺激性,甚至造成灼伤。
皮肤反复接触引起皮肤干燥、皲裂和皮疹。
急救措施皮肤接触立即脱去被污染的衣着,应用大量流动清水冲洗至少15分钟。
就医。
眼睛接触立即提起眼睑,用大量流动清水或生理盐水彻底冲洗,至少15分钟。
就医。
吸入迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
如呼吸停止,立即进行人工呼吸。
就医。
食入误服者用水漱口,给饮牛奶和蛋青。
就医。
燃烧爆炸危险性燃烧性本品助燃,具刺激性。
闪点(℃)无意义引燃温度(℃)无意义爆炸极限(v%)无意义危险特性强氧化剂。
与可燃物着火时,能助长火势。
与有机物、还原剂、易燃物如硫、磷接触或混合时有引起燃烧爆炸的危险。

高纯硝酸钾摘要:高纯硝酸钾是一种重要的化工原料,在许多领域中有广泛的应用。
本文对高纯硝酸钾进行了全面的介绍,包括其性质、制备方法、应用领域及安全注意事项等内容。
通过该文档的阅读,读者能够全面了解高纯硝酸钾的各方面知识。
一、引言高纯硝酸钾(Potassium Nitrate,化学式:KNO3)是一种无机化合物,常温下为无色结晶,可溶于水。
由于其具有良好的稳定性和化学性质,高纯硝酸钾在多个领域中广泛应用,例如火药制造、肥料生产、玻璃制造、食品加工等。
二、性质高纯硝酸钾是一种无色结晶,具有无臭或微臭味。
其密度为2.109 g/cm³,熔点为334℃,沸点为400℃。
高纯硝酸钾可溶于水,溶解度随温度升高而增加。
在空气中加热到高温时,高纯硝酸钾会发生分解反应,产生氧气和二氧化氮。
三、制备方法高纯硝酸钾的制备方法主要有两种:石硝法和硝化钾法。
1. 石硝法:石硝法是一种将硫酸铵与硝酸钙反应生成高纯硝酸钾的方法。
具体步骤如下:a) 将硫酸铵和硝酸钙按照摩尔比例混合;b) 将混合物在适当温度下加热煅烧;c) 过滤得到高纯硝酸钾溶液;d) 蒸发溶液得到高纯硝酸钾晶体。
2. 硝化钾法:硝化钾法是一种将硫酸银与钾盐反应生成高纯硝酸钾的方法。
具体步骤如下:a) 将硫酸银和钾盐按照摩尔比例混合;b) 加入水溶液,反应生成硝酸银和硫酸钾的混合物;c) 过滤得到硫酸钾溶液;d) 蒸发溶液得到高纯硝酸钾晶体。
四、应用领域高纯硝酸钾在众多领域中有广泛的应用。
以下是几个常见的应用领域:1. 火药制造:高纯硝酸钾是火药的主要成分之一。
其在火药中起到提供氧化剂的作用。
由于高纯硝酸钾的稳定性较好,能够稳定火药的性能,因此广泛应用于各类火药的制造。
2. 肥料生产:高纯硝酸钾作为一种氮肥,被广泛应用于农业领域。
它能够提供植物所需的氮元素,促进植物的生长发育。
此外,高纯硝酸钾还具有提高作物品质、增加产量的效果。
3. 玻璃制造:高纯硝酸钾在玻璃制造中用作剂量和着色剂。

硝酸钾原料硝酸钾,化学式为KNO3,是一种常见的无机化合物,也是一种重要的氧化剂和氮肥原料。
它具有白色结晶或颗粒状,无臭,可溶于水。
以下将从硝酸钾的生产、性质以及应用等方面进行介绍。
硝酸钾的生产主要有两种方法,一种是通过硝酸和氢氧化钾反应得到,另一种是通过硝酸和钾盐反应得到。
其中,通过硝酸和氢氧化钾反应得到的硝酸钾纯度较高。
在工业上,硝酸钾通常是通过硝酸和钾盐反应得到的。
这个反应过程中,需要控制反应条件,如温度、压力和反应时间等,以确保产品的纯度和产量。
此外,硝酸钾也可以通过从天然硝石中提取得到。
硝酸钾具有一些特殊的性质。
首先,它是一种氧化剂,可以与许多物质发生剧烈的反应,释放出氧气。
由于其氧化性质,硝酸钾广泛应用于火药和炸药的制造。
其次,硝酸钾是一种良好的氮肥原料。
作为氮源,硝酸钾可以提供植物所需的氮元素,促进作物生长。
此外,硝酸钾还可以用于制备玻璃、陶瓷和肥皂等工业产品。
硝酸钾在农业上有重要的应用。
作为一种氮肥原料,硝酸钾可以提供植物所需的氮元素。
氮是植物生长的关键营养元素之一,它参与植物体内的许多代谢过程,如蛋白质合成和光合作用等。
因此,适量施用硝酸钾可以促进作物的生长和发育,提高产量和品质。
此外,硝酸钾还具有调节作物生长的作用,可以改善作物的抗逆性,增强植物对病虫害的抵抗能力。
除了在农业上的应用,硝酸钾还被广泛应用于其他领域。
在工业上,硝酸钾可用于制备火药和炸药。
它的氧化性质使其成为一种重要的爆炸剂。
硝酸钾与燃料反应时,能够迅速释放出大量的氧气,从而加剧燃烧反应,产生巨大的热量和压力。
因此,硝酸钾被广泛用于军事、矿山和民用爆炸器材中。
此外,硝酸钾还可以用于制备玻璃、陶瓷和肥皂等工业产品。
硝酸钾是一种重要的无机化合物,具有广泛的应用价值。
它不仅是一种重要的氧化剂和氮肥原料,还可以用于制备火药、炸药以及其他工业产品。
由于其特殊的性质和多样的应用,硝酸钾在农业、工业和军事等领域都有着重要的地位。

硝酸钾提纯方法
硝酸钾是由氯化钾和硝酸反应生成的无色固体物质,主要用于农药、医药、染料和冷冻剂的制造、分离和分析,是具有重要经济价值的中间体和原料。
因为它的可溶性和稳定性,它的提纯也很重要。
下面介绍了硝酸钾提纯的基本方法。
首先,将硝酸钾溶于温水中,在不改变温度的情况下用硝酸钠滴定至pH7.5,然后将溶液离心分离,加入硝酸钙搅拌,使懂沉淀大粒,使悬浮液的清澈度提高,再经过离心分离,就可以得到纯的硝酸钾悬液。
其次,将硝酸钾悬液加热至70℃,用无水硫酸钠滴定至pH6.5,使硝酸钾降解为氯化钾溶液,然后利用氯化钾萃取硝酸钾悬液,提取清澈的硝酸钾溶液,并且将提取的溶液加热蒸发,最后得到白色结晶硝酸钾。
最后,对提取的硝酸钾结晶进行熔融,将温度控制在120℃,最后冷却,得到纯的粉末状硝酸钾。
以上是关于硝酸钾提纯的基本方法,它们的操作非常简单,而且提纯效果良好,通过这些方法能够轻松提取到高纯度的硝酸钾,从而满足需求。
同时,应该注意在操作时要严格控制好温度和pH值,以免影响提纯的效果。
此外,在提纯硝酸钾时,一定要重视安全因素,要使用安全的技术操作,确保提纯操作时的安全性。
总之,在提纯硝酸钾时,应当做
到技术全面、操作环境安全,以便能够提取到更高纯度的硝酸钾产品。

硝酸钾标准
嘿,朋友们!今天咱就来聊聊硝酸钾这玩意儿。
硝酸钾,你可别小看它呀!它就像是一个神奇的小精灵,在很多地方都能大显身手呢!
你想想看,在农业上,它可是肥料界的一把好手。
就好像是庄稼的好朋友,能给它们提供充足的养分,让庄稼长得壮壮的,结出满满的果实。
没有它,那地里的收成说不定就得大打折扣咯!
再说说工业领域,硝酸钾也是相当重要的角色呢!它就如同一个幕后英雄,默默地为各种工业制品的生产贡献着自己的力量。
还有啊,在一些特殊的领域,比如烟火制造,硝酸钾那可是不可或缺的呀!它能让烟花绽放出绚丽多彩的光芒,给我们带来视觉上的盛宴。
这就好比是一场魔法表演,而硝酸钾就是那个神奇的魔法道具。
不过呢,咱们可不能因为它用处大就掉以轻心啊!使用硝酸钾可得小心谨慎,就像走钢丝一样,得时刻保持警惕。
要是不小心用错了量或者用错了地方,那可就麻烦啦!这不就像是做菜,盐放多了或者放少了,味道可就差远了。
而且,咱们还得注意它的储存呀!不能随随便便找个地方就放,得放在合适的环境里,不然它可能就会发脾气,变得不稳定起来呢!这就好比是珍贵的宝贝,得好好保管才行。
咱中国有句老话说得好:小心驶得万年船。
对待硝酸钾,咱们就得有这样的态度。
可不能马马虎虎的,得认真对待它,发挥它最大的作用,同时又要避免可能出现的问题。
所以啊,大家要记住,硝酸钾虽好,但也得用得恰到好处。
只有这样,它才能真正成为我们的好帮手,为我们的生活和工作带来便利和惊喜。
别不当回事呀,朋友们!。

硝酸钾含量检测
硝酸钾(KNO3)是一种常见的无机化合物,通常用于作为肥料、火药和医药等。
硝酸钾可以通过多种方法进行检测,包括比色法、电化学法、质谱法和红外光谱法等。
比色法
比色法是一种快速且简单的检测硝酸钾含量的方法。
基本原理是利用硝酸钾在碱性条件下与N-(1-naphthyl)ethylenediamine二盐(NEDD)、苯磺酸氨基酚(BSP)、苯酚、对酞菁等试剂反应,形成易于观察的有色物质,并通过比色计或分光光度计测量吸收值计算硝酸钾含量。
电化学法
电化学法是一种利用电化学反应测量硝酸钾含量的方法。
常见的电化学法包括阴极极化法、阳极极化法和电化学检测法。
例如,可以利用电化学检测法,即加入硫酸铜电极和银电极,测量电流生成的峰值电流或导电度,计算硝酸钾含量。
质谱法
质谱法是一种利用分子的大小、形状和化学结构来测量硝酸钾含量的方法。
常见的质谱法包括原子吸收光谱法、等离子质谱法和质谱-质谱联用分析法。
例如,在等离子质谱法中,可以将样品气化成离子化的气态分子,利用高能带电粒子将离子打散,并测量气态离子的质量和分子数,计算硝酸钾的含量。
红外光谱法
红外光谱法是一种利用分子振动来测量硝酸钾含量的方法。
当分子受到电磁辐射作用时,就会发生振动和扭曲。
红外光谱法利用这一原理,通过测量分子在不同波长下的吸收情况,确定分子中各种官能团分子振动特征频率,从而确定硝酸钾的含量。
综上所述,检测硝酸钾含量的方法多种多样,可以根据实际需要选择合适的方法进行检测。
在实测过程中,应该注意样品的稳定性和准确性,以及仪器的精度和灵敏度,确保检测结果的可靠性。