甲烷乙烯乙炔的实验室制法
- 格式:pptx
- 大小:1.59 MB
- 文档页数:5


炔烃的知识点汇总————————————————————————————————作者:————————————————————————————————日期:CCHH HCCC F 3120o180O第四节 乙炔 炔烃●教学目的:1、 使学生了解乙炔的重要化学性质和主要用途。
2、 使学生了解乙炔的结构特征、通式和主要的性质。
3、培养学生的辨证唯物主义观。
●教学方法:探索推理法●教学重点:乙炔的化学性质。
●教学难点:乙炔的结构以及与化学性质的关系。
教学过程:[提问]对比乙烷、乙烯的结构,乙烯有一个双键,则氢原子数比乙烷少2个H 。
假设比C 2H 4再少2个H ,结构会怎样?应有一根三键。
(H —C ≡C —H )[结论]和烷烃相比,每有一个双键,氢原子就减少2个,每有一个三键,氢原子就减少4。
[提问] 设C n H m 分子中只有单双键,则该有多少个双键? 不饱和度: 222mn -+ == C 数+1—H 数/2, 如C 12H 12中最多有多少个双键?(7)一、乙炔的组成和结构:分子式:C 2H 2 电子式:结构式:H —C ≡C —H 结构简式:CH ≡CH [展示]乙炔的球棍模型:直线型,键角180°[例题] CH 3—CH==CH —C ≡C —CF 3分子结构的下列叙述中,正确的是( B C ) A 、6个碳原子有可能都在一条直线上B 、6个碳原子不可能都在一条直线上C 、6个碳原子都在同一平面上D 、6个碳原子不可能都在同一平面上 解析:该物质空间结构可表示为:注:该物质并不是所有原子均共面,如—CH 3中的3个氢原子,—CF 3中的3个氟原子均类CH 4中氢原子,是空间的。
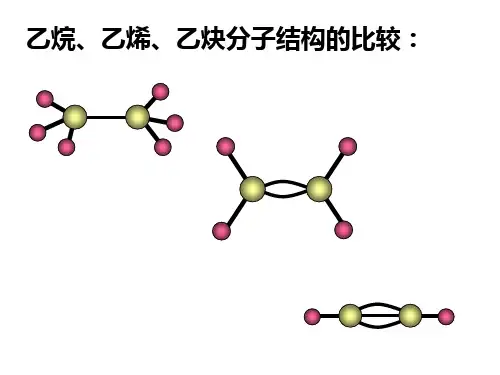
甲烷、乙烯、乙炔结构的比较 结构简式 CH 3—CH 3CH 2==CH 2 HC ≡CH 键角 109°28′(约) 120° 180° 碳碳键长(m ) 1.54×10--10 1.33×10--10 1.20×10--10碳碳键能(KJ/mol )384615812乙炔的键能812<3×384,也比C —C 单键和C==C 双键键能之和小,所以说明乙炔的C ≡C 中有两个键易断裂。





C C H HH CC C F 3120o 180O 第四节 乙炔 炔烃●教学目得:1、 使学生了解乙炔得重要化学性质与主要用途。
2、 使学生了解乙炔得结构特征、通式与主要得性质。
3、培养学生得辨证唯物主义观。
●教学方法:探索推理法●教学重点:乙炔得化学性质。
●教学难点:乙炔得结构以及与化学性质得关系。
教学过程:[提问]对比乙烷、乙烯得结构,乙烯有一个双键,则氢原子数比乙烷少2个H 。
假设比C 2H 4再少2个H ,结构会怎样?应有一根三键。
(H —C ≡C —H )[结论]与烷烃相比,每有一个双键,氢原子就减少2个,每有一个三键,氢原子就减少4。
[提问] 设C n H m 分子中只有单双键,则该有多少个双键?不饱与度:222m n -+ == C 数+1—H 数/2, 如C 12H 12中最多有多少个双键?(7) 一、乙炔得组成与结构: 分子式:C 2H 2 电子式:结构式:H —C ≡C —H 结构简式:CH ≡CH[展示]乙炔得球棍模型:直线型,键角180° [例题] CH 3—CH==CH —C ≡C —CF 3分子结构得下列叙述中,正确得就是( B C )A 、6个碳原子有可能都在一条直线上B 、6个碳原子不可能都在一条直线上C 、6个碳原子都在同一平面上D 、6个碳原子不可能都在同一平面上解析:该物质空间结构可表示为: 注:该物质并不就是所有原子均共面,如—CH 3中得3个氢原子,—CF 3中得3个氟原子均类CH 4中氢原子,就是空间得。
嗆赌駭強导養侶。
结构简式CH 3—CH 3 CH 2==CH 2 HC ≡CH 键角109°28′(约) 120° 180° 碳碳键长(m )1、54×10--10 1、33×10--10 1、20×10--10 碳碳键能(KJ/mol ) 384 615 812 乙炔得键能812<3×384,也比C —C 单键与C==C 双键键能之与小,所以说明乙炔得C ≡C 中有两个键易断裂。


一、甲烷的氯代(性质)有机化学基础实验专题一烃实验:取一个100mL 的大量筒(或集气瓶),用排水的方法先后收集20mLCH4和80mLCl2,放在光亮的地方(注意:不要放在阳光直射的地方,以免引起爆炸),等待片刻,观察发生的现象。
现象:大约3min 后,可观察到混合气体颜色变浅,气体体积缩小,量筒壁上出现油状液体,量筒内饱和食盐水液面上升,可能有晶体析出【会生成HCl,增加了饱和食盐水】解释:生成卤代烃二、石油的分馏(重点)(分离提纯)(1)两种或多种沸点相差较大且互溶的液体混合物,要进行分离时,常用蒸馏或分馏的分离方法。
(2)分馏(蒸馏)实验所需的主要仪器:铁架台(铁圈、铁夹)、石棉网、蒸馏烧瓶、带温度计的单孔橡皮塞、冷凝管、牛角管、锥形瓶。
(3)蒸馏烧瓶中加入碎瓷片的作用是:防止爆沸(4)温度计的位置:温度计的水银球应处于支管口(以测量蒸汽温度)(5)冷凝管:蒸气在冷凝管内管中的流动方向与冷水在外管中的流动方向下口进,上口出(6)用明火加热,注意安全三、乙烯的性质实验现象:乙烯使KMnO4酸性溶液褪色(氧化反应)(检验)乙烯使溴的四氯化碳溶液褪色(加成反应)(检验、除杂)乙烯的实验室制法:(1)反应原料:乙醇、浓硫酸(2)反应原理:CH3CH2OH CH2=CH2↑ + H2O副反应:2CH3CH2OH CH3CH2OCH2CH3 + H2OC2H5OH + 6H2SO4(浓)6SO2↑+ 2CO2↑+ 9H2O(3)浓硫酸:催化剂和脱水剂(混合时即将浓硫酸沿容器内壁慢慢倒入已盛在容器内的无水酒精中,并用玻璃棒不断搅拌)(4)碎瓷片,以防液体受热时爆沸;石棉网加热,以防烧瓶炸裂。
(5)实验中要通过加热使无水酒精和浓硫酸混合物的温度迅速上升到并稳定于170℃左右。
(不能用水浴)(6)温度计要选用量程在200℃~300℃之间的为宜。
温度计的水银球要置于反应物的中央位置,因为需要测量的是反应物的温度。

常见的官能团对应关系如:(1)卤代烃:卤原子(-X),X代表卤族元素(F,CL,Br,I);在碱性条件下可以水解生成羟基(2)醇、酚:羟基(-OH);伯醇羟基可以消去生成碳碳双键,酚羟基可以和NaOH反应生成水,与Na2CO3反应生成NaHCO3,二者都可以和金属钠反应生成氢气(3)醛:醛基(-CHO);可以发生银镜反应,可以和斐林试剂反应氧化成羧基。
与氢气加成生成羟基。
(4)酮:羰基(>C=O);可以与氢气加成生成羟基(5)羧酸:羧基(-COOH);酸性,与NaOH反应生成水,与NaHCO3、Na2CO3反应生成二氧化碳(6)硝基化合物:硝基(-NO2);(7)胺:氨基(-NH2). 弱碱性(8)烯烃:双键(>C=C<)加成反应。
(9)炔烃:三键(-C≡C-)加成反应(10)醚:醚键(-O-)可以由醇羟基脱水形成(11)磺酸:磺基(-SO3H)酸性,可由浓硫酸取代生成(12)腈:氰基(-CN)(13)酯: 酯(-COO-) 水解生成羧基与羟基,醇、酚与羧酸反应生成注: 苯环不是官能团,但在芳香烃中,苯基(C6H5-)具有官能团的性质。
苯基是过去的提法,现在都不认为苯基是官能团甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃)甲烷隔绝空气高温分解甲烷分解很复杂,以下是最终分解。
CH4→C+2H2(条件为高温高压,催化剂)甲烷和氯气发生取代反应CH4+Cl2→CH3Cl+HClCH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HClCHCl3+Cl2→CCl4+HCl (条件都为光照。
)实验室制甲烷CH3COONa+NaOH→Na2CO3+CH4(条件是CaO 加热)乙烯燃烧CH2=CH2+3O2→2CO2+2H2O(条件为点燃)乙烯和溴水CH2=CH2+Br2→CH2Br-CH2Br乙烯和水CH2=CH2+H20→CH3CH2OH (条件为催化剂)乙烯和氯化氢CH2=CH2+HCl→CH3-CH2Cl乙烯和氢气CH2=CH2+H2→CH3-CH3 (条件为催化剂)乙烯聚合nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂)氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n- (条件为催化剂)实验室制乙烯CH3CH2OH→CH2=CH2↑+H2O (条件为加热,浓H2SO4)乙炔燃烧C2H2+3O2→2CO2+H2O (条件为点燃)乙炔和溴水C2H2+2Br2→C2H2Br4乙炔和氯化氢两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl2乙炔和氢气两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6 (条件为催化剂)实验室制乙炔CaC2+2H2O→Ca(OH)2+C2H2↑以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式。
有机反应方程式书写(请注明反应条件)一、烷烃、烯烃、炔烃1.甲烷的实验室制法C2H5OHCH2=CH2↑+H2O2.甲烷燃烧CH4+2O2CO2+2H2O3.甲烷与氯气CH4+Cl2CH3Cl+HCl CH3Cl+Cl2CH2Cl2+HClCH2Cl2+Cl2CHCl3+HCl CHCl3+Cl2CCl4+HCl4.甲烷隔绝空气时高温分解CH4C+2H25.丁烷的裂解(两个方程式)C4H10CH4+C3H6 C4H10C2H4+C2H66.乙烯的实验室制法 CH3CH2OHCH2=CH2↑+H2O7.乙烯燃烧C2H4+3O22CO2+2H2O8.乙烯使溴水褪色CH2=CH2+ Br2→CH2 Br─CH2 Br9.乙烯与水在催化剂下反应CH2=CH2+H2OC2H5OH10.异戊二烯与溴1:1加成(3种产物,分别写三个方程式)11.异戊二烯与足量溴水反应12.乙烯的加聚13.乙烯与丙烯1:1加聚14.异戊二烯聚合15.苯乙烯与异戊二烯1:1加聚16.乙炔的实验室制法CaC2+2H2O CHCH↑+Ca(OH)217.乙炔与足量氢气反应CHCH+2H 2CH3 -CH318.乙炔的聚合19.由乙炔制备聚氯乙烯CHCH+HClCH2=CHCl二、苯及其同系物20.苯燃烧2C6H6+15O212CO2+6H2O21.苯与液溴反应22.甲苯的硝化反应23.苯与氢气反应24.甲苯与氯气的取代反应(2个方程式)(一个在铁的催化下,一个在光照下)25.甲苯与浓硝酸、浓硫酸反应三、卤代烃的性质26.溴乙烷的消去反应CH3CH2Br+NaOH CH2=CH2↑+NaBr+H2O27.溴乙烷的水解反应CH3-CH2-Br+ NaOH CH3-CH2-OH+NaBr28.氯苯与氢氧化钠水溶液反应29.2,3-二氯丁烷的消去反应四、醇的性质30.乙醇燃烧C2H5OH+3O22CO2+3H2O31.乙醇与钠反应2C2H5OH+2Na→2C2H5ONa+H2↑32.乙醇的催化氧化2C2H5OH+O22CH3CHO+2H2O33.乙醇与浓硫酸反应(两个方程式)CH3CH2OHCH2=CH2↑+H2O2CH3CH2OHCH3─CH2─O─CH2─CH3+H2O34.乙醇与乙酸反应C2H5OH+CH3COOHCH3COOC2H5+H2O35.乙二醇与钠反应36.乙二醇的催化氧化37.甘油与硝酸反应五、酚的性质38.苯酚与钠反应39.苯酚与氢氧化钠反应40.苯酚与浓溴水反应41.苯酚钠与二氧化碳反应42.苯酚与甲醛缩聚六、醛的性质43.乙醛与氢气反应CH3CHO+H2C2H5OH44.苯甲醛与足量氢气反应45.甲醛与新制氢氧化铜反应HCHO+4Cu(OH)2CO2+2Cu2O↓+3H2O46.乙醛与新制氢氧化铜反应CH3CHO+2Ag(NH3)2OHCH3COONH4+2Ag↓+3NH3+H2O47.甲醛与银氨溶液反应HCHO+4Ag(NH3)2OH(NH4)2CO3+2Ag↓+6NH3+2H2O48.乙二醛与银氨溶液反应七、羧酸的性质49.乙酸与钠反应2CH3COOH+2Na2CH3COONa+H2↑50.乙二酸与氢氧化钠反应51.甲酸与少量碳酸钠反应HCOOH+Na2CO3→HCOONa+ NaHCO352.甲酸与过量碳酸钠反应2HCOOH+Na2CO3→2HCOONa+CO2↑+H2O53.乙二酸与乙二醇两分子间脱去1份水54.乙二酸与乙二醇两分子间脱去2份水55.乙二酸与乙二醇缩聚56.对苯二甲酸与乙二醇缩聚57.乳酸(2-羟基丙酸)分子内脱去1份水,生成物能使溴水褪色58.2份乳酸分子间脱去1份水59.2份乳酸分子间脱去2份水60.乳酸的缩聚八、酯的性质61.乙酸乙酯酸性水解CH3COOC2H5+H2OCH3COOH+C2H5OH62.乙酸乙酯碱性水解CH3COOC2H5 +NaOHCH3COONa+C2H5OH63.油酸甘油酯酸性条件下水解64.硬脂酸甘油酯碱性条件下水解65.乙酸苯酯碱性条件下水解九、糖、蛋白质的性质66.葡萄糖与新制氢氧化铜反应67.葡萄糖的银镜反应68.由淀粉制乙醇(发酵法)C6H12O6C2H5OH+2CO2↑69.a-氨基乙酸(甘氨酸)与盐酸反应70.a-氨基乙酸(甘氨酸)与氢氧化钠反应71.a-氨基乙酸2分子间脱去1分子水72.a-氨基乙酸2分子间脱去2分子水73.a-氨基乙酸缩聚。