烯烃的亲电加成反应
- 格式:doc
- 大小:703.50 KB
- 文档页数:15
第五章第五章 烯属化合物的反应学习要求学习要求:1.熟悉亲电加成的反应历程。
掌握烯烃与HX、X2的加成反应,烯烃的硼氢化、溶剂汞化反应以及这些反应的立体化学。
2.熟悉马氏规律,能作理性解释。
3.熟悉烯烃的自由基取代及加成反应。
4.掌握氧化数概念。
5.了解亲核加成反应。
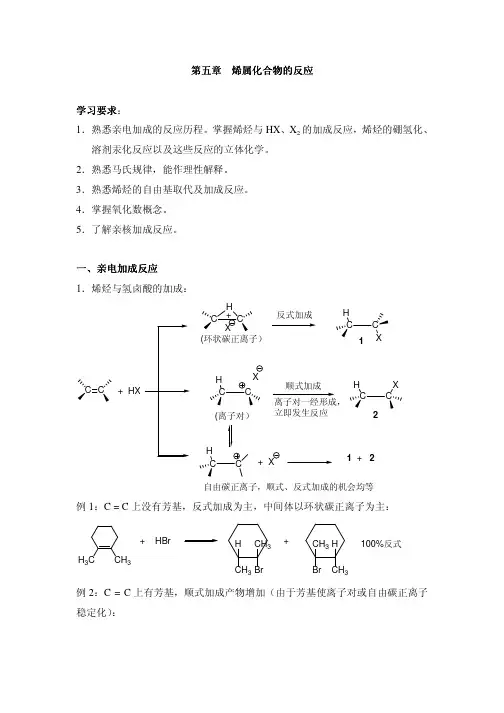
一、亲电加成反应1.烯烃与氢卤酸的加成:C C + HXC CH+X(环状碳正离子)反式加成CCHX1C CH X(离子对)立即发生反应C CH2CCH+ X1 + 2自由碳正离子,顺式、反式加成的机会均等例1:C = C上没有芳基,反式加成为主,中间体以环状碳正离子为主:H3C CH3+ HBr HCH3CH3Br+CH3BrHCH3100%反式例2:C = C上有芳基,顺式加成产物增加(由于芳基使离子对或自由碳正离子稳定化):C C C 6H 5CH 3+ DCl3Cl H6H 5DH H 3C H 3CH D C 6H 5H Cl+主产物赤式,顺式加成D C 6H 5H H H 3C H 3C HDCl C 6H 5H 次产物苏式,反式加成马尔科夫尼科夫规律:HX 和类似HX 的不对称亲核试剂中的负离子加到含氢少的双键碳上所得的产物是主产物。
CH 3CH = CH 2HBrCH 3CHCH 3BrCH 3+ DBrCH 3Br D H+CH 3Br D H反应服从Markovnikou 规律,这是由于H 首先亲电进攻形成碳正离子中间体,无论是环状碳正离子,紧密离子对或者自由碳正离子,较稳定的中间体的正电荷一定分布于或较多地分布于最能容纳正电荷的碳原子上。
这个碳原子往往是含氢较少的双键碳,分布于其上的正电荷能受到所连取代基的+C 、+I 稳定作用,亲电试剂的负离子将进攻它完成加成反应。
如果含氢较少的双键碳上连接有吸电基,它容纳正电荷的能力比含氢多的双键碳还小,当然导致相反的结果,得反马氏加成产物。
例如,CH 2 = CH-COOH + HX XCH 2CH 2COOH (X=Cl,Br,I)CH 2 = CH-N +(CH 3)3 + HIICH 2CH 2N +(CH 3)3CH 2 = CH-CF 3 + HBrCH 2Br-CH 2-CF 3HX 与一卤代乙烯的加成反应服从马氏规律:ClCH = CH 2+ HXCl-CH-CH 3X在氯乙烯分子中,氯原子的-I 〉+C 效应,当亲电剂进攻时,产生了动态共轭效应,加强了p-π共轭,使H 首先进攻含氢较多的双键碳原子,得马氏加成产物。

烯烃加成反应马氏规则
烯烃加成反应是有机化学中的一种重要反应,可以将两个分子中的烯烃与互补反应物加成生成新的化合物。
在这个过程中,马氏规则会起到重要的作用。
马氏规则指的是,在烯烃加成反应中,亲电试剂会优先加到具有最多氢原子的碳原子上。
这是因为在这种情况下,反应产生的中间体最为稳定,反应的能量也最低,因此具有最高的反应活性。
此外,马氏规则也可以解释为什么在一些烯烃加成反应中只会生成一种立体异构体。
这是因为在反应的过程中,亲电试剂只会加成到具有最多氢原子的碳原子上,而其他位置的碳原子则无法参与反应,因此只能生成一种立体异构体。
总之,马氏规则对于研究烯烃加成反应的机理和预测反应产物具有重要意义。
- 1 -。

烯烃加成反应一、催化加氢反应烯烃与氢作用生成烷烃的反应称为加氢反应,又称氢化反应。
加氢反应的活性能很大,即使在加热条件下也难发生,而在催化剂的作用下反应能顺利进行,故称催化加氢。
在有机化学中,加氢反应又称还原反应。
这个反应有如下特点:1.转化率接近100%,产物容易纯化,(实验室中常用来合成小量的烷烃;烯烃能定量吸收氢,用这个反应测定分子中双键的数目)。
2.加氢反应的催化剂多数是过渡金属,常把这些催化剂粉浸渍在活性碳和氢氧化铝颗粒上;不同催化剂,反应条件不一样,有的常压就能反应,有的需在压力下进行。
工业上常用多孔的骨架镍(又称Raney镍)为催化剂。
3.加氢反应难易与烯烃的结构有关。
一般情况下,双键碳原子上取代基多的烯烃不容易进行加成反应。
4.一般情况下,加氢反应产物以顺式产物为主,因此称顺式加氢。
下例反应顺式加氢产物比例为81.8%,而反式产物为18.2%。
产物顺反比例受催化剂、溶剂、反应温度等影响。
5.催化剂的作用是改变反应途径,降低反应活化能。
一般认为加氢反应是H2和烯烃同时吸附到催化剂表面上,催化剂促进H2的σ键断裂,形成两上M-H σ键,再与配位在金属表面的烯烃反应。
6.加氢反应在工业上有重要应用。
石油加工得到的粗汽油常用加氢的方法除去烯烃,得到加氢汽油,提高油品的质量。
又如,常将不饱和脂肪酸酯氢化制备人工黄油,提高食用价值。
7.加氢反应是放热反应,反应热称氢化焓,不同结构的烯烃氢化焓有差异。
例1.反应物:ΔHr/KJmol-1126.6 119.5 115.3例二.反应物:ΔHr/KJmol-1126.6 119.1 112.4各种甲基丁烯热力学能比较:每组的产物相同,吸收H2一样多,氢化焓反映了烯烃的含能量由此得出直链烯烃热力学能(E)-2-丁烯 <(Z)-2-丁烯 < 1-丁烯烯烃的热稳定性的一般规律:RCH=CHR' >RCH=CH2 > CH2=CH2R2C=CR2 > R2C=CHR > R2C=CH2 > RHC=CH2二、加卤素反应:烯烃容易与卤素发生反应,是制备邻二卤代烷的主要方法,丙烯通入液溴中即生成1,2一二溴丙烷:1.这个反应在室温下就能迅速反应,实验室用它鉴别烯烃的存在,(溴的四氯化碳溶液是红棕色,溴消耗后变成无色)。

烯烃的加成反应方程式汇总烯烃是一类含有碳-碳双键的有机化合物。
由于其双键的特殊性质,烯烃可以发生加成反应,即通过在碳-碳双键上添加原子团或官能团。
这种加成反应在有机合成中具有广泛的应用,可以用于构建碳骨架、合成药物、制备高分子材料等领域。
下面是一些常见的烯烃加成反应方程式的汇总。
1. 氢化反应(氢加成)烯烃可以与氢气发生反应,通过加成氢原子来饱和烯烃的双键,生成烃化合物。
例如,乙烯(C2H4)与氢气(H2)反应生成乙烷(C2H6):C2H4 + H2 -> C2H62. 水化反应(水加成)烯烃可以与水发生反应,通过加成水分子的氢和氢氧基团来饱和双键,生成醇化合物。
例如,乙烯与水反应生成乙醇:C2H4 + H2O -> C2H5OH3. 溴化反应(卤素加成)烯烃可以与卤素发生反应,通过加成卤素原子来饱和双键,生成卤代烷化合物。
例如,乙烯与溴反应生成1,2-二溴乙烷:C2H4 + Br2 -> CH2BrCH2Br4. 硝基化反应(亲电加成)烯烃可以与亲电试剂发生反应,通过加成正离子或正离子性片段来饱和双键,并引入新官能团。
例如,乙烯与亚硝酸钠反应生成硝基乙烷:C2H4 + NaNO2 -> CH3CH2NO25. 羰基化反应(亲核加成)烯烃可以与亲核试剂发生反应,通过加成亲核试剂的负离子或配位基团来饱和双键,生成含有羰基的化合物。
例如,乙烯与甲醛反应生成乙醇醛:C2H4 + CH2O -> CH3CHO6. 二元酸酐环化反应某些烯烃可以与二元酸酐发生反应,通过加成酐的羰基和羰基上的氧原子来饱和双键,生成环丙基酮化合物。
例如,1,3-丁二烯与醋酸酐反应生成环丙基丙酮:CH2=CH-CH=CH2 + (CH3CO)2O -> CH2=C(CH3)-C(CH3)=CH2O 以上,便是烯烃常见的加成反应方程式汇总。
这些加成反应不仅在有机化学研究中有重要应用,也在工业化学合成和药物生产中发挥着关键作用。


烯烯和环烯烃的亲电加成反应机理
介绍
烯烯和环烯烃的亲电加成反应,它是一种重要的有机过程,可以在便捷的实验
环境中合成一些价值昂贵的有机化合物。
烯烯和环烯烃的亲电加成反应一般以某一有机基团受烯烯或环烯烃作用而产生双烯会合物,从而获得更加有机富集的有机化合物。
这一反应在有机合成中被广泛应用,因此其反应机理极为重要。
一般烯烯和环烯烃的亲电加成反应可以归结为三个主要步骤,即电荷预处理、
双烯预处理和偶联反应:在电荷预处理步骤中,烯烯的电子实现催化作用,从而使有机基团获得正电荷;在双烯预处理步骤中,烯烯和环烯烃之间的亲电作用使双烯具有最大限度的活性;而在偶联反应步骤中,由于受其他分子的作用,烯烯和环烯烃双烯团可以得到新的结构,在双烯碳-碳键断裂的形成过程中,烯烯的受体基团
的正电荷可以引导氧原子的前位反应,从而使反应获得所需的活化能。
烯烯和环烯烃的亲电加成反应可以用来合成非常复杂的有机化合物,比如分子
内的催化剂、微观结构可控的有机颜料及光谱活性分子等,在生物学及药物化学等领域都有巨大的应用。
例如嵌段共聚物、量子点及量子线等,其受烯烯和环烯烃亲电加成反应的影响,可以用来调节其特性,进而用于新材料的研究和应用。
此外,由于各种有机受体基团的存在,烯烯和环烯烃的亲电加成反应可以生成不同的结构,可以合成用于研究有机物质之间各种化学作用的有机关联体,给许多新材料的合成提供有效的途径。
总之,烯烯和环烯烃的亲电加成反应是一种重要且多功能的反应,它在有机合
成中被广泛使用,具有重要的工程意义,被用于合成一些昂贵但有价值的有机化合物。
它的实际应用是基于它的反应机理,基于反应机理可以更好的理解该反应的各种特性,从而给有机合成过程带来更多的便捷性和有效性。

烯烃和卤代烃加成机理
烯烃与卤代烃的加成机理主要有两种:亲电加成和亲核加成。
在亲电加成中,溴分子在烯烃(或其他极性分子)的诱导下发生溴-溴单键的异裂,溴正离子与烯烃加成形成环溴鎓离子,接下来溴负离子再从环正离子后面进攻得到反式加成的产物。
这种加成可以代表大多数情况下的加成,机理是亲电加成,走的是环正离子中间体机理。
在亲核加成中,烯烃与溴的加成,溴原子是加在阿尔法碳上。
这种加成主要是碳正离子机理。
碳正离子机理主要是比较形成的碳正离子的稳定性,氢离子进攻双键后,可以形成两种碳正离子,一个是和苯环共轭的苄基碳正离子,一个是仲碳正离子。
显然苄基碳正离子更为稳定。
苄基碳正离子和溴离子结合,反应完毕。


烯烃亲电加成自由基加成共轭加成共轭烯烃物理性质的特点:1.红移2.易极化3.趋于稳定烯烃的反应:亲电加成:4种机理1.环正离子中间体机理:溴与烯烃的加成,溴鎓离子,主要产物为反式,苏型产物。
2.碳正离子中间体机理:顺式加成与反式加成皆有很大的机会。
3.离子对中间体机理:主要为顺式加成。
4.三中心过渡态机理:试剂的结构,反应的环境,过渡态的稳定性等等因素都会对机理的选择起影响。
马氏规则:碳碳双键与氢卤酸的加成主要产物为,卤素原子加到带有氢原子少的那一个上。
Notification:具体的特别情况仍然需要进一步的分析:借助电子效应,热力学上最稳定的那种产物,就是主要产物。
烯烃与硫酸,水,有机酸,醇和酚的反应:碳正离子机理,常常有重排产物,不采用。
与有机酸反应生成酯。
烯烃与次卤酸的加成:具体考虑机理之后,再去确定加成是顺式为主还是反式为主。
烯烃的自由基加成反应:反马氏加成Kharasch效应:过氧化物在光照条件下生成自由基。
(又名过氧化效应)书上只说了氢卤酸的kharasch效应,唯有HBr可行。
烯烃的氧化:环氧化反应:顺式加成,产物极其活泼,容易开环!;制取邻二醇:AcOH、H2O2与烯烃反应得到羟基酯,加热使其分解得到邻二醇。
高锰酸钾氧化:PH值对高锰酸钾的氧化能力有影响,需要校正PH值来引导反应方向。
特点:产率不高。
副产物极多!高锰酸钾(aq)用于烯烃的鉴别:注意:有干扰时,请慎用!现象:褪色,沉淀(MnO2)产生。
OsO4氧化烯烃:大量H2O2(低廉)和微量OsO4(昂贵)合作做氧化剂。
顺式加成。
烯烃的臭氧化-分解反应:臭氧氧化之后,得到的二级氧化产物在还原剂的庇护之下,生成两个羰基化合物用于对烯烃结构的推测:发挥想象,连接双键烯烃的硼氢化—氧化反应和硼氢化—还原反应:硼氢化:反马氏规则,顺式加成。
B2H6和烯烃反应生成烷基硼烷。
硼氢化—氧化反应:①碱性条件②底物为烷基硼③过氧化氢参与氧化反应生成硼酸酯(OH-为进攻离子)硼酸酯水解的到醇(ROH)与硼酸(B(OH)3)。

![[精彩]烯烃的化学性质](https://uimg.taocdn.com/4a29f60f54270722192e453610661ed9ad515515.webp)
烯烃的化学性质烯烃的化学性质很活泼,可以和很多试剂作用,主要发生在碳碳双键上,能起加成、氧化聚合等反应。
此外,由于双键的影响,与双键直接相连的碳原子(α-碳原子)上的氢(α-H)也可发生一些反应。
一.加成反应在反应中π键断开,双键上两个碳原子和其它原子团结合,形成两个σ-键的反应称为加成反应。
(一)催化加氢烯烃在催化剂作用下,低温低压既与氢加成生成烷烃。
(二)亲电加成在烯烃分子中,由于π电子具流动性,易被极化,因而烯烃具有供电子性能,易受到缺电子试剂(亲电试剂)的进攻而发生反应,这种由亲电试剂的作用而引起的加成反应称为亲电加成反应。
对电子具有亲和力的试剂叫做亲电试剂。
亲电试剂由于缺少电子,容易进攻反应物上带部分负电荷的位置,由这类亲电试剂进攻而发生发反应称为亲电反应。
亲电试剂通常为路易斯酸。
如:H+Br+、Cl+、H3O+、RC+=O、Cl2、Br2、I2、HCl、HBr、HOCl、H2SO4、F3C─COOH、BF3、AlCl3等烯烃的亲电加成反应历程烯烃的亲电加成反应历程可由实验证明RCH=CHR + H2RCH2CH2RCH2=CH2Br2NaCl(水溶液)CH2-CH2Br BrCH2-CH2CH2-CH2Br Cl Cl Cl无实验说明:1.与溴的加成不是一步,而是分两步进行的。
因若是一步的话,则两个溴原子应同时加到双键上去,那么Cl –就不可能加进去,产物应仅为1,2-二溴乙烷,而不可能有1-氯-2-溴乙烷。
但实际产物中竟然有1-氯-2-溴乙烷,没有1,2-二氯乙烷。
因而可以肯定Cl –是在第二步才加上去的,没有参加第一步反应。
2.反应为亲电加成历程溴在接近碳碳双键时极化成 ,由于带微正电荷的溴原子较带微负电荷的溴原子更不稳定,所以,第一步反应是Br δ+首先进攻双键碳中带微负电荷的碳原子,形成溴鎓离子,第二步负离子从反面进攻溴鎓离子生成产物(反面进攻的证明见P 142~144)。
第一步第二步在第一步反应时体系中有Na +、Br δ+,但Na +具饱和电子结构,有惰性,故第一步只有Br δ+参与反应,因而无1,2-二氯乙烷生成。
ch3co3h和烯烃反应机理烯烃是一类具有双键结构的碳氢化合物,它们具有较高的反应活性,容易与其他化合物发生反应。
而ch3co3h是一种强氧化剂,可以引发烯烃的氧化反应。
本文将介绍ch3co3h与烯烃反应的机理。
在ch3co3h与烯烃反应中,首先发生的是烯烃的亲电加成反应。
烯烃中的双键上的π电子云较为密集,具有较高的电子密度。
而ch3co3h具有正电荷的氧原子,是一种强亲电试剂。
当ch3co3h与烯烃接触时,氧原子的正电荷会与烯烃的π电子云发生作用,形成一个碳正离子和一个醇酸根阴离子。
这个过程是一个化学键的断裂和形成的过程,生成的产物是一个新的化合物。
接下来的反应步骤是醇酸根阴离子的亲核取代反应。
由于醇酸根阴离子具有负电荷,是一种强亲核试剂。
它会与碳正离子发生亲核取代反应,将自己的负电荷转移到碳上,同时断裂碳上的化学键。
这个过程中,醇酸根阴离子会取代掉碳上的一个基团,生成一个新的化合物。
在亲核取代反应中,醇酸根阴离子可以选择与碳上的各个基团发生反应,形成不同的产物。
这取决于烯烃的结构和ch3co3h的反应条件。
例如,当烯烃是一个顺式烯烃时,醇酸根阴离子会与烯烃的两个碳原子中的一个发生反应,生成一个新的化合物。
而当烯烃是一个反式烯烃时,醇酸根阴离子会与烯烃的两个碳原子都发生反应,生成两个新的化合物。
除了亲电加成和亲核取代反应,ch3co3h与烯烃还可以发生其他类型的反应。
例如,它们可以发生氧化反应,将烯烃中的碳原子上的氢原子氧化为羟基。
这个反应是一个氧化还原反应,需要有合适的条件和催化剂。
ch3co3h与烯烃反应的机理是一个复杂的过程,包括亲电加成、亲核取代和氧化等多种反应类型。
这些反应在有机合成中具有重要的应用价值,可以用来构建复杂的有机分子结构。
在实际应用中,研究人员可以根据不同的需要选择合适的反应条件和催化剂,来实现特定的反应目标。
烯烃加成反应方程式烯烃加成反应是有机化学中的一种基本反应类型,可以将烯烃的双键上加入新的原子或官能团,从而得到新的化合物。
烯烃加成反应可分为电子加成和亲核加成两种类型,其中电子加成反应中的加成剂为电子亲和能力较高的分子,亲核加成反应中则是亲核性较强的离子、小分子或分子中的原子。
1. 电子加成反应电子加成反应是指在烯烃双键上加成的试剂是亲电性分子,这种反应可分为乙烯化反应,狄尔斯-阿尔德反应和胺膦化反应。
乙烯化反应的方程式如下:C2H4 + HX → CH3CH2X其中X可为卤素如Br或I,也可为酸基如H2SO4或H3PO4等。
此反应以酸作为催化剂,发生在高温下。
狄尔斯-阿尔德反应的方程式如下:C4H6 + H2C=CHCO2Et →(CH2)5CO2Et其中C4H6和H2C=CHCO2Et分别为二烯和己二酰乙酯。
此反应以热或紫外线为反应条件,是一种非常重要的烯烃加成反应,可以合成环地平等的天然产物和药物。
胺膦化反应的方程式如下:C2H4 + R3P → CH3CH2PR3其中R为有机基团。
此反应以膦类化合物为试剂,发生在室温下。
胺膦化反应也可以被用于构建8、10和12元环化合物。
2. 亲核加成反应亲核加成反应是指在烯烃双键上加成的试剂是亲核性离子或分子,这种反应可分为羰基亲核加成反应、醇亲核加成反应和氮亲核加成反应等。
羰基亲核加成反应的方程式如下:C2H4 + RCOCH3 → CH3CH2COCH3其中RCOCH3为丙酮或其他α-羰基化合物。
此反应以酸或碱为催化剂,可以包括在很多合成中,例如酯合成、胆固醇合成等。
醇亲核加成反应的方程式如下:C2H4 + R-OH → CH3CH2-O-R其中ROH为醇类试剂。
此反应常以酸或碱为催化剂,可以用于合成乙醇、异丙醇等化合物。
氮亲核加成反应的方程式如下:C2H4 + H2NNH2 → CH3CH2NH2NH2其中H2NNH2为肼。
此反应常发生于暗中或在紫外线照射下,可以合成肼和氨。
烯烃加成反应方程式1. 引言烯烃是一类具有双键的碳氢化合物,由于其特殊的结构和性质,被广泛应用于有机合成、材料科学和生物化学等领域。
烯烃加成反应是一种常见的有机合成方法,通过在烯烃双键上添加其他原子或官能团,可以合成各种有机化合物。
本文将介绍烯烃加成反应的基本原理、常见的反应类型以及相关的反应方程式。
2. 烯烃加成反应的基本原理烯烃加成反应是指在双键上添加其他原子或官能团的化学反应。
这种反应通常以亲电试剂(如卤素、酸、醛、酮等)与双键发生加成为主要方式。
在亲电加成中,亲电试剂中的一个原子或官能团与双键形成共价键,同时另一个原子或官能团离开分子。
这样就实现了对双键上两个碳原子之间的连接进行改变或扩展。
3. 常见的烯烃加成反应类型3.1 烯烃与卤素的加成反应烯烃与卤素(如溴、氯)发生加成反应,生成相应的卤代烷化合物。
这种反应常用于合成有机化合物的起始步骤。
以下是一些典型的烯烃与卤素的加成反应方程式:1.1,2-二溴乙烷的合成:CH2=CH2 + Br2 → CH2BrCH2Br2.1,3-二氯丙烷的合成:CH3CH=CH2 + Cl2 → CH3CHC lCH2Cl3.2 烯烃与酸的加成反应烯烃与酸(如硫酸、盐酸等)发生加成反应,生成相应的酸化合物。
这种反应可以用于制备有机酸或中间体。
以下是一些典型的烯烃与酸的加成反应方程式:1.乙烯与硫酸的加成反应,生成乙醛:CH2=CH2 + H2SO4 → CH3CHO3.3 硼氢化物对于双键的还原和羟基代替硼氢化物(如NaBH4、LiAlH4)可以对烯烃中的双键进行还原,生成相应的醇化合物。
这种反应常用于合成醇或中间体。
以下是一些典型的硼氢化物对烯烃的加成反应方程式:1.乙烯与NaBH4的加成反应,生成乙醇:CH2=CH2 + NaBH4 → CH3CH2OH3.4 烯烃与其他亲电试剂的加成反应除了卤素、酸和硼氢化物,烯烃还可以与其他亲电试剂发生加成反应。
这些亲电试剂包括醛、酮、叠氮化物等。
不对称烯烃与亲电试剂的加成反应引言:不对称烯烃与亲电试剂的加成反应是有机化学中一类重要的反应,它能够在不对称合成中起到关键的作用。
本文将从反应机理、应用以及发展前景等方面对不对称烯烃与亲电试剂的加成反应进行探讨。
一、不对称烯烃与亲电试剂的反应机理不对称烯烃与亲电试剂的加成反应通常遵循亲电加成机理。
首先,亲电试剂通过与烯烃中的π电子形成共轭体系,形成中间体。
接下来,中间体经历质子化、重排或其他转化,形成最终的产物。
整个反应过程中,由于烯烃的不对称性,使得产物有可能呈现不对称结构,从而实现不对称合成的目的。
二、不对称烯烃与亲电试剂的应用不对称烯烃与亲电试剂的加成反应在有机合成中具有广泛的应用。
首先,该反应可以用于制备具有药物活性的天然产物和药物分子。
通过选择合适的烯烃和亲电试剂,可以实现高效的不对称合成,从而提高目标化合物的产率和立体选择性。
其次,该反应还可以用于合成手性配体和手性催化剂,这对于不对称催化反应具有重要意义。
此外,不对称烯烃与亲电试剂的加成反应还可应用于合成有机金属化合物、功能性材料等领域。
三、不对称烯烃与亲电试剂的发展前景随着有机合成方法学的不断发展和进步,不对称烯烃与亲电试剂的加成反应也在不断演化。
一方面,研究人员通过引入新型的烯烃和亲电试剂,不断扩展该反应的反应底物范围。
另一方面,通过设计和合成新型的手性配体和催化剂,提高不对称烯烃与亲电试剂的加成反应的立体选择性和产率。
此外,一些新颖的反应策略如不对称烯烃环化反应、不对称烯烃逆向加成等也为该领域的发展带来了新的机遇。
四、总结不对称烯烃与亲电试剂的加成反应是一类重要的有机合成方法。
通过研究该反应的机理、应用以及发展前景,我们可以看到其在不对称合成中的重要性和潜力。
未来的研究将继续探索新的反应底物和催化剂,以提高该反应的效率和立体选择性,从而为有机合成化学提供更多的可能性。
参考文献:[1] Trost B M, Van Vranken D L. Asymmetric addition of organometallic reagents to alkenes: aldol and allylation reactions [J]. Chemical Reviews, 1996, 96(8): 395-422.[2] Doyle M P, Duffy R, Ratnikov M, et al. A highly enantioselective route to chiral α-alkylated carbonyl compounds: catalytic asymmetric epoxidation followed by ring opening[J]. Journal of the American Chemical Society,1998, 120(11): 2637-2638.。
. . kszl 烯烃的亲电加成反应
烯烃的亲电加成反应 与烯烃发生亲电加成的试剂,常见的有下列几种:卤素(Br2,Cl2
)、无
机酸(H2SO4
,HCl,HBr,HI,HOCl,HOBr)及有机酸等。
1.与卤素加成 主要是溴和氯对烯烃加成。氟太活泼,反应非常激烈,放出大量的热,使烯烃分解,所以反应需在特殊条件下进行。碘与烯烃不进行离子型加成。
(1)加溴:在实验室中常用溴与烯烃的加成反应对烯烃进行定性和定量分析,如用5%溴的四氯化碳溶液和烯烃反应,当在烯烃中滴入溴溶液后,红棕色马上消失,表明发生了加成反应,一般双键均可进行此反应。
CH2=CH2+Br2→BrCH2CH2Br 卤素与烯烃的加成反应是亲电加成,反应机制是二步的,是通过环正离子过渡态的反式加成,主要根据以下实验事实:
(a)反应是亲电加成:是通过溴与一些典型的烯烃加成的相对反应速率了解的:
可以看到,双键碳上烷基增加,反应速率加快,因此反应速率与空间效应关系不大,与电子效应有关,烷基有给电子的诱导效应与超共轭效应,使双键电子云密度增大,烷基取代越多,反应速率越快,因此这个反应是亲电加成反 . . kszl 应。当双键与苯环相连时,苯环通过共轭体系,起了给电子效应,因此加成速率比乙烯快。当双键与溴相连时,溴的吸电子诱导效应超过给电子共轭效应,总的结果起了吸电子的作用,因此加成速率大大降低。
(b)反应是分二步的:如用烯烃与溴在不同介质中进行反应,可得如下结果:
上述三个反应,反应速率相同,但产物的比例不同,而且每一个反应中均有BrCH2CH2Br产生,说明反应的第一步均为Br+与CH2=CH2
的加成,同时这是
决定反应速率的一步;第二步是反应体系中各种负离子进行加成,是快的一步。(上述三个反应,如溴的浓度较稀,主要产物为溴乙醇和醚。)
(c)反应是通过环正离子过渡态的反式加成,而且是立体选择性的反应(stereoselectivereaction)。所谓环正离子过渡态,是试剂带正电荷或带部分正电荷部位与烯烃接近,与烯烃形成碳正离子,与烯烃结合的试剂上的孤电子对所占轨道,与碳正离子轨道,可以重叠形成环正离子,如
形成活性中间体环正离子,这是决定反应速率的一步。所谓反式加成,是试剂带负电荷部分从环正离子背后进攻碳,发生 SN
2反应,总的结果是试剂的
二个部分在烯烃平面的两边发生反应,得到反式加成的产物。如下所示: . . kszl 所谓立体选择性反应是指一个反应可能产生几个立体异构式(如顺式加成产物与反式加成产物),优先(但不是百分之一百)得到其中一个立体异构体(或一对对映体),这种反应称立体选择性反应(参看3.21,5)。上述溴与烯烃的加成,是立体选择的反式加成反应。
以上结果是通过很多实验事实总结得到的。如溴与(Z)-2-丁烯加成,得到>99%的一对苏型外消旋体:
如反应是顺式加成则得到以下产物: .
. kszl 实验结果,顺式加成得到的赤型产物<1%。因此溴与(Z)-2-丁烯的加成是通过环正离子过渡态的反式加成。
习题5-4写出溴与(E)-2-丁烯加成的反应机制、主要产物,并用费歇尔投影式表示,主要产物是苏型的还是赤型的?
下面列举溴与环己烯体系的加成反应: 溴与环己烯反应如下:
在环己烯(i)中,双键及其两个邻接的碳原子C-6,C-1,C-2,C-3在一个平面上,因此C-4,C-5在环平面的上面和下面,如(ii)所示。在加成反应中,为了易于表达,常把它写成半椅型构象如(iii)或(vii),(iii)与(vii)达成平衡。(iii)与Br2加成,首先得(iv),Br-从离去基团背后进攻C-1,得反式加成产物即具有双直键的二溴化物(v)(Br-C-C-Br四个原子排列是反式 . . kszl 共平面),Br-与(iv)中的C-1结合,是使构象最小的改变,即C-3,C-4,C-5,C-6的碳架改变最小,维持原来的椅型构象;如与C-2结合,要转变成另一椅型构象如(ix),这时需要能量较大。加成的最初产物是双直键的二溴化物(v),一旦生成后,很快地发生椅型-椅型的构象体互相转换,形成双平键的二溴化物(vi),(v)与(vi)达成平衡。一般化合物双平键构象稳定,占优势,但(v)与(vi)两种构象几乎相等,因为双直键的二溴化物有1,3-双直键的相互作用,但双平键的二溴化物中Br-C-C-Br为邻交叉型,有偶极-偶极的排斥作用,以上两种作用力能量几乎相等,互相抵消。(vii)同样也能发生加成反应得(ix),(ix)与(x)达成平衡。(iii)与(vii)能量是相等的,反应机会也是均等的,因此(v)与(ix)是等量的,(v)与(ix)均有光活性,总的结果,得到一对外消旋体。从这里可以了解:原料无光活性,反应产物也无光活性,即使产物有手性,但因得外消旋体而无光活性。
如溴与具有光活性的4-甲基环己烯进行加成反应结果如下: .
. kszl (i)有光活性,它的半椅型构象(ii)与(iii),由于(ii)中甲基类似平键,(iii)中甲基类似直键,因此平衡有利于(ii),主要由(ii)进行反应,经(iv),得有光活性的(v),(iii)反应仅得少量(vi),因此有光活性的反应物,可得有光活性的产物。
(vii)也有光活性,主要构象为(viii),与Br2
反应经(x)得有光活性
的(xi),也得少量(xii)。
如果用(RS)-4-甲基环己烯反应,主要得到一对由(v)与(xi)组成的外消旋体及少量由(vi)与(xii)组成的外消旋体。因此消旋的反应物,得到消旋的产物。
由于(i)、(vii)有光活性,反应后产生了新的手性碳,得到了不等量的非对映体,如(i)产生(v)与(vi),(vii)产生(xi)与(xii)。这种在手性因素制约下的化合物,被试剂作用产生新的手性碳原子所组成的不等量的两个光活异构体——非对映体,这是不对称合成,或称手性诱导合成的又一例子。这在3.21,5节中已进行了介绍。
习题5-5写出下列化合物与溴的加成产物。
习题5-6苯乙烯()在甲醇溶液中溴化,得到1-苯基-1,2-二溴乙烷及1-苯基-1-甲氧基-2-
溴乙烷,用反应机制说明。习题5-7 4-三级丁基环己烯在甲醇中溴化,得45∶55比例的两种化合物的混合物,分子式都是C11H21BrO,预言这两个产物的立体结构,并提出理由。
(2)加氯:氯对烯烃的加成反应,与溴一样,是亲电的、二步的、通过 . . kszl 环正离子过渡态的反式加成。但有少数例外,如与1-苯丙烯的加成反应,得如下结果:
可以看出,上述加成反应,溴以反式为主,而氯以顺式为主,不同的加成产物是与不同的反应机制有关。溴对1-苯丙烯的加成,主要通过环正离子过渡态,而氯对1-苯丙烯的加成,主要通过离子对过渡态或碳正离子过渡态。所谓离子对过渡态,即试剂与烯烃加成,烯烃的π键断裂形成碳正离子,试剂形成负离子,这两者形成离子对,这是决定反应速率的一步,π键断裂后,带正电荷的C——C键来不及绕轴旋转,与带负电荷的试剂同面结合,得到顺式加成产物:
所谓碳正离子过渡态,试剂首先离解成离子,正离子与烯烃反应成碳正离子,这是决定反应速率的一步,π键断裂后,C——C键可以自由旋转,然后与带负电荷的离子结合,这时结合就有两种可能,即生成顺式加成与反式加成两种产物:
那末为什么溴与1-苯丙烯加成,以反式为主,而氯与1-苯丙烯的加成以顺式为主,原因主要是通过不同的反应机制进行的,而根据哪一种反应机制反应, . . kszl 与试剂、底物的结构及溶剂均有关,与过渡态的势能即活性中间体的稳定性有关。中间体环正离子是由卤原子上孤电子对轨道与碳正离子轨道重叠形成的(参看5.4,1,(1)),环卤鎓离子具有弯曲键的三元环结构,且所带正电荷又在电负性较大的卤原子上,比较不稳定;但由于形成一个C——X共价键,且成环原子均为8电子构型,因此增加了环卤鎓离子的稳定性,故溴与氯对烯烃的加成一般均通过环正离子过渡态。但如果卤原子与碳正离子轨道重叠形成弱的C——X键,如下所示:
环正离子较不稳定,这时反应可以按离子对过渡态或碳正离子过渡态进行,其产物的比例也与相应活性中间体的稳定性有关。
溴原子比氯原子电负性小,体积大,溴原子的孤电子对轨道容易与碳正离子的p轨道重叠形成环正离子:
然后Br-在离去基团的背后进攻C-1,以反式产物为主。而氯原子电负性较大,提供孤电子对与碳正离子成键不如溴原子容易,在1-苯丙烯类化合物中,碳正离子的p轨道正好与苯环相邻,可以共轭,使正电荷分散而稳定,在此情况下,氯对烯烃的加成主要通过离子对过渡态及碳正离子过渡态,故产物以顺式为主:
此外,溶剂对产物比例也有影响,如溶剂的极性等等。 .
. kszl 总之,在一般条件下,溴、氯对烯烃的加成反应是通过环正离子过渡态的反式加成,只有在特定条件下,如底物为1-苯丙烯类化合物,溴加成仍以反式为主,而氯加成却以顺式为主。
碘与烯烃一般不发生反应,但氯化碘(ICI)或溴化碘(IBr)比较活泼,可定量地与碳碳双键发生反应,因此,利用这个反应,可以测定石油或脂肪中不饱和化合物的含量。不饱和程度一般用碘值来表示的。碘值的定义是:100g汽油或脂肪所吸收的碘量(克)。
2.与酸的加成 无机酸和强的有机酸都较易和烯烃发生加成反应,而弱的有机酸如醋酸、水、醇等只有在强酸催化下,才能发生加成反应。
(1)加卤化氢:一般用中等极性的溶剂如醋酸,它既可溶解烯烃,又可溶解卤化氢。体系中要避免有水,因水与烯烃在酸性条件下也能发生加成反应。卤化氢的反应性:HI>HBr>HCl。加成反应如下所示:
CH2=CH2+HI→CH3CH2
I
CH2=CH2+HBr→CH3CH2
Br
CH2=CH2+HCl→CH3CH2
Cl
(a)反应有立体选择性:加成反应一般得到以反式加成为主的产物:
(b)反应有区域选择性:卤化氢与不对称烯烃加成时,产物有两种可能: