自身免疫性胃炎研究进展(2020完整版)
- 格式:doc
- 大小:22.50 KB
- 文档页数:8

2020年慢性胃炎基层诊疗指南作者:中华医学会中华医学会杂志社中华医学会消化病学分会中华医学会全科医学分 会中华医学会《中华全科医师杂志》编辑委员会 消化系统疾病基层诊疗指南编写专家组一、概述(一)定义慢性胃炎(c h ro ni c gastritis)是由多种病因引起的胃黏膜慢性炎症或萎缩性病变。
本质是胃黏膜上皮反复受到损害使黏膜发生改变,最终导致不可逆的胃固有腺体的萎缩,甚至消失。
该病易反复发作,不同程度地影响患者生命质量。
(二)流行病学慢性胃炎是基层消化内科门诊最常见的疾病,大多数慢性胃炎患者缺乏典型临床表现,因此在自然人群中的确切患病率难以获得。
慢性胃炎发病率在不同国家与地区之间存在较大差异,其发病率与幽门螺杆菌(Hel i cobac t er pylo r i, Hp)感染的流行病学重叠[lJ,并随年龄增长而增加[2]。
(三)分类1.基千病因分类:分为Hp胃炎和非Hp胃炎。
病因分类有助千慢性胃炎的治疗 。
2. 基千内镜和病理诊断分类:分为萎缩性和非萎缩性两大类。
3. 基千胃炎分布分类:分为胃窦为主胃炎、胃体为主胃炎和全胃炎三大类。
胃体为主尤其伴有胃黏膜萎缩者,发生胃癌的风险增加;胃窦为主者胃酸分泌增多,发生消化性溃疡的风险增加。
4.特殊类型胃炎的分类:包括化学性、放射性、淋巴细胞性、肉芽肿性、嗜酸细胞性以及其他感染性疾病所致。
二、病因和发病机制(一)病因、诱因或危险因素1.H p感染:是慢性胃炎最主要的原因。
2.饮食和环境因素:进食过冷、过热以及粗糙、刺激性食物等不良饮食习惯。
3.自身免疫:自身免疫性胃炎在北欧多见,我国少有报道。
4.其他因素:胆汁反流、抗血小板药物、非笛体消炎药(NSAIDs)等药物、酒精等外在因素也是慢性胃炎相对常见的病因。
其他感染性、嗜酸性粒细胞性、淋巴细胞性、肉芽肿性胃炎和其他自身免疫性疾病累及所致的胃炎比较少见。
(二)发病机制1.H p感染:H p具有鞭毛,能在胃内穿过黏液层移向胃黏膜,其释放尿素酶分解尿素产生氨、分泌空泡毒素A等物质而引起细胞损害;细胞毒素相关基因蛋白能引起强烈的炎症反应;其菌体胞壁还可作为抗原诱导免疫反应。

单克隆抗体治疗自身免疫性疾病的研究进展一、本文概述自身免疫性疾病是一类由于免疫系统错误地攻击自身健康细胞和组织,而非外来病原体,导致的一系列疾病。
这类疾病的治疗一直是一个全球性的挑战,传统的免疫抑制药物往往无法精确识别并攻击异常的免疫细胞,同时还会抑制正常的免疫功能,增加感染和其他并发症的风险。
近年来,单克隆抗体(Monoclonal Antibodies,mAbs)的兴起为自身免疫性疾病的治疗带来了新的希望。
本文将对单克隆抗体在自身免疫性疾病治疗方面的研究进展进行全面的综述,分析单克隆抗体的制备技术、作用机制、临床应用以及面临的挑战,以期为未来单克隆抗体在自身免疫性疾病治疗中的进一步应用提供理论支持和实践指导。
二、单克隆抗体治疗自身免疫性疾病的基本原理单克隆抗体(Monoclonal Antibodies,mAbs)治疗自身免疫性疾病的基本原理在于利用其高度的特异性和亲和性,针对导致疾病发生的特定抗原或炎症介质进行精确打击。
自身免疫性疾病是一类由于免疫系统错误地将自身组织或细胞识别为外来威胁并进行攻击而导致的疾病。
单克隆抗体能够针对这些被错误识别的自身抗原,通过阻断其与相应免疫细胞的结合,从而抑制过度的免疫反应,减轻组织损伤和炎症。
在治疗过程中,单克隆抗体通过与目标抗原结合,形成抗原-抗体复合物,从而阻止抗原与免疫细胞的相互作用。
单克隆抗体还可以激活机体的免疫系统,促进免疫细胞的清除功能,进一步清除体内的自身抗原和炎症介质。
这种治疗方法的优势在于其高度的特异性和精准性,能够针对特定的抗原进行治疗,而不会影响其他正常的免疫反应。
目前,单克隆抗体已经广泛应用于多种自身免疫性疾病的治疗,如类风湿性关节炎、系统性红斑狼疮、多发性硬化症等。
通过深入研究单克隆抗体的作用机制和临床应用,我们可以为自身免疫性疾病的治疗提供更加有效和精准的方法。
未来,随着技术的不断发展和进步,单克隆抗体治疗有望在自身免疫性疾病领域发挥更大的作用,为更多的患者带来福音。

自身免疫性胃炎中西医研究进展
韩暄;党志博;赵丽萍
【期刊名称】《河南中医》
【年(卷),期】2014(34)10
【摘要】自身免疫性胃炎的诊断方法有消化内镜检查和实验室检查,实验室检查包括胃蛋白酶原检查、胃泌素检查和蛋白组学检测;治疗方法包括中医治疗和西医治疗,西医治疗方法有一般治疗、抗幽门螺杆菌治疗、加强黏膜的营养与保护治疗,中医治疗包含中药治疗、针灸治疗及其他外治疗法。
治疗应该综合考虑,选择科学、合理的个体化诊治方案。
【总页数】2页(P2063-2064)
【关键词】自身免疫性胃炎;消化内镜检查;胃蛋白酶原检查;胃泌素检查;蛋白组学检测;一般治疗;抗幽门螺杆菌治疗;加强黏膜的营养与保护治疗;中药治疗;针灸治疗;其他外治疗法
【作者】韩暄;党志博;赵丽萍
【作者单位】北京中医药大学;太原市第二人民医院
【正文语种】中文
【中图分类】R259.733
【相关文献】
1.自身免疫性胃炎研究进展 [J], 尹朝; 齐明; 王倩
2.自身免疫性疾病血液系统损害中西医研究进展 [J], 张之玲;欧林燕;吴金玉
3.自身免疫性胃炎的研究进展 [J], 刘佳;阳惠湘
4.免疫性不孕症中西医发病机制及治疗研究进展 [J], 刘卫丽;尹巧芝
5.中西医结合在免疫性肝病合并胃炎的临床效果及安全性 [J], 涂波;吴伟民
因版权原因,仅展示原文概要,查看原文内容请购买。

自身免疫性胃炎研究新进展发布时间:2022-12-10T03:15:59.939Z 来源:《医师在线》2022年8月16期作者:洪清艳[导读]自身免疫性胃炎研究新进展洪清艳(防城港市港口区人民医院;广西防城港538001)【摘要】自身免疫性胃炎属于免疫性疾病,发病机制尚不明确,诊断存在一定程度的困难,且该疾病也与其他的免疫性疾病之间存在较强的关联性。
通过认识并了解该疾病,能够为临床诊断、治疗自身免疫性胃炎提供参考价值,本文主要对自身免疫性胃炎的发病机制、临床表现、诊断方法、与其他免疫性疾病的关联性、治疗及随访等相关内容进行了综述。
【关键词】自身免疫性胃炎;病理特点;胃黏膜萎缩;综述自身免疫性胃炎常见于老年女性群体,其确切病因尚不明确,主要累及壁细胞,表现为胃底、胃体黏膜萎缩、胃窦黏膜正常等,会对患者机体健康及生活质量造成影响,可合并恶性贫血及其他免疫性疾病,同时还存在一定的癌变风险。
因此,临床医师需要提高对于自身免疫性胃炎的相关认识,以便在面对此病患者时能够做到正确诊断、科学治疗,进一步提高自身免疫性胃炎的诊断率,促进患者病情改善,使胃黏膜萎缩得以延缓。
但临床现阶段有关该疾病的相关研究报道较少,本文在现有文献资料的基础上对自身免疫性胃炎展开相关分析,现将相关内容综述如下。
1发病机制自身免疫性胃炎(autoimmune gastritis,AIG)又称A型胃炎,是一种渐进性的慢性炎性病变,会导致胃体底黏膜的泌酸腺萎缩和取代性化生,结果是胃酸减少或胃酸缺乏症[1]。
该病在女性中有着较高的发病率,且老年患者居多,该病是多种致病因素共同作用下所导致的,胃黏膜固有腺体减少、伴或不伴肠化生为该病的主要特征,存在癌变风险,而我国是胃癌高发国家,关注这一疾病对于减少胃癌的发生具有重要意义[2-3]。
但国内关于自身免疫性胃炎的相关报道较少,若能够掌握患者的临床病理学特征,可有效提升其检出率,避免误诊漏诊现象,从而尽早实施治疗,稳定患者病情,为预后提供保障[4]。

中屮中医药杂志(原中国医药学报)2021年2;j第36卷第2期CJTCMP,February 2021, Vol.36, No.2•869 -•临证经验•周斌微观辨证治疗自身免疫性胃炎经验莫方正\郭哲宇-,周斌2r北京中医药大学,北京100029; 2中国中医科学院广安门医院,北京100053)摘要:文章概述了 &身免疫性胃炎的临床特点,总结r周斌教授应丨n中医中药辨证治疗丨'丨»免疫性胃炎的临 床经验周斌教授提出先天®赋不足,脏腑发育+a,致使脾肾两虚,足木病的主要病因,治疗时强调从发病之初即补益脾肾,并贯穿疾病治疗的始终;同时根据现代胃镜及病理、血淸学等手段进行微观辨丨I丨•:,结合患荇不同的症状表现,微观辨证与宏观辨证相结合,精准治疗,从而冇效的治疗n a免疫n胃炎关键词:f丨身免疫性胃炎;周斌;微观辨证;经验C l i n i c a l experience o f Z H O U Bin i n t r e a t i n g autoimmune g a s t r i t i s based onmicroscopic syndrome d i f f e r e n t i a t i o nM O F a n g-z h e n g1,G U O Z h e-y u:,Z H O U B i n-('Beijing University o f C h i n e s e M e d i c i n e, Beijing 100029, C h i n a: "G u a n g'a n m e n Hospital, C h i n a A c a d e m y o fC h i n e s e M e d i c a l Sciences, Beijing 100053, C h i n a )A b s t r a c t:T h e article s u m m a r i z e s the clinical characteristics o f a u t o i m m u n e gastritis a n d the clinical e x p e r i e n c e o fprofessor Z H O U B i n in a p p l y i n g T C M dialectical therapy to a u t o i m m u n e gastritis. Professor Z H O U B i n pointed out that lack ofcongenital e n d o w m e n t a n d p o o r d e v e l o p m e n t o f viscera result in deficiency o f both spleen a n d kidney, w h i c h are the m a i n causeso f this disease. D u r i n g treatment, i t is e m p h a s i z e d that the spleen a n d k i d n e y sh o u l d be n o u r i s h e d f r o m the b e g i n n i n g o f the diseasea n d r u n t h r o u g h the treatment. Besides, the treatment s h o u l d reference the gastroscopy, histology, s e r u m m a r k e r s a n d differents y m p t o m s o f patients. T h e c o m b i n a t i o n o f m i c r o s c o p i c s y n d r o m e difTerentiation a n d m a c r o s c o p i c s y n d r o m e differentiationprovides precise treatment, thus effectively treating a u t o i m m u n e gastritis.K e y W O r d S I A u t o i m m u n e gastritis; Z H O U Bin: M i c r o s c o p i c s y n d r o m e differentiation; E x p e r i e n c e《胃炎的分类和分级——新悉尼系统》n i将慢性 胃炎根据病变部位的不同分为A型胃炎及B型胃炎,A 型胃炎即自身免疫性胃炎(a u t o i m m u n e gastrilis,A I G);相对于B型胃炎以胃窦病变为主要表现,A l(;病变部位 主要在胃体及胃底,而胃窦基本不受影响在我国传统中医学文献中,A1G尚无对应的中医病名,但根据 其症状体征,周斌教授认为本病当归于“痞病”“虚 劳”等范畴。

如对您有帮助,可购买打赏,谢谢
自身免疫性胃炎的病理和临床特点
导语:胃部是我们人体非常重要的一个器官,想要有健康的身体我们就必须拥有一个健康的胃,如果我们的胃部出现了问题,那么不但会给我们带来疼痛的
胃部是我们人体非常重要的一个器官,想要有健康的身体我们就必须拥有一个健康的胃,如果我们的胃部出现了问题,那么不但会给我们带来疼痛的感觉而且还容易影响到我们的消化,自身免疫性胃炎是胃部疾病里面的一种,很多朋友可能对于自身免疫性胃炎还不是很了解,下文我们介绍一下自身免疫性胃炎的病理和临床特点。
自身免疫性胃炎病理表现为胃体、胃底弥漫性萎缩,而胃窦黏膜基本正常。
内源性或外源性的各种有害因素均可引起胃黏膜损伤,壁细胞抗原释出,并致敏免疫细胞引起免疫反应,造成胃黏膜慢性炎症,继而通过体液免疫产生抗胃壁细胞抗体。
抗胃壁细胞抗体的靶器官为胃壁细胞H+-K+-ATP酶的α和β亚基,由于胃体腺体及胃壁细胞被破环,胃泌酸功能明显降低或无酸,并引起血清胃泌素水平反馈性升高。
主细胞的破坏可导致胃蛋白酶原Ⅰ减少。
胃酸缺乏影响铁的吸收,导致缺铁性贫血。
胃泌素可促进嗜铬细胞增生,嗜铬粒蛋白A水平升高,有可能发展为胃类癌。
胃底、胃体萎缩,可出现肠上皮化生或非典型增生,胃腺癌发生率升高。
部分患者可检出内因子抗体,其可分为“阻断”抗体(Ⅰ型)和“结合”抗体(Ⅱ型),前者与内因子结合后能阻断维生素B12与内因子形成复合物,以致维生素B12不能吸收,后者与内因子-维生素B12复合物结合阻碍它们在回肠中的吸收,最终导致恶性贫血。
此外,AIG还可伴发多种其他自身免疫性疾病。
在上面的文章里面我们强调了胃部对于我们人体的重要性,我们建预防疾病常识分享,对您有帮助可购买打赏。



自身免疫性胃炎的研究进展
杨格日乐;李艳梅;赵丽萍
【期刊名称】《内蒙古医科大学学报》
【年(卷),期】2022(44)1
【摘要】自身免疫性胃炎(autoimmune gastritis,AIG)临床少见,是一种器官特异性的自身免疫和炎症性疾病,组织病理学表现为胃底、胃体萎缩而胃窦不受累。
早期临床无特异性症状,目前无根治方法。
AIG患者随访主要关注胃黏膜萎缩程度及癌前病变。
我国尚缺乏AIG的系统研究,国外研究较多。
通过检索国内外相关文献对AIG及相关疾病最新研究进展作综述,以期为相关领域的研究提供新思路。
【总页数】6页(P82-87)
【作者】杨格日乐;李艳梅;赵丽萍
【作者单位】内蒙古医科大学;内蒙古医科大学附属医院消化内科;呼和浩特市第一医院消化内科
【正文语种】中文
【中图分类】R573.3
【相关文献】
1.自身免疫性糖尿病与自身免疫性甲状腺疾病中易感基因相关研究进展
2.自身免疫性糖尿病与自身免疫性甲状腺疾病中易感基因相关研究进展
3.雌激素对实验性自身免疫性脑脊髓炎免疫性保护机制的研究进展
4.药物性肝损伤、药物诱导性自身免疫性肝炎和自身免疫性肝炎鉴别诊断研究进展
5.自身免疫性胃炎中西医研究进展
因版权原因,仅展示原文概要,查看原文内容请购买。
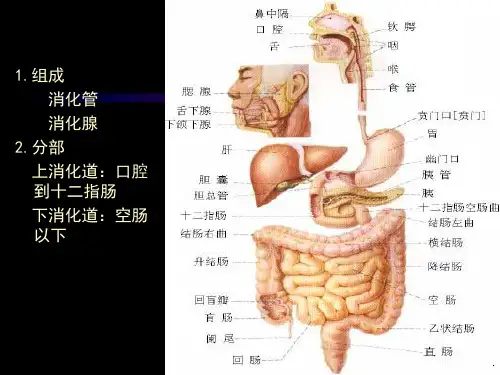

慢性萎缩性胃炎的诊断与随访(2020完整版)慢性萎缩性胃炎的诊断与随访(2020完整版)摘要慢性胃炎根据其内镜下表现及病理检查,分为萎缩性胃炎及非萎缩性胃炎,前者作为一种癌前疾病,在预防及筛查早期胃癌中都具有警示意义,应引起消化科医师的重视。
笔者从诱因、诊断、高风险人群识别及随访等方面对萎缩性胃炎有关内容进行了简述。
慢性胃炎系指由不同病因引起的各种慢性胃黏膜炎性病变。
其分类尚未统一,一般根据其病因、内镜所见、胃炎分布范围和胃黏膜病理变化等相关指标进行分类。
目前临床通常根据其内镜下表现及病理检查,分为萎缩性胃炎及非萎缩性胃炎两大类[1]。
胃癌在我国所有癌症中发病率高居第2位,而为我们所熟知的Correa级联学说中,即胃黏膜从非萎缩性胃炎、萎缩性胃炎、肠上皮化生、异型增生逐渐发展为胃癌的过程,萎缩性胃炎作为其中重要的一环,在预防及筛查早期胃癌中对我们具有警示意义。
为了帮助临床医师更好地认识慢性萎缩性胃炎这一癌前疾病,以下将从诱因、诊断、高风险人群识别及随访等方面对其有关内容作简述。
一、慢性萎缩性胃炎的诱因慢性萎缩性胃炎发生过程有多种因素共同起作用,在这其中幽门螺杆菌(Helicobacter pylori,Hp)感染扮演着至关重要的角色,然而Hp感染并非其发生的充分条件[2]。
此外,环境因素如高盐饮食、少吃蔬菜等对于萎缩性胃炎发生也同样具有促进作用,而在我国较为少见的自身免疫性胃炎则是因为抗壁细胞抗体的存在导致的。
1.Hp感染与慢性萎缩性胃炎:Hp感染与多种因素有关,如地域、人口种族和经济条件等,我国成人中Hp感染率高达40%~60%,且呈逐年下降趋势[3]。
已有许多研究提出Hp与胃癌发生有关。
Hp感染可通过诱发胃上皮的炎症反应,导致胃黏膜结构和功能受损,在胃癌发生中起始动作用[4]。
2018年美国的全基因组分析研究指出:高盐及缺铁等致癌微环境导致Hp菌株发生FurR88H基因突变,从而促进了Hp致癌[5]。
中医药治疗幽门螺旋杆菌感染性慢性胃炎研究进展【摘要】幽门螺旋杆菌感染性慢性胃炎是一种常见的胃部感染疾病,传统治疗方法存在着耐药性和不良反应等问题。
随着人们对中医药的认可度不断提高,越来越多的研究表明中医药在治疗幽门螺旋杆菌感染性慢性胃炎方面具有显著疗效。
本文综述了中医药治疗该疾病的理论基础、临床实践、疗效评价以及研究进展。
通过对中药复方、针灸等治疗方法的探讨发现,中医药在幽门螺旋杆菌感染性慢性胃炎的治疗中展现出了重要作用,并且有望成为未来治疗该疾病的重要选择。
研究认为,中医药对幽门螺旋杆菌感染性慢性胃炎具有显著疗效,有很大的发展前景,为该疾病的治疗提供了一种新的思路和方法。
【关键词】关键词:中医药、幽门螺旋杆菌、慢性胃炎、治疗、研究进展、临床实践、疗效评价、针灸、中药复方、疗效、发展前景。
1. 引言1.1 研究背景中国传统医学在治疗幽门螺旋杆菌感染性慢性胃炎方面具有悠久的历史和丰富的经验,有许多有效的治疗方法被不断探索和总结。
中医药治疗该疾病理论基础扎实,包括病因病机、辨证施治等方面有独特优势。
目前,针灸疗法、中药复方、中成药等多种中医药治疗方案在临床实践中被广泛采用,并取得了一定的疗效。
对于中医药治疗幽门螺旋杆菌感染性慢性胃炎的疗效评价、疗效机制等方面仍有待进一步研究和探讨,为了更好地推广中医药在这一领域的应用,有必要加强相关研究,深化理论探讨,完善临床实践,为慢性胃炎患者提供更有效的治疗方案。
1.2 研究目的本研究的目的是探讨中医药治疗幽门螺旋杆菌感染性慢性胃炎的疗效和机制,为临床提供更有效的治疗方案。
具体目的包括:一是总结当前幽门螺旋杆菌感染性慢性胃炎的诊疗现状,明确中医药在该疾病治疗中的地位和作用;二是分析中医药治疗幽门螺旋杆菌感染性慢性胃炎的理论基础和临床实践,探讨其疗效评价方法;三是归纳针灸治疗幽门螺旋杆菌感染性慢性胃炎的疗效评价研究进展,深入探讨中药复方治疗的优势和局限性;四是探讨中医药治疗本病的研究现状和趋势,为进一步深入开展相关研究提供参考。
最新《中国慢性胃炎诊治指南》解读:萎缩性胃炎癌变风险评估和监测慢性胃炎是最常见的消化系统疾病,不仅可引起各种消化不良症状,而且更重要的是其中的萎缩性胃炎存在发展为胃癌的潜在风险,因此受到医患双方重视,对症治疗、评估风险、降低癌变风险和定期内镜监测是慢性胃炎管理的主要措施。
中华医学会消化病学分会于2017年发布了《中国慢性胃炎共识意见(2017年,上海)》[1],对临床规范慢性胃炎的诊治起到了积极作用。
随着近年来相关研究证据的不断积累,慢性胃炎的诊治取得新进展,为此中华医学会消化病学分会组织相关专家对2017年慢性胃炎共识意见进行了更新,制定了《中国慢性胃炎诊治指南(2023年,上海)》(以下简称2023版胃炎指南)[2],现就2023版胃炎指南中有关萎缩性胃炎的癌变风险分层、内镜监测策略等内容作一解读。
一、萎缩性胃炎的胃癌发生风险和相关因素慢性萎缩性胃炎的主要病因是幽门螺杆菌感染,少数由自身免疫引起,与胃癌的发生关系密切。
一项长达15年的随访研究显示,幽门螺杆菌感染引发的胃癌的HR 为5.8,95%置信区间为2.7-15.3,而萎缩性胃炎导致的胃癌的HR达9.1,95%置信区间为2.9~30.0[3].胃癌患者的一级亲属罹患胃癌的风险是一般人群的2~10倍,胃癌患者的一级亲属中,幽门螺杆菌感染、慢性萎缩性胃炎和肠上皮化生的发生率均明显升高。
慢性萎缩性胃炎多数情况下病情较稳定,进展缓慢,但仍有一定癌变概率。
一项随访10年的研究显示,萎缩性胃炎、肠上皮化生的年胃癌发生率分别为0.1%、0.25%[4]o哪些萎缩性胃炎具有更高的病变进展、甚至癌变风险?对胃癌前病变的内镜随访研究表明,胃体部萎缩、肠上皮化生的病变进展比例较胃窦部高,提示胃体部癌前病变,尤其是肠上皮化生具有更高的病变进展风险[5]。
大量研究证实,萎缩性胃炎癌变风险与萎缩、肠上皮化生的范围和程度有关。
因此,针对慢性萎缩性胃炎,应根据萎缩、肠上皮化生的范围、程度,结合患者的年龄、幽门螺杆菌感染状态、胃癌家族史等综合评估胃癌发生风险。
自身免疫性胃炎研究进展(2020完整版)AIG的病因和发病机制尚不清楚,但已知与遗传、环境、免疫功能异常等因素有关。
一些研究表明,AIG与HLA-DQB1、HLA-DRB1、CTLA-4等基因的多态性有关[7]。
环境因素方面,Hp感染与AIG的发病有关,但并非所有AIG患者都有Hp感染,且Hp感染率下降而AIG发病率升高的趋势说明还存在其他环境因素[8]。
免疫功能异常是AIG发病的重要因素,AIG患者常伴有其他自身免疫性疾病,如自身免疫性甲状腺疾病、类风湿性关节炎等[9]。
此外,一些研究表明,AIG 与胃肠道微生物群落失衡有关[10]。
三、诊断AIG的诊断主要依靠血清标志物,如壁细胞抗体和内因子抗体,但这些标志物的阳性率不是很高。
一些研究显示,同时检测壁细胞抗体和内因子抗体的敏感性和特异性较高[11]。
内镜检查和活检可以发现胃黏膜萎缩等病变,但在AIG早期诊断中的阳性率较低。
一些研究表明,胃黏膜萎缩指数(GAIS)可以作为AIG早期诊断的指标之一[12]。
四、治疗AIG的治疗旨在改善胃黏膜萎缩和恶性贫血等症状,同时预防相关癌前病变的发生。
目前尚无特效治疗方法,常规治疗包括补充维生素B12、铁剂等,必要时行胃镜下黏膜下注射铁剂或胃黏膜切除术等手术治疗[13]。
此外,一些研究表明,胃肠道微生态调节剂和免疫抑制剂等也可能是AIG治疗的方向[14]。
总之,AIG的病理生理机制、自然史、相关癌前病变等仍需进一步研究,以更好地指导AIG的诊断和治疗。
AIG的发病机制和临床过程尚不十分清楚,但目前认为CD4+T细胞针对胃壁细胞分泌的H+/K+ATP酶产生自身免疫反应是主要原因之一,导致壁细胞破坏、泌酸黏膜受损、胃酸分泌减少或缺乏、胃黏膜萎缩,具体机制可能为Fas配体诱导的凋亡。
遗传易感性研究显示,AIG与特异性家族组织相容性单倍型,如HLA-DRB103、HLA-DRB104、HLA-B8和HLA-DR3相关。
万方数据万方数据万方数据自身免疫性胃炎诊治进展作者:田珂, 王晶桐, TIAN Ke, WANG Jingtong作者单位:北京大学人民医院消化内科,100044刊名:胃肠病学英文刊名:CHINESE JOURNAL OF GASTROENTEROLOGY年,卷(期):2010,15(9)参考文献(15条)1.Xiao SD;Jiang SJ;Hu YB Serum vitamin B12 levels and dual isotope test for vitamin B12 malabsorption in atrophic gastritis 1985(05)2.Wan Chan JC;Yu Liu HS;Sang Kho BC Pernicious anemia in Chinese:a study of 181 patients in a Hong Kong hospital 2006(03)3.De Block CE;De Leeuw IH;Van Gaal LF Autoimmune gastritis in type 1 diabetes:a clinically oriented review 2008(02)4.Torbenson M;Abraham SC;Boitnott J Autoimmune gastritis:distinct histological and immunohistochemical findings before complete loss of oxyntic glands[外文期刊] 2002(02)5.Hershko C;Ronson A;Souroujon M Variable hematologic presentation of autoimmunegastritis:agerelated progression from iron deficiency to cobalamin depletion[外文期刊] 2006(04)hner E;Annibale B Pernicious anemia:new insights from a gastroenterological point of view[期刊论文]-World Journal of Gastroenterology 2009(41)7.Presotto F;Sabini B;Cecchetto A Helicobacter pylori infection and gastric autoimmune diseases:is there a link[外文期刊] 2003(06)8.Amedei A;Bergman MP;Appelmelk BJ Molecular mimicry between Helicobacter pylori antigens and H+,K+--adenosine triphosphatase in human gastric autoimmunity[外文期刊] 2003(08)9.Ohana M;Okazaki K;Oshima C Inhibitory effects of Helicobacter pylori infection on murine autoimmune gastritis[外文期刊] 2003(08)10.De Block CE;De Leeuw IH;Bogers JJ Autoimmune gastropathy in type 1 diabetic patients withparietal cell antibodies:histological and clinical findings[外文期刊] 2003(01)11.De Block CE;De Leeuw IH;Rooman RP Gastric parietal cell antibodies are associated with glutamic acid decarboxylase-65 antibodies and the HLA DQAI*0501 DQB1*0301 haplotype in Type 1 diabetes mellitus.Belgian Diabetes Registry[外文期刊] 2000(08)12.Silveira PA;Baxter AG;Cain WE A major linkage region on distal chromosome 4 conferssusceptibility to mouse autoimmune gastritis 1999(09)13.Silveira PA;Wilson WE;Esteban LM Identification of the Gasa3 and Gasa4 autoimmune gastritis susceptibility genes using congenic mice and partitioned,segregative and interaction analyses[外文期刊] 2001(09)14.Osawa H Ghrelin and Helicobacter pylori infection[期刊论文]-World Journal of Gastroenterology 2008(41)15.Checchi S;Montanaro A;Pasqui L Serum ghrelin as a marker of atrophic body gastritis in patients with parietal cell antibodies[外文期刊] 2007(11)本文读者也读过(8条)1.萧树东.陆红如何诊断和治疗自身免疫性胃炎[期刊论文]-中华医学信息导报2007,22(22)2.王晶桐.刘玉兰.WANG Jingtong.LIU Yulan免疫介导消化系统疾病在我国的诊治现状以及今后发展方向[期刊论文]-胃肠病学2010,15(9)3.胡莹.久保木真.刘玉兰.HU Ying.KUBOKI Makoto.LIU Yulan丙型肝炎的自身免疫现象-鉴别诊断和治疗原则[期刊论文]-胃肠病学2010,15(10)4.姚宏.YAO Hong胃内分泌肿瘤研究新进展[期刊论文]-山西医药杂志2007,36(7)5.蒋蔚茹.钟良自身免疫性胃炎并发胃类癌一例诊断与治疗评析[期刊论文]-中华检验医学杂志2008,31(10)6.李晶.王晶桐.常山幸一.刘玉兰.LI Jing.WANG Jingtong.Koichi Tsuneyama.LIU Yulan自身免疫性肝损伤与非酒精性脂肪性肝病[期刊论文]-胃肠病学2010,15(9)7.李红明.钟德芳A型胃炎的治疗观察[期刊论文]-中国误诊学杂志2007,7(22)8.姚海红.栗占国.YAO Haihong.LI Zhanguo关注自身免疫性疾病的消化系统损害[期刊论文]-胃肠病学2010,15(9)引用本文格式:田珂.王晶桐.TIAN Ke.WANG Jingtong自身免疫性胃炎诊治进展[期刊论文]-胃肠病学 2010(9)。
2020年慢性胃炎基层诊疗指南作者:中华医学会中华医学会杂志社中华医学会消化病学分会中华医学会全科医学分 会中华医学会《中华全科医师杂志》编辑委员会 消化系统疾病基层诊疗指南编写专家组一、概述(一)定义慢性胃炎(c h ro ni c gastritis)是由多种病因引起的胃黏膜慢性炎症或萎缩性病变。
本质是胃黏膜上皮反复受到损害使黏膜发生改变,最终导致不可逆的胃固有腺体的萎缩,甚至消失。
该病易反复发作,不同程度地影响患者生命质量。
(二)流行病学慢性胃炎是基层消化内科门诊最常见的疾病,大多数慢性胃炎患者缺乏典型临床表现,因此在自然人群中的确切患病率难以获得。
慢性胃炎发病率在不同国家与地区之间存在较大差异,其发病率与幽门螺杆菌(Hel i cobac t er pylo r i, Hp)感染的流行病学重叠[lJ,并随年龄增长而增加[2]。
(三)分类1.基千病因分类:分为Hp胃炎和非Hp胃炎。
病因分类有助千慢性胃炎的治疗 。
2. 基千内镜和病理诊断分类:分为萎缩性和非萎缩性两大类。
3. 基千胃炎分布分类:分为胃窦为主胃炎、胃体为主胃炎和全胃炎三大类。
胃体为主尤其伴有胃黏膜萎缩者,发生胃癌的风险增加;胃窦为主者胃酸分泌增多,发生消化性溃疡的风险增加。
4.特殊类型胃炎的分类:包括化学性、放射性、淋巴细胞性、肉芽肿性、嗜酸细胞性以及其他感染性疾病所致。
二、病因和发病机制(一)病因、诱因或危险因素1.H p感染:是慢性胃炎最主要的原因。
2.饮食和环境因素:进食过冷、过热以及粗糙、刺激性食物等不良饮食习惯。
3.自身免疫:自身免疫性胃炎在北欧多见,我国少有报道。
4.其他因素:胆汁反流、抗血小板药物、非笛体消炎药(NSAIDs)等药物、酒精等外在因素也是慢性胃炎相对常见的病因。
其他感染性、嗜酸性粒细胞性、淋巴细胞性、肉芽肿性胃炎和其他自身免疫性疾病累及所致的胃炎比较少见。
(二)发病机制1.H p感染:H p具有鞭毛,能在胃内穿过黏液层移向胃黏膜,其释放尿素酶分解尿素产生氨、分泌空泡毒素A等物质而引起细胞损害;细胞毒素相关基因蛋白能引起强烈的炎症反应;其菌体胞壁还可作为抗原诱导免疫反应。
自身免疫性胃炎研究进展(2020完整版)摘要自身免疫性胃炎是一种由自身免疫功能异常所致的胃炎,临床较少见,主要表现为胃底胃体黏膜萎缩以及血清存在壁细胞抗体和内因子抗体。
虽然已经发现数年,但其病理生理机制、自然史、相关癌前病变等仍未研究清楚,部分患者甚至被误诊为难治性幽门螺杆菌感染。
本综述对自身免疫性胃炎的流行病学、发病机制、诊断及治疗进展进行了阐述。
自身免疫性胃炎(autoimmune gastritis, AIG),也称为A型胃炎,是一种由于自身免疫功能异常所致的胃炎。
主要表现为以胃体黏膜萎缩为主的胃炎,常伴有血和(或)胃液壁细胞抗体和(或)内因子抗体阳性,严重者因维生素B12缺乏而有恶性贫血表现。
以前常将其与恶性贫血一概而论,AIG可以被认为是恶性贫血的前期状态,约25%~40%的AIG患者发生恶性贫血[1]。
在西方国家,幽门螺杆菌(Helicobacter pylori, Hp)感染率逐渐下降,但同时伴随着AIG发病率逐渐升高。
AIG在我国尚缺乏系统化研究。
现对AIG的流行病学、发病机制、诊断及治疗进展进行综述。
一、流行病学因AIG在发病初期常无症状,且其诊断很多情况下无法通过内镜检查和活检确定,主要依靠血清标志物,因此AIG的确切发病率尚不清楚。
早期报道AIG好发于北欧老年女性。
美国研究资料显示,恶性贫血在60岁以上老年人中患病率约为2%,在老年女性可达4%~5%,且在非白人女性中发病率更高,发病更早[2]。
德国一项研究纳入9 949例50~74岁的健康体检人群,其中1 889例(19.5%)壁细胞抗体血清学阳性[3]。
亚洲AIG 发病率低于欧美。
国内在20世纪20—30年代逐渐出现了恶性贫血病例报道,自1962年Irvine和Markson发现恶性贫血患者血清中存在壁细胞抗体后,国内报道的数量有所增加[4,5],但尚缺乏大规模的流行病学调查研究。
北京大学第三医院一项历时8年的研究显示,门诊胃镜检查中AIG的年检出率为0.9%,年龄(60.6±12.3)岁,以女性为主[6]。
二、病因和发病机制AIG的发病机制及临床过程仍不十分清楚,目前认为是CD4+T细胞针对胃壁细胞分泌小管膜上的H+/K+ATP酶产生自身免疫反应,导致壁细胞破坏,泌酸黏膜受损,胃酸分泌减少或缺乏,胃黏膜萎缩。
具体机制可能为Fas配体诱导的凋亡[7]。
遗传易感性研究显示,AIG与特异性家族组织相容性单倍型,如HLA-DRB103、HLA-DRB104、HLA-B8和HLA-DR3相关[8]。
另有研究显示,37%的AIG患者胃黏膜组织IgG4+浆细胞显著增多,提示IgG4+浆细胞可能与AIG的发生相关[9]。
Hp感染是B型胃炎的常见致病因素,但其在A型胃炎发展进程中的作用尚不明确。
越来越多的证据表明Hp可能是自身免疫反应的感染性触发因素,急性Hp感染引起大量上皮细胞受损,从而引起H+/K+ATP酶暴露于抗原递呈细胞,在易感个体引起自身免疫反应。
另外,Hp蛋白肽含有与壁细胞质子泵相似的序列,通过分子模拟使CD4+T细胞交叉识别H+/K+ATP酶和各种Hp蛋白抗原,对它们同时产生免疫反应[10]。
研究显示,抗H+/K+ATP酶抗体存在于20%~30%的Hp感染者[11];约2/3的萎缩性胃体炎患者存在现症或既往Hp感染,此外,Hp阳性者比Hp 阴性者年龄小[12],均表明Hp感染与AIG发病相关。
但亦有研究报道,AIG患者Hp感染率更低[13]。
另外,在小鼠动物模型中Hp感染可以抑制AIG的发展[14]。
这种结论的矛盾和不确定性很可能与各项研究在Hp 感染的检测及认定上的差异有关。
多项研究显示组织学及酶免疫分析(enzyme immunoassay, EIA)Hp阴性的萎缩性胃体炎患者,免疫印迹阳性[15,16]。
Hp感染通常从胃窦开始,随着进展到胃体萎缩和胃酸分泌减少而消失,随年龄增长Hp感染率下降的趋势在研究中得到证实,AIG 患者Hp感染率从年轻时(<20岁)的88%下降到老年时(>60岁)的13%[17]。
因此,使用何种方法确定既往或现症Hp感染对AIG与Hp关系的研究具有重要意义。
另外,目前仍不清楚Hp是激活Th1细胞的始发因素,抑或只是伴随因素,尚需进一步研究。
三、组织病理学(一)大体和病理表现1.大体表现:早期胃黏膜无明显变化,随着萎缩进展,黏膜变薄,皱襞变平,可以看到小的结节(假息肉,增生性息肉,腺瘤性息肉,神经内分泌肿瘤)。
2.病理表现:主要特征是局限于胃体的萎缩性胃炎,伴不同程度的肠上皮化生、假幽门腺化生、胰腺腺泡化生、肠嗜铬样(enterochromaffin-like,ECL)细胞增生。
在泌酸腺完全消失前,出现以下组织学表现支持AIG的诊断:固有层弥漫性淋巴浆细胞深部浸润,灶状腺体浸润和破坏,嗜酸性粒细胞浸润,上皮化生,壁细胞假性肥大,黏膜肌增厚,ECL细胞线性或更高程度的增生[18,19]。
在无Hp感染史的患者,胃窦小凹增生(反应性炎症)可能与胃泌素分泌过多相关;当合并Hp感染时,胃窦会出现Hp感染相关胃炎的表现,包括萎缩和化生,胃体会出现活动性炎症。
此外,胃窦萎缩(全胃萎缩)的情况也见于自身免疫病或结缔组织病[20]。
(二)并发病变1.胃神经内分泌肿瘤(gastric neuroendocrine neoplasms,g-NENs):g-NENs较少见,但欧美各国统计结果显示其发病率呈上升趋势,美国SEER数据库显示1973到2012年g-NENs的发病率增加了15倍,年发病率约为0.45/10万[21]。
g-NENs分为4型,其中1型是由AIG引起,占70%~80%,约4%的AIG/恶性贫血患者存在由ECL细胞增生或异型增生形成的肿瘤[22]。
机体产生针对壁细胞的抗体,导致壁细胞数量减少,胃酸分泌减少,从而导致高胃泌素血症,进而刺激神经内分泌细胞增生,根据增生细胞的数量和病灶的大小分为线性增生(41%)、微小结节样增生(25%)、腺瘤样增生、异型增生、微小神经内分泌肿瘤等。
AIG患者的g-NENs通常较小(<1 cm),中位直径为5 mm,常表现为胃底、胃体息肉,65%为多发,复发率高,有丝分裂指数低,多数为G1级,无恶变潜能[23];>1 cm的g-NENs易出现转移,转移率约为7.6%~12%[24,25]。
与g-NENs进展相关的基因突变包括MEN1和REG 基因[26]。
2.增生性息肉、假性息肉、幽门腺腺瘤、腺癌:美国门诊胃镜检查患者中,1.3%患有增生性息肉,占所有胃息肉的15%~20%[27]。
AIG的增生性息肉更靠近近端、数量更多[28]。
当泌酸黏膜遭到破坏,残留的泌酸黏膜凸入胃腔,形成萎缩背景下散在的孤岛,谓之假性息肉。
幽门腺腺瘤较少见,2项关于幽门腺腺瘤的研究显示,约1/3来自AIG患者,30%的患者可能会转变为癌[29,30]。
因此,AIG被认为是癌前病变。
2012年,一个包含6项欧洲研究453例恶性贫血患者的Meta分析结果表明,恶性贫血患者胃癌的年发病率为0.27%,总体相对风险为6.8(95%CI 2.6~18.1)[31]。
但这些研究没有考虑Hp感染的因素。
多项研究表明,只有同时合并Hp感染、萎缩累及胃窦时,AIG患者胃癌的发生风险才会升高。
四、临床表现多数患者无特异性的胃部不适,多以血液学异常就诊,部分患者是以其他自身免疫病或神经系统症状等就诊。
缺铁性贫血是AIG患者最常见的血液学表现,可早于恶性贫血数年出现。
AIG患者缺铁性贫血是由于胃酸分泌减少或缺乏导致铁吸收障碍,内因子缺乏引起维生素B12吸收不良,导致恶性贫血和神经系统症状。
Hershko等[17]一项研究纳入160例AIG患者,其中83例存在缺铁性贫血,主要为女性,年龄比巨幼细胞性贫血患者要小20岁左右,且活动性Hp感染率更高。
一项包含150例难治性缺铁性贫血患者的研究显示,40例(27%)患有AIG[32]。
AIG常合并其他自身免疫病,如自身免疫性甲状腺炎、1型糖尿病、白癜风、Addison病、重症肌无力、自身免疫性肝炎等。
但其相互关系及致病机制尚不明确,可能为免疫交叉反应。
另有研究显示,AIG存在与其他自身免疫病相同的致病基因,AIG是自身免疫性多内分泌腺病综合征的一部分[33]。
一项研究纳入320例AIG患者,171例(53.4%)合并其他自身免疫病,其中116例(36.2%)患有自身免疫性甲状腺炎[34]。
1型糖尿病和自身免疫性甲状腺炎患者恶性贫血的发病率增加3~5倍;约1/3自身免疫性甲状腺炎患者以及5%~10%的1型糖尿病患者患有AIG[35,36]。
值得注意的是,恶性贫血患者不仅胃肿瘤发生率增高,小肠腺癌、食管鳞癌、胆管癌和血液系统恶性肿瘤发病率也增高[37]。
五、诊断AIG确诊主要依赖血清学、内镜检查和胃黏膜活检组织病理结果。
血清学检查包括:血液中存在壁细胞抗体和内因子抗体;泌酸腺的主细胞及颈黏液细胞受损,导致胃蛋白酶原Ⅰ下降,而胃窦腺体未受影响,胃蛋白酶原Ⅱ分泌正常,从而导致胃蛋白酶原Ⅰ/Ⅱ比值下降;胃泌素水平升高;维生素B12缺乏;缺铁性或巨幼细胞性贫血。
一项研究显示,胃蛋白酶原Ⅰ/Ⅱ比值敏感性最高,为96.1%,阴性预测值为97.7%,胃蛋白酶原Ⅰ特异性最高,为94.6%[38]。
壁细胞抗体存在于85%~90%的恶性贫血患者,内因子抗体的血清阳性率比壁细胞抗体低,约为60%,但内因子抗体的特异性更高[39]。
壁细胞抗体和内因子抗体水平与胃泌酸黏膜的萎缩程度显著相关。
血清胃促生长素(ghrelin)是1种非常有前景的预测胃黏膜萎缩的实验室指标,主要由胃泌酸黏膜的内分泌细胞产生,有报道称它预测胃黏膜萎缩的敏感性和特异性分别为97.3%和100%,优于胃蛋白酶原Ⅰ/Ⅱ比值和胃泌素[40]。
六、治疗和管理AIG尚无治愈方法。
疾病早期要预防维生素B12、叶酸及铁缺乏,缺乏者要进行补充。
补充维生素B12可以减轻巨幼细胞性贫血和改善神经系统症状,但无法阻止AIG的进程。
虽然Hp感染在AIG发病中的作用尚不完全清楚,但若检测到Hp感染,应根除。
免疫抑制剂如泼尼松龙能通过胃黏膜再生改善AIG病情,但停药后会复发[41]。
通过骨髓移植重建免疫系统被认为是有可能治愈AIG的途径[42]。
异体移植可治愈疾病,但受预处理毒性和移植排斥反应并发症的限制;自体移植毒性小,但疾病复发率高。
对于g-NENs,欧洲神经内分泌肿瘤协会推荐:<1 cm者可以随访观察或内镜下切除;>1 cm的g-NENs,应根据浸润深度和淋巴结转移情况,决定是内镜下切除还是外科手术切除[43]。
对于T2或切缘阳性的患者,可选择局部切除或胃大部切除。