CTD资料-合成部分
- 格式:pptx
- 大小:229.09 KB
- 文档页数:27
![阿托伐他汀钙片CTD格式模板资料[制剂]](https://uimg.taocdn.com/56627beef12d2af90342e678.webp)
CTD格式8号申报资料主要研究信息(药学部分:制剂)3.2.P.1 剂型选择依据及产品组成(1)本品为普通片剂,规格为:10mg每片XXXXX片的处方组成见表3.2.P.1。
附表3.2.P.1XXXXX片药物组成表(2)本品在制备过程中没有使用专用的溶剂。
(3)XXXXX片的内包装材料为铝塑板,有避光和防潮的作用,与XXXXX 的内包装材质相同。
内包材的生产厂家具有内包材注册证,执行国家标准。
3.2.P.2 产品开发XXXXX是HMG-CoA还原酶的一选择性、竞争性抑制剂,可以显著降低胆固醇水平,并降低心肌梗死或脑卒中的发病危险。
临床试验已经证实XXXXX 降低胆固醇的临床疗效明显优于其它汀类药物,对原发性高胆固醇血症、包括家族性高胆固醇血症或混合型高脂血症患者以及纯合子家族性高胆固醇血症者有明显疗效。
XXXXX(商品名)作为目前世界上顶级降血脂药物,由美国华纳-兰伯特公司研制开发。
1997年上市,之后并入辉瑞公司。
自1998年以来取得了优异的业绩,成为当今世界增长最快的药品,连续三年名列全球畅销处方药第一位,2003年全球销售92.3亿美元,2004年高达108.6亿美元。
华纳-兰伯特公司的XXXXX在1999年9月获准中国申请药品行政保护,在国内由XX辉瑞生产销售。
目前,国内原红惠制药(现更名嘉林药业)已获得XXXXX及片剂产品的生产批文,天方药业研制开发XXXXX胶囊,于2005年9月29日获得新药证书和药品注册批件。
我公司立项仿制XXXXX片,规格与辉瑞制药(XX)XX的XXXXX相同,为:10mg/片。
3.2.P.2.1 处方组成3.2.P.2.1.1 原料药性状:白色至类白色结晶性粉末。
溶解性:XXXXX不溶于PH≤4的水溶液,能微溶于蒸馏水、PH为7.4的磷酸盐缓冲液、乙腈,轻度微溶于乙醇,易溶于甲醇。
贮藏:遮光,密封保存。
有效期:48个月分子式:XXXXX分子量:XXXX化学名:XXXXXXXXXXXX英文名:Atorvastatin Calcium化学结构式:XXXXXXXXXXXX生产厂家:XXXXX批准文号:XXXXXX质量标准:药品注册标准YBH00262010原料检验:依据药品注册标准XXXX检测XXXX原料,有关物质图谱于参比制剂的有关物质图谱进行对比。

CTD资料模板(常用)资料来自:/download.do?method=list&class_id1=1,(整理:刘)目录CTD格式申报资料撰写格式(制剂) (1)CTD格式申报资料撰写格式(原料药) (2)CTD格式申报主要研究信息汇总表(制剂) (3)CTD格式申报主要研究信息汇总表(原料药) (14)化药综述资料(药学研究) (22)化药综述资料(药理毒理) (22)化药综述资料(立题目的与依据) (23)化药综述资料(主要研究结果的总结及评价) (23)化药综述资料(临床试验) (24)中药、天然药物综述资料(药学研究) (25)中药、天然药物综述资料(药理毒理) (26)中药、天然药物综述资料(临床试验) (27)中药、天然药物综述资料(主要研究结果的总结和评价) (28)化药制剂(说明书) (29)化药OTC说明书 (31)中药“生产现场检查用生产工艺”格式和内容 (33)中药生产现场检查用生产工艺的参考案例 (37)非大容量注射剂生产工艺信息表 (43)大容量注射剂生产工艺信息表 (44)CTD格式申报资料撰写格式(制剂)3.2.P.1 剂型及产品组成3.2.P.2 产品开发3.2.P.2.1 处方组成3.2.P.2.1.1 原料药3.2.P.2.1.2 辅料3.2.P.2.2 制剂3.2.P.2.2.1 处方开发过程3.2.P.2.2.2 制剂相关特性3.2.P.2.3 生产工艺的开发3.2.P.2.4 包装材料/容器3.2.P.2.5 相容性3.2.P.3 生产3.2.P.3.1 生产商3.2.P.3.2 批处方3.2.P.3.3 生产工艺和工艺控制3.2.P.3.4 关键步骤和中间体的控制3.2.P.3.5 工艺验证和评价3.2.P.4 原辅料的控制3.2.P.5 制剂的质量控制3.2.P.5.1 质量标准3.2.P.5.2 分析方法3.2.P.5.3 分析方法的验证3.2.P.5.4 批检验报告3.2.P.5.5 杂质分析3.2.P.5.6 质量标准制定依据3.2.P.6 对照品3.2.P.7 稳定性3.2.P.7.1 稳定性总结3.2.P.7.2 上市后的稳定性研究方案及承诺3.2.P.7.3 稳定性数据CTD格式申报资料撰写格式(原料药)3.2.S 原料药3.2.S.1 基本信息3.2.S.1.1 药品名称3.2.S.1.2 结构3.2.S.1.3 理化性质3.2.S.2 生产信息3.2.S.2.1 生产商3.2.S.2.2 生产工艺和过程控制3.2.S.2.3 物料控制3.2.S.2.4 关键步骤和中间体的控制3.2.S.2.5 工艺验证和评价3.2.S.2.6 生产工艺的开发3.2.S.3 特性鉴定3.2.S.3.1 结构和理化性质3.2.S.3.2 杂质3.2.S.4 原料药的质量控制3.2.S.4.1 质量标准3.2.S.4.2 分析方法3.2.S.4.3 分析方法的验证3.2.S.4.4 批检验报告3.2.S.4.5 质量标准制定依据3.2.S.5 对照品3.2.S.6 包装材料和容器3.2.S.7 稳定性3.2.S.7.1 稳定性总结3.2.S.7.2 上市后稳定性承诺和稳定性方案3.2.S.7.3 稳定性数据CTD格式申报主要研究信息汇总表(制剂)2.3.P.1 剂型及产品组成(1)说明具体的剂型,并以表格的方式列出单位剂量产品的处方组成,列明各成分在处方中的作用,执行的标准。


CTD格式申报资料撰写格式(制剂)3.2.P.1 剂型及产品组成3.2.P.2 产品开发3.2.P.2.1 处方组成3.2.P.2.1.1 原料药3.2.P.2.1.2 辅料3.2.P.2.2 制剂3.2.P.2.2.1 处方开发过程3.2.P.2.2.2 制剂相关特性3.2.P.2.3 生产工艺的开发3.2.P.2.4 包装材料/容器3.2.P.2.5 相容性3.2.P.3 生产3.2.P.3.1 生产商3.2.P.3.2 批处方3.2.P.3.3 生产工艺和工艺控制3.2.P.3.4 关键步骤和中间体的控制3.2.P.3.5 工艺验证和评价3.2.P.4 原辅料的控制3.2.P.5 制剂的质量控制3.2.P.5.1 质量标准3.2.P.5.2 分析方法3.2.P.5.3 分析方法的验证3.2.P.5.4 批检验报告3.2.P.5.5 杂质分析3.2.P.5.6 质量标准制定依据3.2.P.6 对照品3.2.P.7 稳定性3.2.P.7.1 稳定性总结3.2.P.7.2 上市后的稳定性研究方案及承诺3.2.P.7.3 稳定性数据二、申报资料正文及撰写要求3.2.P.1 剂型及产品组成(1)说明具体的剂型,并以表格的方式列出单位剂量产品的处方组成,列明各成分在处方中的作用,执行的标准。
如有过量加入的情况需给予说明。
对于处方中用到但最终需去除的溶剂也应列出。
(2)如附带专用溶剂,参照以上表格方式列出专用溶剂的处方。
(3)说明产品所使用的包装材料及容器。
Eg:3.2.P.2 产品开发提供相关的研究资料或文献资料来论证剂型、处方组成、生产工艺、包装材料选择和确定的合理性,具体为:3.2.P.2.1 处方组成3.2.P.2.1.1 原料药参照《化学药物制剂研究的技术指导原则》,提供资料说明原料药和辅料的相容性,分析与制剂生产及制剂性能相关的原料药的关键理化特性(如晶型、溶解性、粒度分布、吸湿性等)。
Eg:格列苯脲的粒度研究3.2.P.2.1.2 辅料说明辅料种类和用量选择的依据,分析辅料用量是否在常规用量范围内,是否适合所用的给药途径,(符合药用要求,注射剂辅料应符合注射液要求;不予主药发生不良相互作用;根据剂型选择必要的辅料)并结合辅料在处方中的作用分析辅料的哪些性质会影响制剂特性。

国食药监注〔2010〕 387 号附件:化学药品 CTD格式申报资料撰写要求CTD格式申报主要研究信息汇总表(原料药)基本信息药品名称原料药的中英文通用名、化学名构造原料药的构造式、分子式、分子量理化性质原料药的主要物理和化学性质:性状( 如外观,颜色,物理状态) ;熔点或沸点;比旋度,溶解性,溶液 pH, 分派系数,解离常数,将用于制剂生产的物理形态(如多晶型、溶剂化物、或水合物),生物学活性等。
生产信息生产商生产商的名称(必定要写全称)、地址以及生产场所的地址。
生产工艺和过程控制(1)工艺流程图:拜见申报资料3.2.S.2.2 (注明页码)。
(2)工艺描绘:按反响路线简述各步反响的反响种类(氧化、复原、代替、缩合、烃化、酰化等),各步反响的原料、试剂、溶剂和产物的名称,终产物的精制方法和粒度控制等;特别的反响条件(如高温、高压、深冷等)应说明。
详尽容拜见申报资料(注明页码)。
( 3)生产设施:拜见申报资料(注明页码)。
( 4)大生产的制定批量:kg( g) / 批。
物料控制生产用物料(如开端物料、反响试剂、溶剂、催化剂等)的质量控制信息(包含根源、质量标准等),拜见申报资料 3.2.S.2.3 (注明页码)。
要点步骤和中间体的控制列出全部要点步骤及其工艺参数控制围。
要点步骤确立依照拜见申报资料或(注明页码)。
中间体的质量控制拜见申报资料(注明页码)。
工艺考证和评论无菌原料药:工艺考证方案(编号: -- ,版本号: -- )和考证报告(编号: -- ,版本号: -- )拜见申报资料 3.2.S.2.5 (注明页码)。
其余原料药:工艺考证方案(编号: -- ,版本号: -- )和考证报告(编号: -- ,版本号: -- )拜见申报资料 3.2.S.2.5 (注明页码);或许,工艺考证方案(编号: -- ,版本号: -- )和批生产记录(编号: -- ,版本号: -- )样稿拜见申报资料 3.2.S.2.5 (注明页码),考证承诺书拜见申报资料 3.2.S.2.5 (注明页码)。

医药CRO化学药品各号申报资料的一般要求申报资料的一般要求为便于梳理与理解,在同一号资料中分为以下三种情形:A:新药报临B:新药报生产C:仿制药1号资料:A:包括通用名、商品名、化学名、英文名、汉语拼音,并注明其化学结构式、分子量、分子式等(见药审中心要求)。
如果是新剂型新命名、应附上药典委员会命名的复函B:同AC:同A外,需提供:国家标准(注:不允许申请商品名)2号资料:A:1、药品生产企业:“三证”(GMP与生产许可证的单位名称和生产地址一致)新药证书申请人:有效的营业执照、事业单位法人证书及其变更登记证明2、专利查询报告、不侵权保证书3、特殊药品:SFDA安监司的立项批件4、制剂用原料药的合法来源(一套)①直接向原料生产厂家购买:a、原料厂三证(三证与原料的批准证明文件的单位名称、地址必须一致)1、生产企业:营业执照、税务登记证、组织机构代码证、生产许可证(QS 证)(还需要产品第三方检测报告、出厂检测报告,产品执行标准等) 。
2、贸易型企业:营业执照、流通许可证(同时也需要提供所销售产品生产厂家的营业执照、生产许可证等)b、原料的批准证明文件(《药品注册批件》、《药品注册证》、统一换发文号的文件等)c、原料的质量标准及原料药出厂检验报告d、购货发票(赠送的,提供相关证明(赠送证明))e、购销合同或供货协议复印件f、自检报告书(全检)②向原料经销单位购买的:除需提供上述文件外,还需提供经销商与原料厂的供货协议新增:申报生产时,原料药如系通过赠送途径获得而未能提供该原料药合法来源证明和供货协议的,不批准③原料与制剂同时注册申请:原料和制剂厂不一致的,应提供原料和制剂厂之间的供货协议或合作开发协议(申报相同剂型的原料药来源不能是相同的原料药申请人)×A厂胶囊原料甲×B厂胶囊只能一对一,因此时的原料甲还未批准上市④使用进口原料的:略5、商标查询单或商标注册证(可推迟至报生产时提供)6、直接接触药品的包装材料和容器的包材证或受理通知单(2005版药典已将胶囊归为包材)7、委托试验:应提供委托合同,并附该机构合法登记证明、必要的资质证明。

国食药监注…2010‟ 387 号附件:化学药品CTD格式申报资料撰写要求23456CTD格式申报主要研究信息汇总表(制剂)2.3.P.5 制剂的质量控制2.3.P.5.1质量标准按下述表格方式提供质量标准。
如具有放行标准和货架期标准,应分别进行说明。
质量标准详细信息参见申报资料3.2.P.5.1(注明页码)。
2.3.P.5.2 分析方法列明各色谱方法的色谱条件:降解产物、残留溶剂、含量等。
列明溶出度检查的溶出条件、定量方法等。
分析方法详细信息参见申报资料3.2.P.5.2(注明页码)。
举例:列明各色谱方法的具体条件72.3.P.5.3分析方法的验证以表格形式逐项总结验证结果。
示例如下:有关物质方法学验证结果详细信息参见申报资料3.2.P.5.3(注明页码)。
举例含量测定方法学验证总结82.3.P.5.4 批检验报告三个连续批次(批号:)的检验报告参见申报资料3.2.P.5.4(注明页码)。
举例:2.3.P.5.5 杂质分析以列表的方式列明产品中可能含有的杂质。
示例如下:9杂质情况分析详细信息参见申报资料3.2.P.5.5(注明页码)。
2.3.P.5.6 质量标准制定依据质量标准制定依据参见申报资料3.2.P.5.6(注明页码)。
2.3.P.6 对照品药典对照品:来源、批号。
自制对照品:简述含量和纯度标定的方法及结果。
2.3.P.7 稳定性2.3.P.7.1稳定性总结(1)试验样品(2)研究内容10常规稳定性考察结果使用中产品稳定性研究结果2.3.P.7.2 上市后的稳定性承诺和稳定性方案详细信息参见申报资料3.2.P.7.2(注明页码)。
基于目前稳定性研究结果,拟定包装材料、贮藏条件和有效期如下:2.3.P.7.3 稳定性数据按以下例表简述研究结果,详细信息参见申报资料3.2.P.7.2(注明页码)。
说明:对于选用CTD格式提交申报资料的申请人,除按照“CTD 格式申报资料撰写要求”整理、提交药学部分的研究资料和图谱外,还应基于申报资料填写本表,并提交电子版。
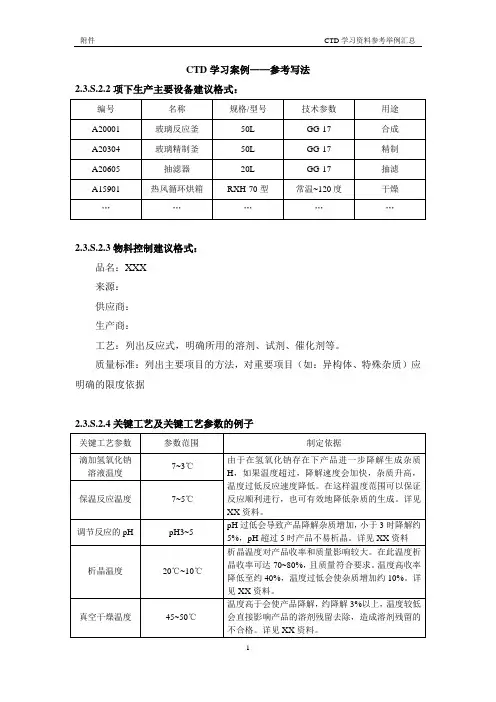
CTD学习案例——参考写法2.3.S.2.2项下生产主要设备建议格式:2.3.S.2.3物料控制建议格式:品名:XXX来源:供应商:生产商:工艺:列出反应式,明确所用的溶剂、试剂、催化剂等。
质量标准:列出主要项目的方法,对重要项目(如:异构体、特殊杂质)应明确的限度依据2.3.S.2.4关键工艺及关键工艺参数的例子2.3.S.2.4中间体控制的例子:合成中间体A2的质量标准合成中间体A3的质量标准2.3.S.2.5工艺验证和评价建议格式:XX工艺验证方案编号:XX,版本号:XX;XX工艺验证方案编号:XX,版本号:XX;验证的时间:2013年X月X日至X月X日,地点:在X厂X车间,批号:XX,批量:X kg/批关键工艺参数的验证:评价指标:空白批记录:结论:2.3.S.2.6生产工艺的开发建议格式:工艺开发过程中生产工艺的主要变化:2.3.S.4.1质量标准比较举例:质量比较:列表说明不同过程样品质量比较。
2.3.P.3.3主要生产设备参考表格2.3.P.3.4举例##口腔崩解片:采用直接压片工艺2.3.P.3.5工艺验证小结举例工艺验证情况小结:2010年3月30日——4月1日在本公司九车间进行三批卡培他滨片(批号**,**,**)的工艺验证,批量为3.5万片,对预混制粒工序(混合时间和混合均匀性)、烘干工序(不同烘干时间的水分检测)、总混工序(混合时间、水分、堆密度和休止角)、压片工序(压片过程中片重差异、硬度、溶出度、脆碎度的监测)、包衣工序(包衣后样品的溶出度)、铝塑包装工序等工艺步骤进行验证。
结果显示各工艺参数监测均符合要求,生产过程中无偏差,按照此工艺条件生产的三批样品的各项检验结果符合要求。
2.3.P.5.4批检验报告举例3.2.P.7.2稳定性方案参考举例表3.2.P.7.2.X 上市后生产产品的稳定性试验方案表3.2.P.7.2.X 上市后生产产品的稳定性试验方案*1:12、24、36月时检测。

CTD格式申报资料撰写要求(原料药)一、目录3.2.S 原料药3.2.S.1 基本信息3.2.S.1.1 药品名称3.2.S.1.2 结构3.2.S.1.3 理化性质3.2.S.2 生产信息3.2.S.2.1 生产商3.2.S.2.2 生产工艺和过程控制3.2.S.2.3 物料控制3.2.S.2.4 关键步骤和中间体的控制3.2.S.2.5 工艺验证和评价3.2.S.2.6 生产工艺的开发3.2.S.3 特性鉴定3.2.S.3.1 结构和理化性质3.2.S.3.2 杂质3.2.S.4 原料药的质量控制3.2.S.4.1 质量标准3.2.S.4.2 分析方法3.2.S.4.3 分析方法的验证3.2.S.4.4 批检验报告3.2.S.4.5 质量标准制定依据3.2.S.5 对照品3.2.S.6 包装材料和容器3.2.S.7 稳定性3.2.S.7.1 稳定性总结3.2.S.7.2 上市后稳定性承诺和稳定性方案3.2.S.7.3 稳定性数据二、申报资料正文及撰写要求3.2.S.1 基本信息3.2.S.1.1药品名称提供原料药的中英文通用名、化学名,化学文摘(CAS)号以及其它名称(包括国外药典收载的名称)。
3.2.S.1.2 结构提供原料药的结构式、分子式、分子量,如有立体结构和多晶型现象应特别说明。
3.2.S.1.3 理化性质提供原料药的物理和化学性质(一般来源于药典和默克索引等),具体包括如下信息:性状(如外观,颜色,物理状态);熔点或沸点;比旋度,溶解性,溶液pH, 分配系数,解离常数,将用于制剂生产的物理形态(如多晶型、溶剂化物、或水合物),粒度等。
3.2.S.2 生产信息3.2.S.2.1生产商生产商的名称(一定要写全称)、地址、电话、传真以及生产场所的地址、电话、传真等。
3.2.S.2.2 生产工艺和过程控制(1)工艺流程图:按合成步骤提供工艺流程图,标明工艺参数和所用溶剂。
如为化学合成的原料药,还应提供其化学反应式,其中应包括起始原料、中间体、所用反应试剂的分子式、分子量、化学结构式。

CTD格式申报资料撰写要求(原料药)一、目录3.2.S 原料药3.2.S.1 基本信息3.2.S.1.1 药品名称3.2.S.1.2 结构3.2.S.1.3 理化性质3.2.S.2 生产信息3.2.S.2.1 生产商3.2.S.2.2 生产工艺和过程控制3.2.S.2.3 物料控制3.2.S.2.4 关键步骤和中间体的控制3.2.S.2.5 工艺验证和评价3.2.S.2.6 生产工艺的开发3.2.S.3 特性鉴定3.2.S.3.1 结构和理化性质3.2.S.3.2 杂质3.2.S.4 原料药的质量控制3.2.S.4.1 质量标准3.2.S.4.2 分析方法3.2.S.4.3 分析方法的验证3.2.S.4.4 批检验报告3.2.S.4.5 质量标准制定依据3.2.S.5 对照品3.2.S.6 包装材料和容器3.2.S.7 稳定性3.2.S.7.1 稳定性总结3.2.S.7.2 上市后稳定性承诺和稳定性方案3.2.S.7.3 稳定性数据二、申报资料正文及撰写要求3.2.S.1 基本信息3.2.S.1.1药品名称提供原料药的中英文通用名、化学名,化学文摘(CAS)号以及其它名称(包括国外药典收载的名称)。
3.2.S.1.2 结构提供原料药的结构式、分子式、分子量,如有立体结构和多晶型现象应特别说明。
3.2.S.1.3 理化性质提供原料药的物理和化学性质(一般来源于药典和默克索引等),具体包括如下信息:性状(如外观,颜色,物理状态);熔点或沸点;比旋度,溶解性,溶液pH, 分配系数,解离常数,将用于制剂生产的物理形态(如多晶型、溶剂化物、或水合物),粒度等。
3.2.S.2 生产信息3.2.S.2.1生产商生产商的名称(一定要写全称)、地址、电话、传真以及生产场所的地址、电话、传真等。
3.2.S.2.2 生产工艺和过程控制(1)工艺流程图:按合成步骤提供工艺流程图,标明工艺参数和所用溶剂。
如为化学合成的原料药,还应提供其化学反应式,其中应包括起始原料、中间体、所用反应试剂的分子式、分子量、化学结构式。

CTD格式申报资料(原料药) CTD 格式申报资料撰写要求(原料药)一、目录原料药基本信息药品名称结构理化性质生产信息生产商生产工艺和过程控制物料控制关键步骤和中间体的控制工艺验证和评价生产工艺的开发特性鉴定结构和理化性质杂质原料药的质量控制质量标准分析方法分析方法的验证批检验报告质量标准制定依据对照品包装材料和容器稳定性稳定性总结上市后稳定性承诺和稳定性方案稳定性数据二、申报资料正文及撰写要求基本信息药品名称提供原料药的中英文通用名、化学名,化学文摘(CAS )号以及其它名称(包括国外药典收载的名称) 。
结构提供原料药的结构式、分子式、分子量,如有立体结构和多晶型现象应特别说明。
理化性质提供原料药的物理和化学性质 (一般来源于药典和默克索引等) , 具体包括如下信息:性状 (如外观,颜色,物理状态 ) ;熔点或沸点;比旋度,溶解性,溶液 pH, 分配系数,解离常数, 将用于制剂生产的物理形态(如多晶型、溶剂化物、或水合物) ,粒度等。
生产信息生产商生产商的名称(一定要写全称) 、地址、电话、传真以及生产场所的地址、电话、传真等。
生产工艺和过程控制(1)工艺流程图:按合成步骤提供工艺流程图,标明工艺参数和所用溶剂。
如为化学合成的原料药, 还应提供其化学反应式, 其中应包括起始原料、中间体、所用反应试剂的分子式、分子量、化学结构式。
(2)工艺描述:按工艺流程来描述工艺操作,以注册批为代表,列明各反应物料的投料量及各步收率范围,明确关键生产步骤、关键工艺参数以及中间体的质控指标。
(3)生产设备:提供主要和特殊设备的型号及技术参数。
(4)说明大生产的拟定批量范围。
物料控制按照工艺流程图中的工序,以表格的形式列明生产中用到的所有物料(如起始物料、反应试剂、溶剂、催化剂等) ,并说明所使用的步骤。
示例如下:物料控制信息提供以上物料的质量控制信息, 明确引用标准, 或提供内控标准 (包括项目、检测方法和限度) ,并提供必要的方法学验证资料。
CTD格式模板资料(制剂)CTD格式申报资料撰写格式(制剂)剂型及产品组成产品开发处⽅组成原料药辅料制剂处⽅开发过程制剂相关特性⽣产⼯艺的开发包装材料/容器相容性⽣产⽣产商批处⽅⽣产⼯艺和⼯艺控制关键步骤和中间体的控制⼯艺验证和评价原辅料的控制制剂的质量控制质量标准分析⽅法分析⽅法的验证批检验报告杂质分析质量标准制定依据对照品稳定性稳定性总结上市后的稳定性研究⽅案及承诺稳定性数据CTD格式8号申报资料主要研究信息(药学部分:制剂)剂型选择依据及产品组成(1)本品为普通⽚剂,规格为:10mg每⽚XXXXX⽚的处⽅组成见表。
附表XXXXX⽚药物组成表(2)本品在制备过程中没有使⽤专⽤的溶剂。
(3)XXXXX⽚的内包装材料为铝塑板,有避光和防潮的作⽤,与XXXXX的内包装材质相同。
内包材的⽣产⼚家具有内包材注册证,执⾏国家标准。
产品开发XXXXX是HMG-CoA还原酶的⼀选择性、竞争性抑制剂,可以显著降低胆固醇⽔平,并降低⼼肌梗死或脑卒中的发病危险。
临床试验已经证实XXXXX降低胆固醇的临床疗效明显优于其它汀类药物,对原发性⾼胆固醇⾎症、包括家族性⾼胆固醇⾎症或混合型⾼脂⾎症患者以及纯合⼦家族性⾼胆固醇⾎症者有明显疗效。
XXXXX(商品名)作为⽬前世界上顶级降⾎脂药物,由美国华纳-兰伯特公司研制开发。
1997年上市,之后并⼊辉瑞公司。
⾃1998年以来取得了优异的业绩,成为当今世界增长最快的药品,连续三年名列全球畅销处⽅药第⼀位,2003年全球销售亿美元,2004年⾼达亿美元。
华纳-兰伯特公司的XXXXX在1999年9⽉获准中国申请药品⾏政保护,在国内由⼤连辉瑞⽣产销售。
⽬前,国内原北京红惠制药(现更名北京嘉林药业)已获得XXXXX及⽚剂产品的⽣产批⽂,天⽅药业研制开发XXXXX胶囊,于2005年9⽉29⽇获得新药证书和药品注册批件。
我公司⽴项仿制XXXXX⽚,规格与辉瑞制药(⼤连)有限公司的XXXXX相同,为:10mg/⽚。
CTD格式申报资料撰写要求(原料药)一、目录3。
2。
S 原料药3.2。
S.1 基本信息3。
2。
S。
1.1 药品名称3.2。
S。
1。
2 结构3。
2。
S。
1。
3 理化性质3。
2.S.2 生产信息3。
2.S。
2.1生产商3.2。
S。
2。
2生产工艺和过程控制3.2。
S.2。
3物料控制3.2.S.2.4关键步骤和中间体的控制3.2。
S。
2。
5工艺验证和评价3。
2。
S。
2.6生产工艺的开发3.2。
S。
3 特性鉴定3。
2。
S。
3。
1结构和理化性质3。
2.S.3。
2杂质3。
2.S。
4 原料药的质量控制3.2。
S。
4.1质量标准3.2。
S.4.2分析方法3.2.S。
4.3分析方法的验证3。
2。
S。
4。
4批检验报告3.2。
S。
4.5质量标准制定依据3.2.S。
5对照品3。
2。
S.6包装材料和容器3.2。
S.7稳定性3。
2.S.7。
1稳定性总结3.2。
S.7。
2上市后稳定性承诺和稳定性方案3。
2。
S.7。
3稳定性数据二、申报资料正文及撰写要求3。
2。
S。
1 基本信息3.2.S。
1。
1药品名称提供原料药的中英文通用名、化学名,化学文摘(CAS)号以及其它名称(包括国外药典收载的名称)。
3.2.S。
1.2 结构提供原料药的结构式、分子式、分子量,如有立体结构和多晶型现象应特别说明.3。
2.S.1。
3 理化性质提供原料药的物理和化学性质(一般来源于药典和默克索引等),具体包括如下信息:性状(如外观,颜色,物理状态);熔点或沸点;比旋度,溶解性,溶液pH, 分配系数,解离常数,将用于制剂生产的物理形态(如多晶型、溶剂化物、或水合物),粒度等。
3。
2。
S。
2 生产信息3。
2.S。
2.1生产商生产商的名称(一定要写全称)、地址、电话、传真以及生产场所的地址、电话、传真等。
3.2.S。
2。
2 生产工艺和过程控制(1)工艺流程图:按合成步骤提供工艺流程图,标明工艺参数和所用溶剂。
如为化学合成的原料药,还应提供其化学反应式,其中应包括起始原料、中间体、所用反应试剂的分子式、分子量、化学结构式。
CTD格式中的合成工艺研究及申报资料撰写要求(原料药)一、目录3.2.S 原料药3.2.S.1 基本信息3.2.S.1.1 药品名称3.2.S.1.2 结构3.2.S.1.3 理化性质3.2.S.2 生产信息3.2.S.2.1生产商3.2.S.2.2生产工艺和过程控制3.2.S.2.3物料控制3.2.S.2.4关键步骤和中间体的控制3.2.S.2.5工艺验证和评价3.2.S.2.6生产工艺的开发3.2.S.3 特性鉴定3.2.S.3.1结构和理化性质3.2.S.3.2杂质3.2.S.4 原料药的质量控制3.2.S.4.1质量标准3.2.S.4.2分析方法3.2.S.4.3分析方法的验证3.2.S.4.4批检验报告3.2.S.4.5质量标准制定依据3.2.S.5对照品3.2.S.6包装材料和容器3.2.S.7稳定性3.2.S.7.1稳定性总结3.2.S.7.2上市后稳定性承诺和稳定性方案3.2.S.7.3稳定性数据二.合成工艺研究及申报资料撰写要求存在的问题:未真正按照过程控制和终点控制相结合的、全面系统的药品质量控制理念,进行系统而深入的研发,仅简单地将原有的申报资料按照CTD的格式重新组合。
3.2.S.1 基本信息3.2.S.1.1药品名称提供原料药的:中文通用名:英文通用名:化学名:中文化学名和英文化学名。
化学文摘(CAS)号:其它名称(包括国外药典收载的名称):如有,写出,如无,不写。
3.2.S.1.2 结构提供原料药的:结构式:分子式:分子量:如有立体结构和多晶型现象应特别说明。
3.2.S.1.3 理化性质提供原料药的物理和化学性质,具体包括如下信息:性状(如外观,颜色,物理状态);熔点或沸点;比旋度,溶解性,溶液pH, 分配系数,解离常数,将用于制剂生产的物理形态(如多晶型、溶剂化物、或水合物),粒度等。
来源于文献及试验。
例:本品为黄色结晶性粉末,无臭,无味,遇光不稳定,在丙酮或氯仿中易溶,在乙醇中略溶,在水中几乎不溶。
国食药监注〔2010〕 387 号附件:化学药品 CTD格式申报资料撰写要求CTD格式申报主要研究信息汇总表(原料药)基本信息药品名称原料药的中英文通用名、化学名构造原料药的构造式、分子式、分子量理化性质原料药的主要物理和化学性质:性状(如外观,颜色,物理状态);熔点或沸点;比旋度,溶解性,溶液pH, 分派系数,解离常数,将用于制剂生产的物理形态(如多晶型、溶剂化物、或水合物),生物学活性等。
生产信息生产商生产商的名称(必定要写全称)、地址以及生产场所的地址。
生产工艺和过程控制(1)工艺流程图:拜见申报资料(注明页码)。
(2)工艺描绘:按反响路线简述各步反响的反响种类(氧化、复原、代替、缩合、烃化、酰化等),各步反响的原料、试剂、溶剂和产物的名称,终产物的精制方法和粒度控制等;特别的反响条件(如高温、高压、深冷等)应说明。
详尽内容拜见申报资料(注明页码)。
(3)生产设施:拜见申报资料(注明页码)。
( 4)大生产的制定批量:kg( g) / 批。
物料控制生产用物料(如开端物料、反响试剂、溶剂、催化剂等)的质量控制信息(包含根源、质量标准等),拜见申报资料(注明页码)。
要点步骤和中间体的控制列出全部要点步骤及其工艺参数控制范围。
要点步骤确立依照拜见申报资料或(注明页码)。
中间体的质量控制拜见申报资料(注明页码)。
工艺考证和评论无菌原料药:工艺考证方案(编号: --,版本号: --)和考证报告(编号: --,版本号: --)拜见申报资料(注明页码)。
其余原料药:工艺考证方案(编号:--,版本号: --)和考证报告(编号:--,版本号: --)拜见申报资料(注明页码);或许,工艺考证方案(编号: -- ,版本号: --)和批生产记录(编号: --,版本号: --)样稿拜见申报资料(注明页码),考证承诺书拜见申报资料(注明页码)。
生产工艺的开发简要说明工艺路线的选择依照(比如参照文件或自行设计),简要描绘工艺开发过程中生产工艺的主要变化(包含批量、设施、工艺参数以及工艺路线等的变化)。
医药CRO化学药品各号申报资料的一般要求申报资料的一般要求为便于梳理与理解,在同一号资料中分为以下三种情形:A:新药报临B:新药报生产C:仿制药1号资料:A:包括通用名、商品名、化学名、英文名、汉语拼音,并注明其化学结构式、分子量、分子式等(见药审中心要求)。
如果是新剂型新命名、应附上药典委员会命名的复函B:同AC:同A外,需提供:国家标准(注:不允许申请商品名)2号资料:A:1、药品生产企业:“三证”(GMP与生产许可证的单位名称和生产地址一致)新药证书申请人:有效的营业执照、事业单位法人证书及其变更登记证明2、专利查询报告、不侵权保证书3、特殊药品:SFDA安监司的立项批件4、制剂用原料药的合法来源(一套)①直接向原料生产厂家购买:a、原料厂三证(三证与原料的批准证明文件的单位名称、地址必须一致)1、生产企业:营业执照、税务登记证、组织机构代码证、生产许可证(QS 证)(还需要产品第三方检测报告、出厂检测报告,产品执行标准等) 。
2、贸易型企业:营业执照、流通许可证(同时也需要提供所销售产品生产厂家的营业执照、生产许可证等)b、原料的批准证明文件(《药品注册批件》、《药品注册证》、统一换发文号的文件等)c、原料的质量标准及原料药出厂检验报告d、购货发票(赠送的,提供相关证明(赠送证明))e、购销合同或供货协议复印件f、自检报告书(全检)②向原料经销单位购买的:除需提供上述文件外,还需提供经销商与原料厂的供货协议新增:申报生产时,原料药如系通过赠送途径获得而未能提供该原料药合法来源证明和供货协议的,不批准③原料与制剂同时注册申请:原料和制剂厂不一致的,应提供原料和制剂厂之间的供货协议或合作开发协议(申报相同剂型的原料药来源不能是相同的原料药申请人)×A厂胶囊原料甲×B厂胶囊只能一对一,因此时的原料甲还未批准上市④使用进口原料的:略5、商标查询单或商标注册证(可推迟至报生产时提供)6、直接接触药品的包装材料和容器的包材证或受理通知单(2005版药典已将胶囊归为包材)7、委托试验:应提供委托合同,并附该机构合法登记证明、必要的资质证明。