《医学生物化学》期末复习题重点 (答案)
- 格式:docx
- 大小:261.37 KB
- 文档页数:10


《医学生物化学》期末复习题
题型:
(1)选择题25题(每题1分),占25分
(2)填空题10题(每题1分),占10分
(3)名解15题(每题2分),占30分
(4)问答5题(每题7分),占35分
一章、蛋白质:
【名解】(17)
等电点:
肽键、蛋白质的一级结构、亚基、空间构象、蛋白质的二级结构、蛋白质的三级结构、蛋白质的四级结构、ɑ-螺旋、ß-折叠、超二级结构、模体、结构域、分子伴侣、蛋白质组、协同效应、蛋白质变性
【问答】(3)
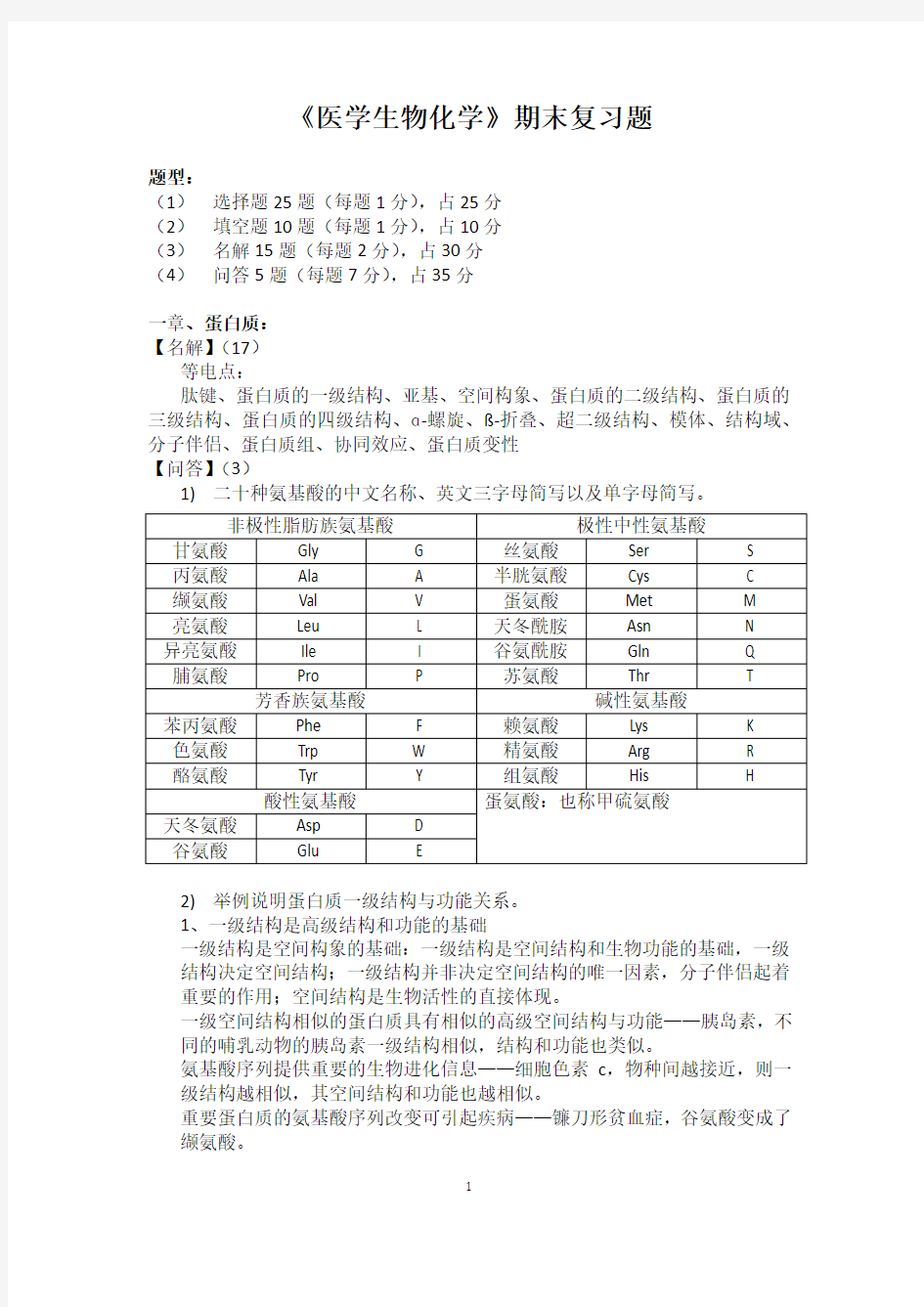
1)二十种氨基酸的中文名称、英文三字母简写以及单字母简写。
2)举例说明蛋白质一级结构与功能关系。
1、一级结构是高级结构和功能的基础
一级结构是空间构象的基础:一级结构是空间结构和生物功能的基础,一级结构决定空间结构;一级结构并非决定空间结构的唯一因素,分子伴侣起着重要的作用;空间结构是生物活性的直接体现。
一级空间结构相似的蛋白质具有相似的高级空间结构与功能——胰岛素,不同的哺乳动物的胰岛素一级结构相似,结构和功能也类似。
氨基酸序列提供重要的生物进化信息——细胞色素c,物种间越接近,则一级结构越相似,其空间结构和功能也越相似。
重要蛋白质的氨基酸序列改变可引起疾病——镰刀形贫血症,谷氨酸变成了缬氨酸。
2、蛋白质的功能依赖特定空间结构
体内蛋白质具有的特定空间构象都与其特殊的生理功能有着密切的关系,蛋白质构象的改变可引起疾病,如疯牛病。
3)蛋白质分离与纯化方法及应用分析,重点是用离子交换层析分离蛋白质
组分或氨基酸组分及其层析图谱分析。
一、透析及超滤法可去除蛋白质溶液中的小分子化合物
透析(dialysis):利用透析袋把大分子蛋白质与小分子化合物分开的方法。超滤法:应用正压或离心力使蛋白质溶液透过有一定截留分子量的超滤膜,达到浓缩蛋白质溶液的目的。
二、丙酮沉淀、盐析及免疫沉淀是常用的蛋白质沉淀方法
丙酮沉淀:使用丙酮沉淀时,必须在0~4℃低温下进行,丙酮用量一般10倍于蛋白质溶液体积。蛋白质被丙酮沉淀后,应立即分离。除了丙酮以外,也可用乙醇沉淀。
盐析:盐析(salt precipitation)是将硫酸铵、硫酸钠或氯化钠等加入蛋白质溶液,使蛋白质表面电荷被中和以及水化膜被破坏,导致蛋白质沉淀。
免疫沉淀法:用某一纯化蛋白质来免疫(使某物产生抗性)动物可获得抗该蛋白的特异抗体。利用特异抗体识别相应的抗原蛋白,并形成抗原抗体复合物的性质,可从蛋白质混合溶液中分离获得抗原蛋白。
三、利用荷电性质可用电泳法将蛋白质分离
蛋白质在高于或低于其pI的溶液中为带电的颗粒,在电场中能向正极或负极移动。这种通过蛋白质在电场中泳动而达到分离各种蛋白质的技术, 称为电泳(elctrophoresis) 。
根据支撑物的不同,可分为薄膜电泳、凝胶电泳等。
几种重要的蛋白质电泳:
①SDS-聚丙烯酰胺凝胶电泳,常用于蛋白质分子量的测定。
②等电聚焦电泳,通过蛋白质等电点的差异而分离蛋白质的电泳方法。
③双向凝胶电泳是蛋白质组学研究的重要技术。
四、应用相分配或亲和原理可将蛋白质进行层析分离
层析(chromatography)分离蛋白质的原理:
待分离蛋白质溶液(流动相)经过一个固态物质(固定相)时,根据溶液中待分离的蛋白质颗粒大小、电荷多少及亲和力等,使待分离的蛋白质组分在两相中反复分配,并以不同速度流经固定相而达到分离蛋白质的目的。
蛋白质分离常用的层析方法:
①离子交换层析:利用各蛋白质的电荷量及性质不同进行分离。
②凝胶过滤(gel filtration)(分子筛层析),利用各蛋白质分子大小不同分离。
图1
图2
五、利用蛋白质颗粒沉降行为不同可进行超速离心分离
超速离心法(ultracentrifugation)既可以用来分离纯化蛋白质也可以用作测定蛋白质的分子量。
蛋白质在离心场中的行为用沉降系数(sedimentation coefficient, S)表示,沉降系数与蛋白质的密度和形状相关。
因为沉降系数S大体上和分子量成正比关系,故可应用超速离心法测定蛋白质分子量,但对分子形状的高度不对称的大多数纤维状蛋白质不适用。
二章、核酸:
【名解】(16)
超螺旋结构及正、负超螺旋、Hoogsteen氢键、核小体、5’帽结构、Poly(A)-tail、hnRNA、mRNA、tRNA、snmRNA、siRNA、三联体密码、开放阅读框、DNA变性、增色效应、解链温度、核酶
【问答】(1)
1)DNA双螺旋结构模型特点及其意义
1.DNA是反向平行、右手螺旋的双链结构
两条多聚核苷酸链在空间的走向呈反向平行(anti-parallel)。两条链围绕着同一个螺旋轴形成右手螺旋(right-handed)的结构。双螺旋结构的直径为2.37nm,螺距为3.54nm。
脱氧核糖和磷酸基团组成的亲水性骨架位于双螺旋结构的外侧,疏水的碱基位于内侧。
双螺旋结构的表面形成了一个大沟(major groove)和一个小沟(minor groove)。
2.DNA双链之间形成了互补碱基对
碱基配对关系称为互补碱基对(complementary base pair)。DNA分子中,腺嘌呤与胸腺嘧啶配对(A=T),鸟嘌呤与胞嘧啶配对(GΞC)。
DNA的两条链则互为互补链(complementary strand)。
碱基对平面与螺旋轴垂直。
3.疏水作用力和氢键共同维系着DNA双螺旋结构的稳定。
相邻两个碱基对会有重叠,产生了疏水性的碱基堆积力(base stacking interaction)。
碱基堆积力和互补碱基对的氢键共同维系着DNA结构的稳定。
三章、酶:
【名解】(16)
寡聚酶、多酶体系、结合酶、全酶、辅酶、酶的活性中心、同工酶、酶的专一性、酶与底物结合的诱导契合、酶的抑制剂、酶的竞争抑制作用、酶的非竞争抑制作用、酶的反竞争抑制作用、变构酶、变构调节、酶原的激活
【问答】(3)
1)酶的反应特点(P68-70)
(1)、酶反应具有极高的效率
酶的催化效率通常比非催化反应高108~1020倍,比一般催化剂高107~1013倍。例如脲酶催化尿素的水解速率是H+催化作用的7×1012倍。α-胰凝乳蛋白酶对本酰胺的水解速率是H+的6×106,而且不需要较高的反应温度。
(2)、酶促反应具有高度的特异性