第16章 氮族预习提纲
- 格式:docx
- 大小:550.61 KB
- 文档页数:10

高二化学氮族元素单元复习人教版【同步教育信息】一. 本周教学内容:氮族元素单元复习二. 重点、难点1. 掌握氮族元素的原子结构特点及其在周期表的位置和性质的变化规律。
2. 掌握氨和铵盐的性质、用途及氨的实验室制法,学会检验铵离子。
3. 掌握硝酸的通性和特性,及氨氧化法制取的化学反应原理,并了解主要生产过程。
4. 了解氮气、磷的同素异形体白磷和红磷的性质和用途。
三.具体内容2. 知识网络:请你按下表要求填入你所知道的含有氮元素的物质的化学式:含氧酸 HNO 3、HNO 2、 碱 NH 3·H 2O 盐 NH 4NO 3络合物 OH NH Ag ])([23有机物C 6H 5—NO 232263)(NO H C CH - n ONO O H C ])([32276(1)氮气① 结构的稳定性 ② 氧化性——223H N +32NH2323N Mg MgN 点燃+③ 还原性——NO O N 222放电+④ 2N 的工业制法及氮的固定 (2)氮的氧化物 (3)磷及其化合物 ① 同素异形体 ② 磷的还原性③ 磷的氧化物——52O P ④ 磷酸及偏磷酸 ⑤ 磷酸盐的性质 (4)氨气及铵盐① 3NH 的结构及物理性质② 3NH 的化学性质——还原性,与水,与酸反应 ③ 3NH 的制法及用途 ④ 铵盐的四大特点: <1> 易溶于水,且吸热 <2> 与碱反应 <3> 受热易分解<4> 水解 ⑤ +4NH 的检验(5)硝酸及硝酸盐① 硝酸的强氧化性、不稳定性、有机反应 ② 工业制硝酸 ③ 硝酸盐的性质 ④ 王水【典型例题】[例1] 在一定条件下,某元素的氢化物X 可完全分解为两种单质:Y 和Z ,若已知:① 反应前的X 与反应后生成的Z 的物质的量之比3:2)(:)(=Z n X n② 单质Y 的分子为正四面体构型 请填写下列空白。
(1)单质Y 是 ,单质Z 是 (填写名称或分子式) (2)Y 分子共含 个共价键。

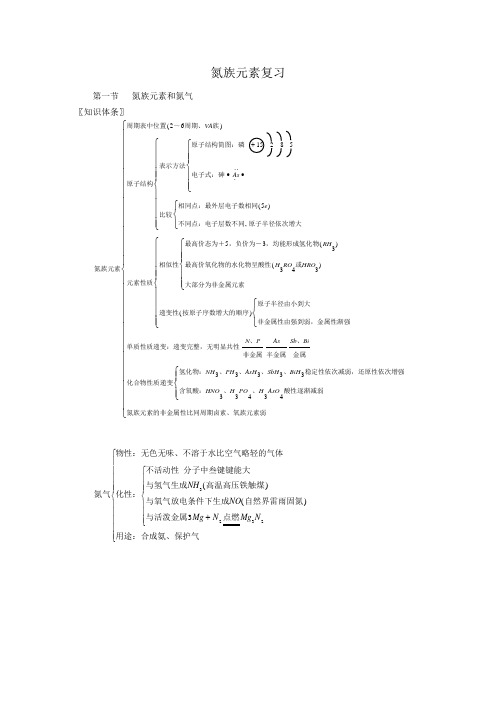
氮族元素复习第一节氮族元素和氮气〖知识体条〗氮族元素周期表中位置~周期、族原子结构表示方法原子结构简图:磷电子式:砷比较相同点:最外层电子数相同不同点:电子层数不同原子半径依次增大元素性质相似性最高价态为+,负价为-,均能形成氢化物最高价氧化物的水化物呈酸性或大部分为非金属元素递变性按原子序数增大的顺序原子半径由小到大非金属性由强到弱,金属性渐强单质性质递变:递变完整,无明显共性、非金属半金属、金属化合物性质递变氢化物:、、()...(),()()()2615285553334333VAAseRHH RO HRON P As Sb BiNH PH AsH+∙∙⎧⎨⎪⎪⎩⎪⎪⎧⎨⎩⎧⎨⎪⎪⎪⎪⎩⎪⎪⎪⎪⎧⎨⎪⎪⎩⎪⎪⎧⎨⎩⎧⎨⎪⎪⎪⎪⎩⎪⎪⎪⎪33333434、、稳定性依次减弱,还原性依次增强含氧酸:、、酸性逐渐减弱氮族元素的非金属性比同周期卤素、氧族元素弱SbH BiHHNO H PO H AsO⎧⎨⎪⎩⎪⎧⎨⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪⎪氮气物性:无色无味、不溶于水比空气略轻的气体化性:不活动性分子中叁键键能大与氢气生成高温高压铁触煤与氧气放电条件下生成自然界雷雨固氮与活泼金属点燃用途:合成氨、保护气NHNOMg N Mg N32323()()+⎧⎨⎪⎪⎪⎩⎪⎪⎪⎧⎨⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪一氧化氮物性:无色有毒、不溶于水的气体化性除硝酸厂尾气不与碱作用生成盐,为不成盐氧化物制法实验室:和稀制只能用排水法收集工业上:和制氨催化氧化法222222222332NO O NO NO NO NaOH NaNO H O Cu HNO NO NH O NO +=++=+⎧⎨⎪⎪⎩⎪⎪⎧⎨⎪⎩⎪⎧⎨⎪⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎪()()()()二氧化氮物性:红棕色有毒、有刺激性气味的气体化性与水:中要有就有氧化性:制法实验室:和浓制只能用向上排空气法收集工业上:制硝酸322222232242242233232NO H O HNO NO NO N O NO N O NO SO SO NO Cu HNO NO NH O NO O NO +=+⇔+→+⎧⎨⎪⎪⎩⎪⎪−→−−−→−−⎧⎨⎪⎩⎪⎧⎨⎪⎪⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎪⎪()()()()[难点分析] 1. 氢化物氢几乎能与除稀有气体外的所有元素结合成二元化合物,这些二元化合物统称为氢化物。


礼泉一中2011-2012学年度高三一轮复习氮与其化合物课前预习区一、氮的固定1、中国有句农谚,叫做“雷雨发庄稼”,,请你用化学反应方程式和必要的文字来解释这句农谚的含义。
2、什么是氮的固定?你能写出几个氮的固定的化学方程式二、氮的氧化物1.NO和NO2的的性质与相互转化三、氨的性质;1.物理性质:2.氨的化学性质⑴与水反应:⑵与酸反应:⑶与氧气反应(催化氧化):3.氨的实验室制法⑴写出实验室制氨气的化学方程式⑵画出实验室制氨气发生装置、干燥装置、收集装置和多余氨气的吸收装置⑶如何检验氨气已经收集满?四、铵盐:1.铵盐的组成和水溶性(1)组成:(2)水溶性:2.铵盐的化学性质⑴受热分解⑵与碱的反应3、铵态氮肥为什么不能与碱性肥料(例如草木灰)混合使用?五、硝酸性质(写出化学方程式)1.酸性:2.硝酸的特性①热不稳定性常见的浓硝酸常显黄色,为什么?实验室应怎样保存硝酸?②强氧化性[课堂互动区][重难点突破]考点1. 氮与其的氧化物[例1]起固定氮作用的化学反应是( )A.N2和H2在一定条件下反应生成NH3B.NO与O2反应生成NO2C.NH3催化氧化生成NOD.由NH3制NH4HCO3和(NH4)2SO4[例2] Murad等三位教授最早提出NO分子在人体内有独特功能,近年来此领域研究有很大发展,因此这三位教授荣获了1998年诺贝尔医学与生理学奖。
下列关于NO的叙述不正确的是()A.NO可以是某些含低价N物质氧化产物B.NO不是亚硝酸酐C.NO可以是某些含高价N物质的还原产物D.NO是棕色气体[变式训练]1.NO、NO2都是大气污染物,空气中NO、NO2主要来自石油产品和煤燃烧、汽车尾气以与制硝酸工厂的废气。
其中空气中的NO2是造成的主要因素。
2. 最新研究表明:NO吸收治疗法可快速改善SARS重症患者的缺氧状况,缓解病情。
病毒学研究同时证实,NO对SARS病毒有直接抑制作用。
下列关于NO的叙述正确的是()A.NO是一种红棕色的气体B.常温常压下,NO不能与空气中氧气直接化合C.含等质量的氧元素的NO和CO的物质的量相等D.NO易溶于水,不能用排水法收集考点2. 氨和铵盐[例1]都能用右图所示装置进行喷泉实验的一组气体是(注:烧杯内为NaOH溶液)()A.HCl和CO2 B.NH3和CH4C.SO2和CO D.NO2和NO【规律总结】喷泉实验成功的关键:①烧瓶、预先吸水的滴管与直玻璃管都要干燥;②气体要充满圆底烧瓶;瓶塞要严密,不漏气,止水夹要夹紧。

高中化学氮族元素知识点氮族元素是元素周期表中的第15族元素,包括氮(N)、磷(P)、砷(As)、锑(Sb)和锇(Bi)。
这些元素在化学性质上具有一些共同的特征,例如它们的价态多变,敏感度较高,容易形成各种化合物等。
1.化学特性氮族元素的价态多变,氮的电子结构为1s²2s²2p³,其价态通常为-3、+3、0和+5、氮和磷的成键性质更加明显而形成更多的化合物,而砷、锑和锇则形成较少的化合物。
在化合物中,氮族元素通常以共价键形式存在。
2.氮族元素的重要化合物(1)氮化物:氮族元素与金属形成氮化物,例如氮化钙(Ca3N2)、氮化铍(Be3N2)等。
这些化合物通常具有很高的热稳定性和硬度,可用作耐磨材料和催化剂。
(2)卤化物:氮族元素与卤素形成卤化物,例如五氯化磷(PCl5)、五溴化磷(PBr5)等。
这些化合物在有机合成和分析化学中具有重要的应用,例如五氯化磷可用于酰氯的制备,五溴化磷可用于酰溴的制备。
(3)氮氧化物:氮氧化物是氮族元素中最重要的化合物之一,其中最常见的是一氧化氮(NO)、二氧化氮(NO2)和氧化氮(N2O)。
氮氧化物在大气中起着重要的化学作用,例如一氧化氮对臭氧层的破坏、二氧化氮和空气中的水蒸气反应形成酸雨等。
3.氮族元素的生物化学作用氮族元素在生物体内具有重要的生物化学作用。
例如,氨基酸中的氮以氨的形式存在,氨是合成蛋白质和核酸的关键物质。
此外,生物体内的ATP(三磷酸腺苷)也包含氮元素,ATP是细胞内能量转化的重要媒介物。
4.氮族元素的应用(1)氮化物的应用:氮化物具有耐磨、高熔点和高硬度的特点,因此被广泛应用于耐磨涂层、陶瓷材料和切削工具等领域。
(2)磷适用性广泛:磷广泛应用于农业和化学工业。
作为肥料,磷是作物生长所需的关键元素之一;作为化学品,磷广泛应用于合成有机化合物、制备药品和消防材料等。
(3)磷化氢的用途:磷化氢(PH3)可用作溴化和碘化的脱溴和脱碘试剂,也可用于制备金属磷化物,例如氢磷化镉和氢磷化铜等。
氮族元素知识点复习完整教案第一章:氮族元素概述1.1 氮族元素的位置和特点氮族元素在元素周期表中的位置氮族元素的共同电子排布特点1.2 氮族元素的物理性质氮族元素的熔点、沸点、密度等基本物理性质氮族元素的颜色、状态等外观特征1.3 氮族元素的应用领域氮族元素在化工、材料科学等领域的应用氮族元素在生产生活中的重要性第二章:氮元素2.1 氮元素的原子结构和电子排布氮元素的原子序数和电子层数氮元素的电子排布和最外层电子数2.2 氮元素的化学性质氮元素的氧化还原性氮元素的化学键类型和化合价2.3 氮元素的重要化合物氨气(NH3)的制备、性质和应用硝酸(HNO3)的制备、性质和应用第三章:磷元素3.1 磷元素的原子结构和电子排布磷元素的原子序数和电子层数磷元素的电子排布和最外层电子数3.2 磷元素的化学性质磷元素的氧化还原性磷元素的化学键类型和化合价3.3 磷元素的重要化合物磷酸(H3PO4)的制备、性质和应用磷肥和农药的制备、性质和应用第四章:砷元素4.1 砷元素的原子结构和电子排布砷元素的原子序数和电子层数砷元素的电子排布和最外层电子数4.2 砷元素的化学性质砷元素的氧化还原性砷元素的化学键类型和化合价4.3 砷元素的重要化合物砷化物和砷酸的制备、性质和应用砷在半导体材料中的应用第五章:锑元素5.1 锑元素的原子结构和电子排布锑元素的原子序数和电子层数锑元素的电子排布和最外层电子数5.2 锑元素的化学性质锑元素的氧化还原性锑元素的化学键类型和化合价5.3 锑元素的重要化合物锑酸(Sb(OH)3)的制备、性质和应用锑在合金材料中的应用第六章:钋元素6.1 钋元素的原子结构和电子排布钋元素的原子序数和电子层数钋元素的电子排布和最外层电子数6.2 钋元素的化学性质钋元素的氧化还原性钋元素的化学键类型和化合价6.3 钋元素的重要化合物钋的氧化物和酸的制备、性质和应用钋在放射性材料中的应用第七章:氮族元素的生物地球化学循环7.1 氮族元素的生物地球化学循环概述氮族元素在自然界中的循环过程氮族元素在生物体中的作用和代谢过程7.2 氮族元素的环境污染和治理氮族元素污染的来源和影响氮族元素污染的治理技术和方法7.3 氮族元素的环境监测和评估氮族元素的环境监测方法和技术氮族元素的环境风险评估和管理第八章:氮族元素的材料科学应用8.1 氮族元素在金属材料中的应用氮族元素在合金制备中的作用和效果氮族元素在新型金属材料研发中的应用8.2 氮族元素在半导体材料中的应用氮族元素在半导体器件中的作用和性能氮族元素在新型半导体材料研发中的应用8.3 氮族元素在其他材料中的应用氮族元素在复合材料、纳米材料等领域的应用氮族元素在新能源材料、环保材料等领域的应用第九章:氮族元素的实验操作和技术9.1 氮族元素的制备和纯化氮族元素的常见制备方法和反应条件氮族元素的纯化和分离技术9.2 氮族元素的表征技术氮族元素的物理和化学性质表征方法氮族元素的结构和形态分析技术9.3 氮族元素的实验安全注意事项氮族元素实验中的安全风险和防护措施实验室中的应急处理和废弃物处理方法第十章:氮族元素的综合研究和应用前景10.1 氮族元素的前沿研究领域氮族元素的新合成方法和新应用领域氮族元素的环境友好型材料和技术10.2 氮族元素的国际研究动态国际上氮族元素研究的最新进展和趋势国际合作和交流项目的申请和实施10.3 氮族元素的产业化应用前景氮族元素在传统产业和新兴产业中的应用前景氮族元素的市场需求和产业化发展趋势第十一章:氮族元素的反应机制和动力学11.1 氮族元素的化学反应类型氮族元素参与的合成反应、分解反应、置换反应等氮族元素化合物的反应活性与反应条件的关系11.2 氮族元素反应的机理研究氮族元素化合物的电子转移和氧化还原反应机理氮族元素参与的多步骤反应过程和路径11.3 氮族元素反应动力学氮族元素化合物的反应速率和平衡常数的研究温度、压力、催化剂等因素对氮族元素反应动力学的影响第十二章:氮族元素的环境化学12.1 氮族元素在大气环境中的化学行为氮族元素在大气中的排放、转化和归宿氮族元素对大气环境和气候变化的影响12.2 氮族元素在水环境中的化学行为氮族元素在水体中的溶解、迁移和转化氮族元素对水环境和生物体的影响12.3 氮族元素在土壤环境中的化学行为氮族元素在土壤中的吸附、固定和转化氮族元素对土壤质量和生物多样性的影响第十三章:氮族元素的健康影响和毒理学13.1 氮族元素的生物地球化学循环与人体健康氮族元素在食物链中的转移和积累氮族元素对人体健康的影响和暴露途径13.2 氮族元素的主要毒性机制氮族元素对呼吸系统、消化系统等的影响氮族元素的遗传毒性、致癌性和生殖毒性等13.3 氮族元素的安全限值和健康风险评估氮族元素的安全摄入量和暴露限制氮族元素的健康风险评估和预防措施第十四章:氮族元素的教育和普及14.1 氮族元素的教学资源和教学方法氮族元素的教学大纲、教材和课件氮族元素的教学实验和案例分析14.2 氮族元素的科普宣传和教育氮族元素的科普书籍、文章和视频氮族元素的公众教育和宣传活动14.3 氮族元素的教育国际合作和交流国际上氮族元素教育和研究的合作项目跨国氮族元素教育和研究机构的交流与协作第十五章:氮族元素的的未来挑战和机遇15.1 氮族元素面临的全球性挑战氮族元素的环境污染和生态破坏氮族元素资源的需求和可持续利用15.2 氮族元素科技创新和绿色发展氮族元素的新合成方法和新应用技术氮族元素的绿色合成和环保材料15.3 氮族元素的产业化发展和市场需求氮族元素在新能源、新材料等领域的产业化应用氮族元素的市场前景和产业政策重点和难点解析本文档涵盖了氮族元素的知识点复习,从氮族元素的概述、氮元素、磷元素、砷元素、锑元素,到钋元素,再到氮族元素的生物地球化学循环、材料科学应用、实验操作和技术,以及综合研究和应用前景,是氮族元素的环境化学、健康影响和毒理学、教育和普及,以及未来的挑战和机遇。
嘴哆市安排阳光实验学校高二化学氮族元素的综合提高通用版【本讲主要内容】氮族元素的综合提高通过一些典型方法,典型问题,综合应用本章知识和学过的相关知识规律,达到巩固提高的目的。
因为难点在计算,故本节侧重于相关问题的分析。
【知识掌握】【知识点精析】一. 有关混合气体(NO2、NO、O2等)与水反应的计算题。
NO2、NO、O2跟水反应的计算反应原理:1. 二氧化氮跟水反应:3NO2+H2O=2HNO3+NO2. 二氧化氮、氧气同时跟水反应:4NO2+O2+H2O=4HNO33. 一氧化氮、氧气同时跟水反应:4NO+3O2+H2O=4HNO3遇到这类计算题时,首先要弄清所涉及的反应原理是哪种情况,再进行计算。
讨论:⑴NO2、NO(或N2)混合气体通入水中,一般利用3NO2+H2O=2HNO3+NO,再根据气体差量法计算。
⑵NO2、O2混合气体通入水中,利用3NO2+H2O=2HNO3+NO和2NO+O2=2NO2可得总反应式:4NO2+O2+2H2O=4HNO3,由此知,当体积比:V(NO2):V(O2)=4:1,恰好完全反应,无气体剩余。
V(NO2):V(O2)<4:1,氧气过量,剩余气体为O2。
V(NO2):V(O2)>4:1,NO2过量,剩余气体为NO。
⑶NO、O2混合气体通入水中,根据反应可得总反应式:4NO+3O2+2H2O=4HNO3,当体积比:V(NO):V(O2)=4:3,恰好完全反应,无气体剩余。
V(NO):V(O2)<4:3,氧气过量,剩余气体为O2。
V(NO):V(O2)>4:3,NO过量,剩余气体为NO。
⑷NO、NO2、O2三种混合气体通入水中,可先求出NO2与H2O反应生成的NO的体积,然后按⑶法进行分析计算。
二. NO、CO2的混合气体通过足量的Na2O2后体积的变化及讨论。
(1)2CO2+Na2O2=2Na2CO3+O2(2)2NO+O2=2NO2(3)2CO2+2NO+2Na2O2=2Na2CO3+2NO2由此可得出下列结论:1. 若V(CO2)=V(NO),反应恰好按(3)式进行,反应后V(总)=[V(CO2)+V(NO)]/22. 若V(CO2)>V(NO),反应按(3)式进行后,剩余CO2按(1)式进行,即体积仍减少一半,反应后V(总)=[V(CO2)+V(NO)]/23. 若V(CO2)<V(NO),反应按(3)式进行后,反应后V(总)=V(NO)三. 根据化学方程式氧化还原电子得失原理的计算例1. NO2、NH3、O2组成的混合气体,一定条件下完全反应生成N2和H2O,则原混合气体中NO2、NH3、O2的体积比可能是(不考虑二氧化氮与四氧化二氮的转化)A. 2∶4∶1B. 2∶1∶2C. 1∶2∶1D. 1∶4∶3解析:A,本题考查氧化还原反应的物质的量关系,反应为:NO2 + NH3+ O2→N2+ H2O,化合价变化为NO2,+4→0,O2,-2→0,NH3,-3→0,由得失电子守恒解出A正确。
复习氮族一. 本周教学内容:复习氮族(一)氮、磷的原子结构氮、磷的原子结构简图电子式VA族元素的原子最外层有5个电子,所以它们具有比较稳定的化学性质。
但是,它们原子核外的电子层数从N→Bi由2层增加到6层,所以它们的原子半径递增、非金属性递减、最高价氧化物对应水化物的酸性递减、气态氢化物①稳定性递减,②沸点递增(二)氮气的结构氮气N2的电子式结构式N2分子稳定的原因:分子内的叁键键能大,分子不容易断裂。
1. N2的重要物理性质:2. N2的重要化学性质:①N2与H2反应②N2与O2反应③N2与Mg反应3. 常见与“N”有关的化学计算原理或关系式(也叫总反应式):⑴NO2与H2O⑵NO、O2、H2O⑶NO2、O2、H2O⑷由NH3制HNO3(三)NH3结构式电子式几何构型:三角锥形1. NH3的重要物理性质:氨水的主要成份2. NH3 的重要化学性质:⑴与酸反应⑵与O2反应⑶与HCl反应3. 实验室制取NH3 :①原理②装置:与甲烷、氧气的相同4. NH3的检验方法:湿润的红色石蕊试纸5. 铵盐与碱溶液反应的离子方程式:NH4+ + OH- == NH3↑ + H2O(四)硝酸1. 硝酸的重要物理性质:浓硝酸的保存方法是:2. 硝酸的重要化学性质:⑴硝酸具有强酸性,但是在浓硝酸中滴入石蕊试液的现象是先变红后褪色,硝酸与金属反应时无氢气生成。
⑵强氧化性:浓硝酸在常温使铁、铝钝化。
浓硝酸、稀硝酸和金属反应的规律:浓硝酸的还原产物为二氧化氮,稀硝酸的还原产物为一氧化氮。
⑶王水的组成是:体积比为3:1的浓盐酸和浓硝酸混合。
(五)磷1. 白磷的主要物理性质:2. 红磷的主要物理性质:3. 白磷与红磷可以相互转化,该过程属于化学变化。
4. 磷的重要化学性质:⑴磷与氧气反应:⑵磷与氯气反应:主要现象为白色烟雾(六)过量计算:【典型例题】例1. 室温下,将等体积的NO和O2混合,混合气体的平均相对分子质量是A 31B 41.3C 稍大于41.3D 稍小于41.3解析:由于反应:2NO + O2→ 2NO2假定原含2摩尔NO和2摩尔O2,反应后生成2摩尔NO2同时剩余1摩尔O2,根据平均相对分子质量的计算,等于41.3。
第十六章 氮族元素预习提纲第16章 氮 磷 砷 锑 铋16.1 元素基本性质氮族(V A):N, P, As, Sb, Bi 价电子构型:ns 2np 3 一、氮的成键特征和价键结构1、形成离子键2、形成共价键(氢键)(1)形成三个共价单键(2)形成一个共价双键和一个共价单键 (3)形成一个共价叁键(4)N 原子还可以有氧化数为+5的氧化态 3、形成配位键N 与同族其他元素性质的差异(1) N -N 单键的键能反常地比第三周期P -P 键的小。
(2) N 易于形成p —p π键(包括离域π键),所以,N =N 和N ≡N 多重键的键能又比其它元素的大。
(3) 在共价化合物中,N 最多只能形成4个共价键,也即N 的配位数最多不超过4。
而P 、As 由于有可利用的d 轨道,配位数可扩大到5或6,如PCl 5(sp3d 杂化)和[PCl 6]-(sp 3d 2杂化)。
应当提及的是,在氮的某些含氧化合物中,由于N 的一对2s 电子参与了价键的形成如,N 虽表现出+V 氧化态,但配位数仍未超过4 。
(4) 和O 、F 相似,N 也有形成氢键的倾向,但是H -N …H 键的强度比H -O …H 键要弱。
二、氮元素的元素电势图 16.2 氮和氮的化合物 一、 氮氮气是无色、无臭、无味的气体。
沸点为 -195.8°C 。
很难液化,微溶于水。
常温下化学性质极不活泼,加热与活泼金属Li ,Ca ,Mg 等反应生成离子型化合物。
1、物理性质和制备实验室里制备少量氮气常用方法:加热饱和的亚硝酸钠和氯化铵的混合溶液: NH 4Cl+NaNO 2===NH 4NO 2+NaCl NH 4NO 2===N 2↑+2H 2O 少量氮气常用方法还可以利用:(1)(NH 4)2Cr 2O 7加热分解: (NH 4)2Cr 2O 7 =N 2↑+Cr 2O 3+4H 2O (2)NH 3通过红热的CuO : 2NH 3+3CuO =3Cu+N 2↑+3H 2O (3)NH 3通入溴水: 8NH 3+3Br 2 =N 2↑+6NH 4Br (4)极纯的N 2(光谱纯)可由叠氮化钠NaN 3加热分解得到:NaN 3=Na(l)+N 2↑NP As Sb Bi +5 +5 +5 (+5) +3 +3 +3 +3 氧化态 +5 | -3 -3 -3 (-3)最大配位数4 6 6 6 6M 2O 3 酸性 酸性 两性 两性 碱性 酸性增加 MH 3稳定性下降B . MO Li~N :E 2 p – E 2s < 15eV ,较小, 2s 与2p 线性组合成分子轨道,使 Li 2 ~ N 2 : E (σ2px ) > E (π2p ) N 2分子轨道式:N 2 [KK (σ2s ) 2 (σ2s *)2 (π2py , π2pz )4, (σ2px )2] 键级 =(8-2)/ 2 = 3对比 :O 2、F 2、Ne 2: E (σ2px ) < E (π2p )2.分子结构A . VBN 2s 2 2p x 1 2p y 1 2p z 1 |σ |π |π N 2s 2 2p x 1 2p y 1 2p z 1即: : N ≡ N : 1 σ + 2 π3、化性二、 氮的氢化物1、氨 (NH 3 )N :sp 3杂化 (1)结构:三角锥形 (2)物理性质 无色,刺激味气体, 极易溶于水,常压下很易被液化,液氨可做制冷剂、溶剂。
(3)氨的制备工业合成: N 2 + 3H 2 2NH 3实验室制备:(4)化学性质 ①加合反应如: NH3·H 2O == NH 4+ + OH - (弱碱性) 加H + 生成铵盐加OH - 释放NH 3 用于实验室制NH 3、鉴定NH 4+盐(气室法)CaCl 2 + 8NH 3 → CaCl 2·8NH 3 (∴CaCl 2不能做NH 3的干燥剂) ② 氧化反应(还原性)4NH 3 + 5O 2 = 4NO + 6H 2O (工业制HNO3的基础反应) 2NH 3 + 3CuO → 3Cu + N 2 + 3H2O2NH 3 + 3Cl 2 → N 2 + 6HCl (可用于检验Cl2气管道是否漏气) ③ 取代反应(两类)可生成一系列NH 3的衍生物,如:NaNH 2、Li 2NH 、AlN 。
又如:Hg(NH 2)Cl 、CO(NH 2)2。
2、铵盐(1)铵盐一般为无色晶体,绝大多数易溶于水,水解: (2)NH 4+的鉴定石蕊试纸法 (红→蓝) Nessler 试剂法 (K 2HgI 4)(3) 热稳定性差红棕到深褐 实质:质子转移稳定性规律:与NH 4+ 结合的阴离子碱性越强,铵盐越不稳定。
如卤化铵 NH 4X 的热稳定性按NH 4F -NH 4I 的顺序递增。
热分解产物:与阴离子对应酸的氧化性、挥发性有关,与分解温度有关。
① 挥发性非氧化性酸铵盐 ② 非挥发性,非氧化性酸铵盐例1 NO 2O N 22放电式加热+ 例2 3,22NH 2H 3N ∆+催化剂 例3 TiAl Ba Mg+ N 2 −→−∆ 相应氮化物 N Li (g)N 6Li(s)32R.T2+ 离子型晶体 例4 与一些d 过渡金属生成配合物: [Ru(NH 3)3(N 2)]2+[(NH 3)3Ru-N 2-Ru(NH 3)3]4+ Ru 2+ 的d 电子反馈到N 2的π* 空轨道,形成d →π*反馈π键, 使N-N 键级 ↘,N 2分子被“活化”——“固氮工程”。
2NH 4Cl + Ca(OH)2 = CaCl 2 + 2NH 3↑+ 2H 2O +++→+OH NH O H NH 3324O 3H 7I I(s)NH Hg Hg O 4OH ]2[HgI NH 22244++⎥⎦⎤⎢⎣⎡−→−++---+O(g)H (g)CO (g)NH HCO NH O(g)H (g)CO (g)NH 2CO )(NH HCl(g)(g)NH Cl NH 2233422332434++−→−++−→−+−→−∆∆∆443424433434HSO NH (g)NH SO )(NH PO H (g)NH 3PO )(NH +−→−+−→−∆∆③ 氧化性酸铵盐3、联氨联氨(肼)N 2H 4 (N 为-Ⅱ)分子中两个N原子sp3杂化轨道成键,由于有两对孤电子对的排斥作用,使两对孤电子对处于反位,并使N-N键键能减小,因而N 2H 4的稳定性比NH 3小。
化学性质不稳定性: N 2H 4稳定性比NH 3小,受热即发生爆炸性分解,生成N 2、NH 3和H 2。
碱性:水溶液显碱性,是二元弱碱,碱性比氨弱。
联氨既有氧化性又有还原性 酸性溶液中以氧化性为主,被还原产物是NH 4+,但大多数氧化反应的速度很慢;在中性和碱性溶液中以还原性为主,为强还原剂,能将Ag +、CuO 、X 2还原为Ag 、Cu 2O 、X -,本身被氧化为N 2。
4、羟氨 (NH 2OH)羟氨易溶于水,碱性比肼还弱。
性质:(1)不稳定,受热分解为NH3、N2和H2O 。
(2)易溶于水,其水溶液比较稳定,显弱碱性(比联氨还弱)。
NH 2OH+H 2O = NH 3OH++OH - K b =6.6×10-9 (3)作为配位剂。
例如Zn(NH 2OH)2Cl 2(4)既有还原性又有氧化性,但以还原性为主。
特别是在碱性介质中为强还原剂,可使Ag +、X 2被还原,本身被氧化为N 2,N 2O ,NO 气体放出,不会给反应体系带来杂质。
注:NH 3,N 2H 4,NH 2OH 都是路易斯碱,碱性依 NH 3,N 2H 4,NH 2OH 的顺序下降。
5、叠氮酸 ( HN 3 )联氨被亚硝酸氧化,生成叠氮酸(逆歧化) N 2H 4 + HNO 2 = 2H 2O + HN 3 性质(1)叠氮酸① 受撞击易爆炸分解:2HN 3(g )= 3N 2(g) + H 2(g) △r H m = -593.6 kJ.mol -1 原因:H + 的离子势很大,对 N 3- 强的“反极化作用”。
②挥发性一元弱酸。
HN 3→H+ + N 3- K a =1.9×10-5其稀的水溶液几乎不分解。
(2)叠氮化物① 重金属(Ag +、Pb 2+、Cu 2+、Hg 22+)的叠氮化物受撞击易爆炸分解,可作“引爆剂”。
②N 3-为拟卤素离子(似X -) 例:AgN 3、Pb(N 3)2、Hg 2(N 3)2均难溶于水。
似AgX (X = Cl 、Br 、I)N 3- 与 N 2O 和 CO 2 为等电子体,都有直线形结 构, N 3- 是个布朗斯特碱,其共轭酸 HN 3 的 pKa= 4.77.作为路易斯碱, N 3-是 d 区金属离子的良好位体。
Pb(N 3)2 和 Hg(N 3)2 常用做引爆剂(制雷管)。
三、 氮的氧化物O2H O N NO NH O9H 2HNO N 4NO 5NH O 4H (s)O Cr (g)N O Cr )(NH O2H (g)N NO NH 2234232C 24034232272242224+−→−++−−→−++−→−+−→−∆︒∆∆1、 一氧化氮(NO)制备:工业: 实验室:物理性质:无色气体,不助燃,水中溶解度较小。
也不与酸碱反应。
常温极易氧化为红棕色的NO 2分子结构: 气态NO 顺磁 → 奇电子化合物,但在低温下,液态和固态NO 却显示逆磁性,这是因为发生了聚合作用,形成二聚体N 2O 2。
化学性质:A 双聚 2 NO = (NO)2B 氧化-还原性:a 还原性5NO+3MnO 4-+4H +=5NO3-+2Mn 2++3H2O (检测NO ) 2NO + O 2 = 2NO2b 氧化性: 2NO(g) + CO(g) = 2N 2(g) + 2CO 2(g) C 配位性质:例:FeSO 4 + NO(g) ——[Fe (NO)]SO 4硫酸亚硝酰铁(I ) 棕色,可溶 棕色环反应,可用于鉴定NO 3- 3 Fe 2+ + NO 3- + 2 H +—— 3 Fe 3+ + NO 2-+ H 2O (H 2SO 4) NO 2- 干扰,需先用I -除去:2 NO 2- + 2 I - + 4 H + = 2 NO ↑+ I 2(s) + 2 H 2O NO 3-在稀酸介质中不能氧化I -。
2、 二氧化氮(NO 2)结构: N :价电子2s 22p 3 sp 2杂化后NO 2有毒,有特殊臭味的红棕色气体化性A 氧化性 4NO 2(g) + H 2S(g)=4NO(g) + SO 3(g) + H 2ONO 2(g) +CO(g) = NO(g) + CO 2(g)B 还原性 10NO 2 +2KMnO 4+3H 2SO 4 +2H 2O= 10HNO 3 +2MnSO 4 + K 2SO 4C 易歧化(酸碱介质均如此)3NO 2 +H 2O= 2HNO 3 + NO(g) (制备HNO3) 2NO 2 + 2OH - =NO 3- + NO 2- + H 2O (用碱吸收) 三、 氮的含氧酸及其盐 1、 亚硝酸(HNO 2)(1)结构: 制备(1) 性质:①不稳定 ② 弱酸③ 氧化还原性O6H NO(g)4(g)5O (g)4NH 2C 80023+−−→−+︒O4H 2NO )3Cu(NO )(8HNO 3Cu 2233++→+稀33π(无色)(红棕色)42C 1402O N 2NO −−→−︒22224422HNO 2O H NO NO HNO NaHSO SO H NaNO −−→−+++−−→−+冷冻冷冻223222NO NO O H O N O H 2HNO ++→+→酸介质氧化性显著,碱介质还原性为主.HNO 2 −−→−还原NO ,N 2O ,N 2,NH 3OH +, NH 4+ a 、HNO 2氧化性例1: 2NO 2- + 2I - + 4H + = 2NO + I 2(s) +2H 2O I 2 + 2S 2O 32- = 2I - + S 4O 62-定量检测NO 2-(生成I 2以CCl 4 萃取 ,可定性检测) 对比:稀酸介质中,NO 3- 无此反应(不氧化I -),说明氧化性NO 3- < NO 2-,以此反应可区分NO 2-和NO 3-。