过渡期生长激素缺乏症诊断及治疗专家共识(2020完整版)
- 格式:doc
- 大小:84.00 KB
- 文档页数:11


《骨代谢生化指标临床应用专家共识(2022)》要点骨是具有新陈代谢的活组织,由破骨细胞吸收旧骨、成骨细胞生成等量新骨取代以完成骨转换,在伴随人一生的骨转换过程中,骨代谢生化指标发挥重要调节作用。
骨代谢生化指标包括:钙磷代谢调节指标、骨形成标志物、骨吸收标志物、激素与细胞因子。
其中骨形成标志物与骨吸收标志物合称为骨转换标志物。
骨代谢生化指标虽不能作为骨质疏松诊断的金标准,但通过检测血、尿中骨代谢生化指标水平,可以了解骨组织新陈代谢的情况,用于评价骨代谢状态、骨质疏松诊断分型、预测骨折风险、抗骨质疏松治疗疗效评价,以及代谢性骨病的鉴别诊断。
在骨质疏松发病机制、骨质疏松药物的研究及流行病学研究方面具有重要的临床意义。
1钙磷代谢调节指标在骨代谢调节过程中,主要的钙磷代谢调节指标包括甲状旁腺素、降钙素和维生素D3。
1.1甲状旁腺素对维持机体钙磷平衡和调节骨代谢起着重要作用。
PTH分泌受多种因素的调节,如维生素D、钙、磷、蛋白激酶、性腺类固醇类激素等。
PTH促进骨吸收和骨转换,动员骨钙入血,血钙升高。
研究表明,PTH对骨形成和骨吸收具有双重效应,PTH的生物效应取决于其作用剂量,在持续大剂量PTH的作用下,破骨细胞活性超过成骨细胞,导致骨丢失大于骨形成。
间歇性小剂量PTH促进骨形成。
PTH增高,见于原发性甲状旁腺功能亢进、异位性甲状旁腺功能亢进、继发于肾病的甲状旁腺功能亢进、假性甲状旁腺功能减退等。
PTH减低,见于甲状腺手术切除所致的甲状旁腺功能减退症、肾功能衰竭和甲状腺功能亢进所致的非甲状旁腺性高血钙症等。
测定血清PTH是诊断PTH相关性骨病的最重要指标,在判断和鉴别原发性和继发性甲状旁腺功能亢进时,可结合血钙、血磷和维生素D水平一起分析。
临床上诊断骨质疏松时,当血钙异常时,为查找原因常检测PTH,而当血钙正常时,通常不常规检测PTH,但血钙正常PTH也有升高现象。
1.2降钙素降钙素(CT)是一种重要的参与钙磷代谢调节的多肽类激素。
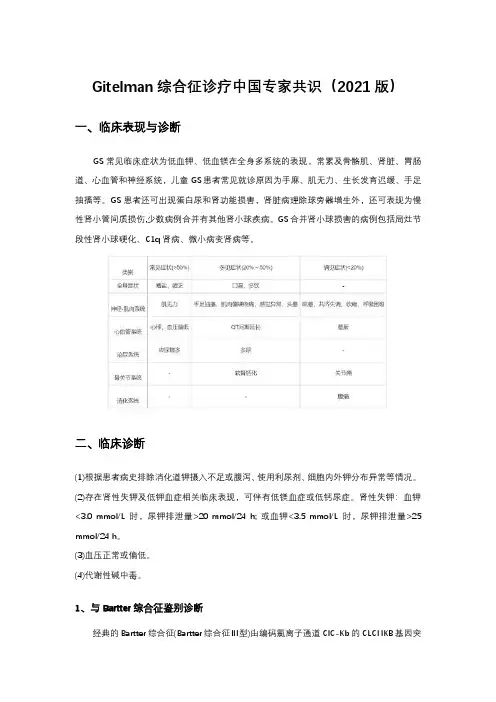
Gitelman综合征诊疗中国专家共识(2021版)一、临床表现与诊断GS常见临床症状为低血钾、低血镁在全身多系统的表现,常累及骨骼肌、肾脏、胃肠道、心血管和神经系统,儿童GS患者常见就诊原因为手麻、肌无力、生长发育迟缓、手足抽搐等。
GS患者还可出现蛋白尿和肾功能损害,肾脏病理除球旁器增生外,还可表现为慢性肾小管间质损伤,少数病例合并有其他肾小球疾病。
GS合并肾小球损害的病例包括局灶节段性肾小球硬化、C1q肾病、微小病变肾病等。
二、临床诊断(1)根据患者病史排除消化道钾摄入不足或腹泻、使用利尿剂、细胞内外钾分布异常等情况。
(2)存在肾性失钾及低钾血症相关临床表现,可伴有低镁血症或低钙尿症。
肾性失钾:血钾<3.0 mmol/L时,尿钾排泄量>20 mmol/24 h; 或血钾<3.5 mmol/L时,尿钾排泄量>25 mmol/24 h。
(3)血压正常或偏低。
(4)代谢性碱中毒。
1、与Bartter综合征鉴别诊断经典的Bartter综合征(Bartter综合征Ⅲ型)由编码氯离子通道ClC-Kb的CLCNKB基因突变所致,患者发病相对较早(多在3岁前),更易出现生长发育迟缓,血镁水平多正常,尿钙水平正常或偏高。
行氯离子清除试验,若患者对氢氯噻嗪试验有反应而对呋塞米试验无反应,将有助于临床诊断Bartter综合征,基因检测可进一步鉴别。
Gitelman综合征具体诊疗流程见图1。
2. 基因诊断针对SLC12A3基因的直接测序仍是目前使用最广泛的检测方法,但约8%~30%的患者仅可检测到单杂合突变,需进一步对内含子突变及基因大片段缺失和重复进行分析。
二代测序技术、MLPA和微阵列比较基因组杂交技术(aCGH) 逐渐用于诊断GS。
对一代测序仅有SLC12A3单杂合突变的患者,建议进一步行MLPA、全外显子组或全基因组二代测序寻找其他可能的变异位点,如条件允许可直接采用二代测序技术进行基因诊断。

2023恶性肠梗阻治疗中国专家共识(完整版)摘要:恶性肠梗阻是晚期肿瘤患者常见终末期事件,20%的肿瘤最终发展为恶性肠梗阻。
然而,恶性肠梗阻患者预后差,缺乏有效的治疗方法,恶性肠梗阻的诊疗路径、治疗策略、手术适应证和禁忌证、手术治疗能否获益等均是需要探索性的课题。
中国抗癌协会组织多位在恶性肠梗阻诊疗领域具有丰富临床经验的专家就恶性肠梗阻的定义、流行病学、病理生理、治疗原则和方法、疗效评价进行讨论,重新定义恶性肠梗阻,总结恶性肠梗阻发生、发展的病理生理机制,提出恶性肠梗阻“多学科会诊、分级诊疗、整合治疗和精准强化”治疗策略,明确手术适应证、手术方式、手术效果评价方法和指标,并对恶性肠梗阻手术治疗与药物治疗效果进行了评价。
《恶性肠梗阻治疗中国专家共识(2023年)》对提高恶性肠梗阻规范化治疗水平具有一定意义。
恶性肠梗阻(MBO)是晚期肿瘤患者常见终末期事件。
2007年,MBO国际会议和临床方案委员会明确MBO诊断标准[1]:①临床确诊为肠梗阻;②屈氏韧带以下梗阻;③腹膜转移;④不可治愈。
2018年,中国抗癌协会成立恶性肠梗阻学组,将“不可治愈”修订为“难以治愈”,意在强调MBO并非不治之症;2021年石汉平等主编的《恶性肠梗阻》出版。
首都医科大学附属北京世纪坛医院肿瘤营养代谢中心以MBO治疗为特色,组织中国抗癌协会该领域专家、学者讨论形成《恶性肠梗阻治疗中国专家共识(2023年)》o1恶性肠梗阻流行病学MBO在晚期肿瘤中的发生率为5%~43%,以卵巢癌发生风险最高(5%~51%)、胃肠肿瘤(10%~28%)次之⑵;MBo原发癌中,结直肠癌(25%~40%)、卵巢癌(16%~29%)和胃癌(6%~19%)为前三大癌肿⑶。
MBO 患者平均年龄61岁,女性多于男性(1.8:1),从肿瘤初次诊断到发生MBo,平均时间14个月[4]o2恶性肠梗阻病理、生理MBO可以是完全或不完全性肠梗阻,小肠梗阻占61%、大肠梗阻占33%、小肠和大肠双梗阻占20%,一段肠梗阻占20%、多段肠梗阻占80%,梗阻部位以回盲部、乙状结肠、结肠脾曲和小肠粘连于盆腔最常见[5]。

骨代谢生化指标临床应用专家共识(2023修订版)要点摘要:骨代谢生化指标的临床应用,为骨质疏松的诊断、鉴别诊断、预测骨折风险及抗骨质疏松治疗疗效评价提供了分子生物学依据,并在骨质疏松流行病学研究、发病机制、骨质疏松药物开发研究方面具有重要意义。
由于骨代谢生化指标检测特异性强、灵敏度高,其应用日趋广泛。
该文检索了大量中外文献,编审了《骨代谢生化指标临床应用专家共识》(2023修订版),对骨代谢生化指标的分类、骨代谢生化指标的方法学以及生物学意义、骨代谢指标的检测变异等进行了论述。
骨代谢生化指标分别来源于骨、软骨、软组织、皮肤、肝、肾、小肠、血液及内分泌腺体等,是由成骨细胞或破骨细胞分泌的酶和激素,以及骨基质的胶原蛋白代谢产物或^胶原蛋白。
通过检测血、尿中骨代谢生化指标水平,可以了解骨组织新陈代谢的情况,用于评价骨代谢状态、骨质疏松诊断分型、预测骨折风险、代谢性骨病的鉴别诊断。
骨代谢生化指标作为监测手段,评估骨质疏松治疗的反应。
目前临床上的检测方法包括:酶联免疫吸附测定(E1ISA)、化学发光免疫测定(CUA)、电化学发光免疫分析(EC1IA)、放射免疫分析(RIA)、免疫放射分析QRMA)、高效液相色谱(HP1e)等。
1骨代谢生化指标分类2骨代谢生化指标检测方法骨代谢生化指标检测主要实验方法有酶联免疫吸附测定、化学发光法、电化学发光法、放射免疫法和高效液相色谱法。
详见表2。
3骨代谢生化指标生物学意义3.1 钙磷代谢调节指标3.1.1 甲状旁腺素:甲状旁腺素(PTH)是由甲状旁腺主细胞合成分泌的、含有84个氨基酸的碱性单链多肽,维持机体钙磷平衡和调节骨代谢。
PTH增高,见于原发性甲状旁腺功能亢进、异位性甲状旁腺功能亢进、继发于肾病的甲状旁腺功能亢进、假性甲状旁腺功能减退等。
PTH减低,见于甲状腺手术切除所致的甲状旁腺功能减退症、肾功能衰竭和甲状腺功能亢进所致的非甲状旁腺性高血钙症等。
3.1.2 降钙素:降钙素(CT)是重要的参与钙磷代谢调节的多肽类激素。

从临床诊疗指南及专家共识角度看小于胎龄儿的诊断和治疗李冉;陈适;朱惠娟;潘慧【摘要】小于胎龄儿围生期患病率及病死率高,成年期发生代谢综合征风险增加,但目前国内尚且缺少小于胎龄儿的诊治共识,本文从定义、危险因素、生长激素治疗及治疗前后的评估与监测、其他治疗及小于胎龄儿的近期和远期并发症等方面进行总结,从而为临床工作中的诊断和治疗提供参考.%Infants of small-for-gestational-age have high rate of mortality and morbidity in perinatal period , high risk of metabolic syndrome in adult .However , there is a lack of consensus about the diagnosis and treatment of small-for-gestational age in China .We make a literature review for the definition , risk factors, growth hormone ther-apy, evaluation before and after growth hormone therapy , short-time and long-time complications of small-for-gesta-tional-age in all the clinical practice guideline and expert consensus available all over the world , aiming at providing useful information in clinical practice .【期刊名称】《基础医学与临床》【年(卷),期】2017(037)012【总页数】5页(P1756-1760)【关键词】小于胎龄儿;生长激素;追赶性生长;诊断;治疗【作者】李冉;陈适;朱惠娟;潘慧【作者单位】中国医学科学院北京协和医学院北京协和医院内分泌科卫生部内分泌重点实验室,北京100730;中国医学科学院北京协和医学院北京协和医院内分泌科卫生部内分泌重点实验室,北京100730;中国医学科学院北京协和医学院北京协和医院内分泌科卫生部内分泌重点实验室,北京100730;中国医学科学院北京协和医学院北京协和医院内分泌科卫生部内分泌重点实验室,北京100730【正文语种】中文【中图分类】R22小于胎龄儿(small for gestational age, SGA)不仅围产期病死率高,新生儿期并发症发生率也增加,其成年后发生代谢综合征及心血管疾病的风险较正常儿童也显著增加。

2020年注意缺陷多动障碍早期识别、规范诊断和治疗的儿科专家共识(完整版)注意缺陷多动障碍(attention deficit hyperactivity disorder, ADHD)是一种常见的慢性神经发育障碍,起病于童年期,影响可延续至成年,其主要特征是与发育水平不相称的注意缺陷和(或)多动冲动。
全球儿童发病率约为7.2%,60%~80%可持续至青少年期,50.9%持续为成人ADHD。
约65%的患儿存在一种或多种共患病。
ADHD不仅损害学习功能,还存在其他多方面、涉及生命全周期的损害。
早期识别、诊断和规范治疗可显著改善ADHD的预后。
据统计,我国儿童ADHD患病率为6.26%(约2 300万人),但就诊率仅10%左右,提示家长及社会宣传、医务人员培训不够。
2006年中华儿科杂志发表的"儿童注意缺陷多动障碍诊疗建议"为指导和规范我国儿童ADHD诊治发挥了重要作用,但是近年来ADHD的复杂性逐渐被认识到,其诊断标准以及治疗干预有很大进展,ADHD诊疗方案需相应更新。
由于我国儿童精神科医师短缺,大量ADHD患儿常首诊于全科医师、儿童保健医师和发育行为儿科医师。
而我国发育行为儿科医师人数不足,儿童保健医师和全科医师缺乏相关培训。
2015年中华医学会精神医学分会组织出版的"中国注意缺陷多动障碍防治指南"第二版进一步从精神专业角度系统讲授了ADHD防治的相关内容,但相关儿科医务人员对指南理解应用不够,源自儿科临床实践的诊疗共识将更有利于提高发育行为儿科医师、儿童保健医师和全科医师针对各种罹患ADHD 的高危儿童进行长期监测、定期筛查和家校宣教的意识,提高诊疗能力。
因此,中华医学会儿科学分会发育行为学组经过2年多次反复讨论,邀请儿童精神医学专家、儿童神经内科专家参与,参照国际最新进展,结合我国儿科临床实践特点,达成以下临床实践专家共识,旨在提高我国儿童及妇幼三级卫生服务体系ADHD 早期识别、诊断及治疗的规范性和同质性。

文章编号1006-8147(2021)01-0088-02作者简介许庆玲(1991-),女,医师,硕士,研究方向:儿童内分泌;通信作者:郑荣秀:E-mail:**************.cn 。
重组人生长激素治疗德朗热综合征1例许庆玲,张淑欣,郑荣秀(天津医科大学总医院儿科,天津300052)关键词德朗热综合征;重组人生长激素;幼儿中图分类号R725文献标志码B德朗热综合征(CdLS )又称为阿姆斯特丹侏儒症,是主要由参与姐妹单体内聚的基因突变引起的罕见常染色体显性遗传疾病。
其典型临床表现为特殊面容,宫内及出生后生长发育迟缓,肢体畸形及认知障碍。
在活婴中的发病率约为1/30000~1/10000[1]。
由于该病临床表现的多样性及临床医生的认识不足,许多患者仍未被诊出。
目前国内对该病的报道大多数为新生儿,且尚无CdLS 予以重组人生长激素(rhGH )治疗的报道,本文主要介绍了1例2岁5个月幼儿的临床资料及予以rhGH 治疗的效果,以加深临床医生对此病的认识。
1临床资料患儿,女,2岁5个月,主因“自幼特殊面容,生长发育迟缓”入院。
患儿自幼面容异常,浓眉,弓形眉,睫毛长而卷,长人中,小下颌,无唇裂、腭裂,无舌大宽厚,无表情呆板及淡漠,出生身长39cm ,1岁时身高62cm ,2岁时70cm ,目前身高为75cm ,生长速率正常,语言发育落后,现只会喊“爸爸,妈妈”。
母亲孕32周查超声提示胎儿偏小,行核磁提示胎儿发育异常,因胎儿S/D 比值高,予硫酸镁保胎治疗。
患儿为36+4周的早产儿,G1P1顺产,出生体重1.9kg ,当时因“早产小于胎龄儿,新生儿黄疸”住院治疗14d ,无特殊检查及治疗。
患儿4个月抬头,8个月翻身,1岁独坐,1岁2个月出牙,1岁6个月走路,语言发育落后。
父亲30岁,身高160cm ,自述体健。
母亲29岁,身高158cm ,自述体健,非近亲结婚,家族中无类似病史。
查体:体温36.6℃,心率100次/min ,呼吸23次/min ,血压89/58mmHg ,身高75cm (第3百分位数下9cm ),体重7.5kg (第3百分位数下2.5kg ),上部量45cm ,下部量30cm ,上部量:下部量比为1.5∶1,指尖距70cm ,头围43cm 。


过渡期生长激素缺乏症诊断及治疗专家共识(2020完整版)过渡期是指从青春期后期线性生长结束(生长速率<1.5~2.0 cm/年)到完全成熟为成年个体之间的阶段,此阶段的青少年仍然处于生理、心理各个方面转变的时期,线性身高增长停止但体成分进一步改善,骨量逐渐达到峰值,此阶段历时6~7年[1]。
在此期间发生或由儿童期完全性生长激素缺乏症(growth hormone deficiency,GHD)延续而来仍持续存在的称为过渡期生长激素缺乏症(transition growth hormone deficiency,TGHD)。
TGHD如终止重组人生长激素(recombinant human growth hormone,rhGH)替代治疗,可能导致过渡期或成年期出现多种并发症,因此应该考虑持续使用rhGH替代治疗[2]。
鉴于此部分患者最初由儿科医生诊治,因此儿科医生有必要尽早向患者提供过渡期的医学资讯,并与成人内分泌科医生密切合作,帮助患者顺利过渡到成人阶段。
但TGHD的诊断、治疗仍缺少共识指导,在实践应用中易产生困惑,可能导致TGHD诊断延误、治疗不足及轻易停药。
为逐步完善TGHD患者的诊治和管理,中华医学会儿科学分会内分泌遗传代谢学组和中华儿科杂志编辑委员会组织有关专家,在参考国内外最新研究成果和诊断及治疗指南的基础上,制定本共识。
旨在帮助儿科内分泌专业医生对TGHD进行规范诊断及治疗,也为成人内分泌科医生参与过渡期管理提供参考。
由于TGHD以往认识不多,缺乏大型研究数据,尤其是临床随机双盲对照研究和高质量Meta分析研究,因此在本共识中未标注证据等级。
但为便于临床实践应用,根据学组专家讨论,在本共识中以推荐等级表示,以期规范其临床应用,更好地服务于临床。
将推荐等级分为强、中、弱及专家意见4类(推荐强度强:国际学会指南强推荐,有循证证据;推荐强度中:国际学会指南中等推荐,暂无循证依据,但学组≥80%专家同意;推荐强度弱:国际学会指南弱推荐,暂无循证依据,但学组≥80%专家同意;专家意见:国际学会指南有专家意见,暂无循证依据,但学组≥80%专家同意)。
一、TGHD的评估及诊断(一)TGHD的常见病因和主要表现大多数TGHD是由儿童期完全性GHD延续而来。
影像学证实鞍区和(或)鞍上区先天性结构异常、获得性下丘脑-垂体疾病如颅咽管瘤、直接影响下丘脑-垂体区域的手术或大剂量放疗以及由明确基因变异导致的生长激素分泌功能异常者为TGHD高度疑似,可能存在永久性GHD(推荐强度:中)。
部分TGHD是由于下丘脑和(或)垂体结构破坏或功能损害导致在达到终身高后才发生的GHD的症状和表现。
在过渡期初发的GHD 临床表现通常是非特异性的,但长时间的生长激素缺乏会导致包括肌肉组织减少、脂肪组织增加、向心性肥胖等身体组分的改变,血清总胆固醇、低密度脂蛋白胆固醇和甘油三酯水平升高,高密度脂蛋白胆固醇水平降低等脂质代谢异常[3,4],胰岛素抵抗、心血管疾病风险增加[3,5],骨量减少、骨密度降低[6],疲劳、虚弱、精力不济、情绪低落、记忆力下降、生活质量差等改变(推荐强度:强)[2,7]。
TGHD如为多垂体激素缺乏,可伴有其他垂体激素缺乏的表现,如性腺发育落后等。
但对远期并发症的研究集中在成人生长激素缺乏症(adult growth hormone deficiency,AGHD)患者,TGHD远期并发症的研究甚少,需要尽快开展大样本、多中心、长时间的队列研究来进一步明确。
(二)TGHD的评估儿童期特发性孤立性GHD,尤其是部分性GHD患者,有相当一部分在过渡期或成年期生长激素分泌趋于正常,足以维持机体代谢需求,因此在过渡期再次进行生长激素激发试验非常重要,以决定是否需要持续rhGH治疗(推荐强度:强)[8,9]。
建议儿童期诊断的特发性GHD患儿(非高度怀疑TGHD者)在女童骨龄14~15岁,男童骨龄16~17岁(此时往往身高已达到成年终身高的98%~99%),在正规使用rhGH治疗情况下生长速率<1.5~2.0 cm/年,选用至少一种生长激素激发试验重新评估生长激素分泌水平(推荐强度:中)[10]。
考虑到rhGH对类胰岛素样生长因子1(insulin-like growth factor-1,IGF-1)的影响,在重新评估之前停用rhGH 1~3个月,但如临床高度怀疑TGHD者也需注意长时间停用rhGH产生的不良后果(推荐强度:弱)[11]。
而对临床高度疑似TGHD者,如存在多种垂体激素缺乏,在排除其他慢性疾病后IGF-1水平低于均值-2 s,则无需重新评估生长激素分泌水平,直接给予rhGH治疗(推荐强度:中)[12]。
(三)TGHD评估方法对于TGHD患者,公认可行且有效的生长激素激发试验研究较少。
普遍认为TGHD生长激素分泌状态评估首选胰岛素耐量试验(insulin tolerance test,ITT)(推荐强度:强)[2,13]。
由于ITT可诱发低血糖,故禁用于存在心脑血管疾病及癫痫发作风险的患者。
如ITT实施有禁忌,美国临床内分泌协会推荐可以使用胰高血糖素试验和醋酸马西瑞林激发试验代替(推荐强度:中),欧洲内分泌协会推荐使用生长激素释放激素+精氨酸复合试验代替(推荐强度:中)[11],但这几种药物在国内获取困难、实际使用经验过少。
少量文献报道使用单一精氨酸试验作为替代检查[14],但没有经过系统的评估和验证,其灵敏度和特异度在AGHD和TGHD患者中均较低,不常规推荐作为TGHD诊断试验,如选择其作为诊断方法,切值应放在0.4 μg/L[15]。
此外,在儿童生长激素缺乏症(childhood growth hormone deficiency,CGHD)诊断中常用的可乐定、左旋多巴等激发试验在AGHD及TGHD中的诊断效率和精确度更为低下,不推荐作为TGHD的诊断试验(推荐强度:中)[2];吡啶斯的明+左旋多巴、精氨酸+左旋多巴复合试验在TGHD的诊断效率也需要更多的评估和验证(专家意见)。
具体诊断流程见图1。
需要强调的是,不同实验室的生长激素和IGF-1检测差异度较大,建议不同医疗机构建立各自的实验室参考标准(推荐强度:弱)[2]。
二、TGHD治疗rhGH用于GHD,除了在儿童期可促进线性生长外,还可让TGHD 患者获得成年后正常体成分的维持及糖脂代谢平衡等益处。
因此对于TGHD患者,需要考虑长期甚至终生使用rhGH替代治疗,尽量避免在过渡期由于身高增长的停止而中断rhGH治疗(推荐强度:强)[16]。
同时也需要特别关注rhGH滥用的问题,需要在谨慎评估患者的临床表现及实验室结果后,规范使用rhGH替代治疗[9]。
(一)rhGH治疗剂量及调整1.初始剂量、剂量调整及监测一旦确诊为TGHD患者,应考虑立即开始治疗或将CGHD治疗剂量逐渐过渡到成人期。
由CGHD延续而来的TGHD,rhGH的起始剂量为原使用剂量的50%(专家意见);过渡期始发的TGHD,rhGH的起始剂量0.4~0.5 mg/d;对已诊断肥胖症、糖尿病或糖代谢异常的TGHD患者,建议rhGH的初始剂量为0.1~0.2 mg/d(推荐强度:强)[2];如同时存在多种激素缺乏,在使用rhGH前需进行规范的糖皮质激素、甲状腺激素等替代(推荐强度:中)。
对于颅咽管瘤等儿童青少年高发的鞍区占位性病变患儿,建议在手术治疗后1年无临床及影像学复发或进展迹象后,才考虑rhGH应用[17],但需结合肿瘤科医生意见根据不同肿瘤类型进行rhGh使用前的评估(专家意见)。
rhGH的吸收利用和药物敏感性的个体差异很大,临床医师需要重视rhGH应用的个性化、渐进化的药物调整方案(推荐强度:强)。
确诊TGHD前未使用rhGH治疗的患儿建议从小剂量开始,每隔1~2个月,根据临床表现改善情况、IGF-1水平、不良反应等调整剂量,可按照0.1~0.2 mg/d的剂量调整,保持IGF-1水平在同年龄同性别正常范围上限(0~2 s)(推荐强度:强)[2,18]。
达到维持剂量后,建议至少每隔3~6个月监测1次[2]。
监测项目包括临床症状改善情况、药物不良反应、体质指数、腰围、腰臀比、血清IGF-1水平、甲状腺功能、糖化血红蛋白(glycosylated hemoglobin, HbA1c)、空腹血糖、空腹血脂等;双能量X线片吸收法(dual-energy X-ray absorptiometry,DEXA)体成分测量等检查可按照患儿具体情况进行检查和复测(推荐强度:弱);至少6个月评估1次血脂水平、心脏超声、颈动脉内膜中层厚度等评估心血管不良事件风险(推荐强度:弱);每6~12个月进行1次生活质量评估(推荐强度:弱);若治疗初始阶段DEXA扫描骨密度异常,建议每1年复查1次;若成年期继续用药,仍建议定期复查(推荐强度:弱);下丘脑垂体肿瘤术后残余或垂体微腺瘤患儿建议每6~12个月复查鞍区磁共振成像(专家意见);同时接受糖皮质激素、甲状腺激素和性激素替代疗法的患儿在开始rhGH治疗后应及时调整剂量,待稳定后仍继续维持至少6个月1次的复查(推荐强度:中)。
建议确诊TGHD后持续用药至成人期,然后重新评估诊断AGHD,以决定是否继续rhGH应用(推荐强度:中);如患者因个人原因决定停药,需在停药6个月后随访观察是否出现TGHD的临床症状(推荐强度:中)。
2.rhGH剂量影响因素(1)TGHD患者的rhGH治疗剂量受多种因素影响,最为明显的是青春期生长激素生理分泌显著增加和成年后生长激素分泌随年龄逐渐下降[19]。
青春期女童分泌的生长激素比男童更多,可能与女童体内较高水平的雌激素相关。
因此,建议青春期女童给予更大的rhGH用量(推荐强度:中)。
对于极个别在过渡期妊娠的患者,由于没有足够的依据证实其生长激素的妊娠期变化,因此可以考虑维持原有剂量,根据患者的临床表现进行剂量的调整。
(2)肥胖人群内源性生长激素分泌较正常人群降低,但其肝脏生长激素受体相应上调,以维持血清IGF-1水平在正常或正常低限[20]。
对于TGHD肥胖患者给予小剂量rhGH治疗反而可以提高其胰岛素敏感性[21]。
建议初始诊断的肥胖TGHD患者,rhGH起始量为0.1~0.2 mg/d,以减少糖代谢紊乱的发生率(推荐强度:强)。
(3)联合用药方面,TGHD,尤其是过渡期发生的TGHD,常见原因是下丘脑和(或)垂体结构破坏或功能损害,往往同时伴有其他垂体激素的缺乏,需要肾上腺皮质激素、甲状腺素、性激素的替代治疗。
因此,在rhGH治疗前后,应对垂体其他激素水平进行定期监测并正规替代(推荐强度:强)。
由于GHD可能会掩盖肾上腺皮质功能不全,故在rhGH治疗前应仔细评估患者的下丘脑-垂体-肾上腺轴功能。