课堂7-3典型复杂反应动力学分析概论
- 格式:ppt
- 大小:631.00 KB
- 文档页数:48



复杂反应动力学第七章讨论的只是简单反应的动力学规律。
然而实际的化学反应并不都是一步完成的基元反应,大多数的化学反应是经过若干步才完成的。
由若干个基元步骤组成的化学反应称为复杂反应。
由这些基元反应组合便构成反应所经过的途径,在动力学上称之为反应机理(历程)。
既然复杂反应(总包反应)是由数个基元反应按一定次序组合而成,故本章将在基元反应动力学的基本规律的基础上讨论复杂反应的动力学特征。
显然,这两者之间存在必然的密切联系。
讨论这种联系必须遵守“基元反应独立共存原理”,即某一基元反应的速率常数及其动力学规律,不因是否同时存在其它基元反应而有所改变。
这就是说,在复杂反应中的各个基元反应独立进行,互不影响。
例如:(1)A+B C+D,k1,n1=2(2)D+E P,k2,n2=2(3) P R,k3,n3=1此三个基元反应构成A与B及E反应生成R的复杂反应,其中各个基元反应都是独立进行的。
若同一基元反应处于不同的复杂反应之中,其动力学特征是否发生改变?答案是否定的,其特征并不改变。
究其原因是其它反应的进行,只能影响该基元反应中各参与物的浓度,而浓度的改变只能影响其反应速率并不能改变速率常数,反应分子数及反应级数。
最简单的复杂反应,是只由涉及同一物种物的两个基元反应组成,也称典型复杂反应。
更为复杂的复杂反应则是若干个典型复杂反应组合而成,其动力学规律应源于典型复杂反应,故先讨论之。
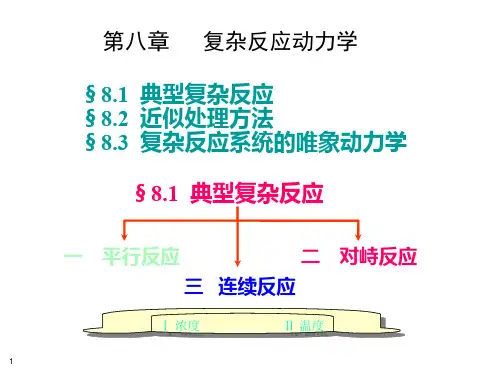
§8.1典型复杂反应对于同一物种的两个基元反应,按组合方式(连接次序与形式)不同可分为三种:对峙反应,平行反应和连续反应等基本类型。
1.1 parallel reaction由相同的反应物在相同条件下同时同向(“四同”:同反应物同条件,同时同向)进行若干个不同的基元反应,便构成平行反应亦称同时反应(simultaneous side reaction)。
这些基元反应互相独立,但互为依存条件,因缺少对方便不是骈(pián)枝反应。




化学反应动力学解析复杂反应过程化学反应动力学是研究化学反应速率以及反应速率与相关因素之间关系的学科。
在化学反应中,复杂反应过程涉及多个物质之间的相互作用,反应速率的确定需要考虑多种因素。
解析复杂反应过程涉及到对反应机制、反应速率常数以及影响反应速率的因素的研究和分析。
复杂反应过程的解析可以通过化学反应动力学的研究方法来实现。
首先,确定反应的整体速率方程是解析复杂反应过程的关键。
通过实验观察反应物和生成物之间的摩尔比例关系,可以确定反应的整体速率方程。
例如,当反应物 A 和 B 反应生成产物 C 和 D 时,可以通过测量各种摩尔浓度变化率来确定整体速率方程。
然而,复杂反应过程的解析并不仅仅依靠整体速率方程。
为了更加细致地了解反应机制和反应速率的变化,需要深入研究反应的分步过程。
这通常通过实验观察中间物种的形成和消失来实现。
中间物种是反应中的过渡化合物,其生成和消失对整个反应的速率有重要影响。
通过测量中间物种的浓度和速率,可以确定反应的分步过程和速率常数。
在解析复杂反应过程时,温度对反应速率的影响是一个重要的因素。
温度的增加可以提高分子的平均动能,增加碰撞频率和碰撞能量,从而加快反应速率。
温度对反应速率的影响可以通过改变反应速率常数的值来解释。
阿伦尼乌斯方程是描述反应速率常数和温度之间关系的经验公式,可以用来预测温度对反应速率的影响。
此外,反应物浓度和反应物的物理性质也会对反应速率产生影响。
当反应物浓度较高时,它们之间的碰撞频率增加,从而提高反应速率。
此外,反应物的分子大小、形状和化学性质也会影响反应速率。
通过改变反应物的浓度和性质,可以对复杂反应过程进行解析,进一步理解反应机制。
光照、催化剂和溶液浓度等因素也会对复杂反应过程的解析产生重要影响。
光照可以通过激发反应物的电子能级来促进反应。
催化剂可以降低反应的活化能,加速反应的进行。
溶液浓度调节可以改变反应物的环境条件,进而改变反应速率。
综上所述,化学反应动力学是解析复杂反应过程的重要工具。