2014年高考化学二轮复习:反应热与盖斯定律ppt课件
- 格式:ppt
- 大小:1.49 MB
- 文档页数:51
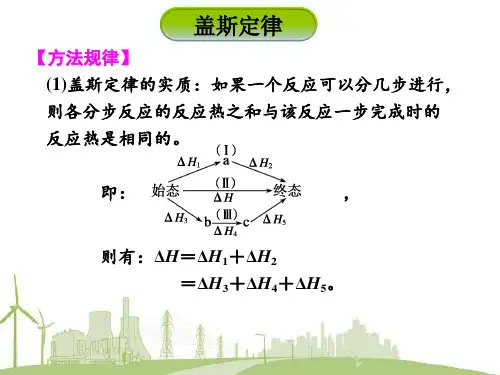







反应热&盖斯定律讲义(学霸版)课程简介:即PPT(第1页):本节课我们主要学习:反应热&盖斯定律。
反应热&盖斯定律是化学反应原理的一个分支,高考出题主要为盖斯定律的计算应用,很简单,属于送分题目。
反应热&盖斯定律主要内容是理解清楚反应热的相关概念,掌握盖斯定律的计算方法。
这部分知识点相对简单好懂,学习时把概念的关键点注意好即可。
准备好了么?Let’s go!PPT(第2页):先来了解一下反应热&盖斯定律的知识特点。
1、“简单好懂,注意概念的关键点”;2、“理解为主,方法好掌握”。
1、反应热&盖斯定律的知识点很简单,认真听很快就能懂。
学习时需要牢记好概念的细节,这是比较容易疏忽导致出错的地方,只要抓好概念的关键点,妥妥的拿下概念辨析题。
2、反应热&盖斯定律的内容虽然比较形象,但还是有一定的逻辑推理,因此这里除了牢记概念的关键点外,也注重方法的理解,只要认真听,方法都好掌握,举一反三,so easy。
PPT(第3页):现在我们正式进入反应热&盖斯定律的学习。
PPT(第4页):看,这就是反应热&盖斯定律的知识网络图。
我们按化学能与热能、反应热、盖斯定律3个分支来一一讲解。
PPT(第5页):先来看下化学能与热能。
化学反应的本质是旧化学键断裂,新化学键形成的过程。
在这个过程中断键需要吸收能量,成键会释放能量,由于二者的能量差异,因此化学反应在发生物质变化的同时往往伴随着能量的变化,而能量变化通常表现为热量变化,因此一个化学反应不是放热就是吸热。
若断键吸收的能量>成键释放的能量,则该反应为吸热反应;若断键吸收的能量<成键释放的能量,则该反应为放热反应。
如果从总能量的角度来分析,各种物质都储存有化学能,且不同物质所储存的化学能不同;若反应物总能量>生成物的总能量,由于能量守恒,反应物多出的能量只能释放出来,因此是放热反应;同理,若反应物总能量<生成物总能量,由于能量守恒,生成物多出的能量只能吸收而来,因此是吸热反应。

2014年高考生物二轮复习:反应热与盖斯定律综合检测时间:60分钟分值:100分一、选择题(共14小题)1.(2012·重庆理综,12)肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示。
已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O==O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是( )A.194 B.391 C.516 D.658解析:由题中的图像可以看出断裂1 mol N2H4(g)和1 mol O2(g)中的化学键所要吸收的能量为:2 752 kJ-534 kJ=2 218 kJ设断裂1 mol N—H键所需要的能量为x则:154 kJ+4x+500 kJ=2 218 kJ解得x=391 kJ答案:B2.(2012·大纲全国卷,9)反应 A+B―→C(ΔH<0)分两步进行:①A+B―→X (ΔH>0),②X―→C(ΔH<0)。
下列示意图中,能正确表示总反应过程中能量变化的是( )解析:根据反应物和生成物能量的高低来分析、解决问题。
化学反应都伴随能量变化,当反应物的总能量高于生成物的总能量时,该反应为放热反应;当反应物的总能量低于生成物的总能量时,该反应为吸热反应。
反应①的ΔH>0,为吸热反应,故可排除A项和C项。
反应②的ΔH<0,为放热反应,B项错误,故选D。
答案:D3.(2012·江苏,4)某反应的反应过程中能量变化如图所示(图中E 1表示正反应的活化能,E 2表示逆反应的活化能)。
下列有关叙述正确的是 ( )A .该反应为放热反应B .催化剂能改变该反应的焓变C .催化剂能降低该反应的活化能D .逆反应的活化能大于正反应的活化能解析:解本题的关键是正确理解图像的意义。
不难看出,E 1>E 2,正反应的活化能大于逆反应的活化能,ΔH =E 1-E 2>0,故该反应为吸热反应,故A 、D 均错。

