第二节水的电离和溶液的酸碱性(第1课时)教案
- 格式:doc
- 大小:84.00 KB
- 文档页数:3

云南省高中化学 3.2.2水的电离和溶液的酸碱性(第二课时)教案新人教版选修4一、内容及其解析1、 内容:水的电离、溶液的酸碱性与溶液的PH 。
2、 解析:学习水的电离以及影响水的电离的因素、水的离子积,,c (H +)、PH 与溶液酸碱性的关系。
二、目标及其解析 1、目标:(1)、了解水的电离和水的离子积 (2)、了解溶液的酸碱性与pH 的关系 2、解析: (1)、通过学习知道水的电离和水的离子积和离子积常数,知道水的电离受其他因素的影响。
(2)要求懂得溶液的酸碱性与pH 的关系及PH 的测定方法,学会用PH 的理论进行有关溶液PH 的计算。
三、教学问题诊断分析1、教学重点:水的离子积,溶液酸碱性和溶液pH 值的关系2、教学难点:水的离子积,有关溶液PH 的简单计算。
四、教学过程: 引入:水是不是电解质?研究电解质溶液时往往涉及溶液的酸碱性,而酸碱性与水的电离有密切的关系。
那么水是如何电离的呢?精确的实验证明,水是一种极弱的电解质,它能微弱地电离,生成H 3O + 和OH —: 一、水的电离(第一课时) 1、水的电离H 2O + H 2O H 3O + + OH — 简写为:H 2O H + + OH—实验测定:25℃ [H +]=[OH -]=1710-⨯mol/L 100℃ [H +] = [OH -] = 1610-⨯mol/L水的电离与其它弱电解质的电离有何异同?不同点:水是“自身”作用下发生的极微弱的电离。
相同点:均是部分电离,存在电离平衡提问:请学生计算水的浓度,1L 纯水的物质的量是55·6mol ,经实验测得250C 时,发生电离的水只有1×10-7mol ,二者相比,水的电离部分太小,可以忽略不计。
因此电离前后水的物质的量几乎不变,可以视为常数,常数乘以常数必然为一个新的常数,用K w 表示,即为水的离子积常数,简称水的离子积。
2、水的离子积K w = c (H +)·c (OH —)由于250C 时,c (H +)= c (OH —)= 1×10-7mol/L所以250C 时,K w = c (H +)·c (OH —)=1×10-14(定值)(省去单位)提问:当温度升高时,K w 如何变化?影响K w 的因素是什么?(电离过程是吸热过程)1000C 时,K w = c (H +)·c (OH —)=1×10-12影响因素:温度越高,Kw 越大,水的电离度越大。

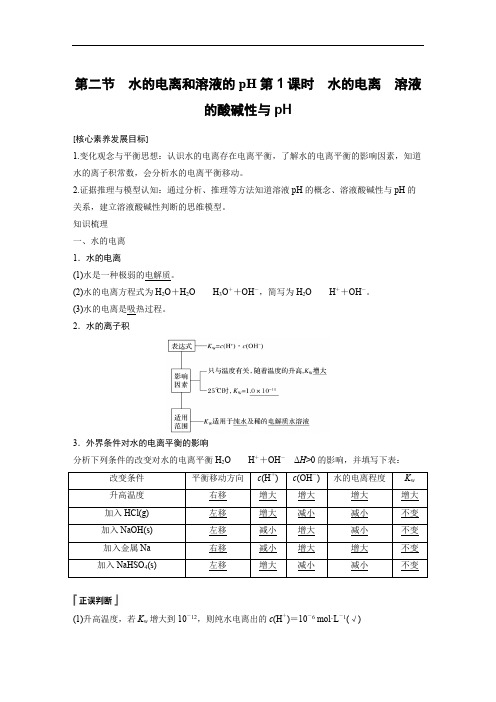
第二节水的电离和溶液的pH第1课时水的电离溶液的酸碱性与pH[核心素养发展目标]1.变化观念与平衡思想:认识水的电离存在电离平衡,了解水的电离平衡的影响因素,知道水的离子积常数,会分析水的电离平衡移动。
2.证据推理与模型认知:通过分析、推理等方法知道溶液pH的概念、溶液酸碱性与pH的关系,建立溶液酸碱性判断的思维模型。
知识梳理一、水的电离1.水的电离(1)水是一种极弱的电解质。
(2)水的电离方程式为H2O+H2O H3O++OH-,简写为H2O H++OH-。
(3)水的电离是吸热过程。
2.水的离子积3.外界条件对水的电离平衡的影响分析下列条件的改变对水的电离平衡H2O H++OH-ΔH>0的影响,并填写下表:改变条件平衡移动方向c(H+)c(OH-)水的电离程度K w升高温度右移增大增大增大增大加入HCl(g)左移增大减小减小不变加入NaOH(s)左移减小增大减小不变加入金属Na右移减小增大增大不变加入NaHSO4(s)左移增大减小减小不变(1)升高温度,若K w增大到10-12,则纯水电离出的c(H+)=10-6 mol·L-1(√)(2)在纯水中加入少量酸,水的电离平衡向逆向移动,K w 减小(×)(3)25 ℃时,若溶液中c (H +)=1.0×10-6 mol·L -1,则溶液中c (OH -)=1.0×10-8mol·L -1(√) (4)25 ℃时,水的离子积K w =1.0×10-14,35 ℃时水的离子积K w =2.1×10-14,则35 ℃时水中的c (H +)>c (OH -)(×) (5)25 ℃时,0.01 mol·L-1的盐酸中,由水电离出的c (OH -)=1.0×10-12mol·L -1(√)1.常温下,某溶液中由水电离出来的c (H +)=1.0×10-11mol·L -1,该溶液可能是________。

其次节水的电离和溶液的酸碱性第1课时水的电离和溶液的酸碱性●课标要求1.知道水的离子积常数。
2.初步把握pH测定的方法,知道溶液pH的调控在工农业生产和科学争辩中的重要应用。
●课标解读1.了解水的电离及水的离子积常数。
2.了解溶液的酸碱性与pH的意义。
●教学地位本课时介绍了水是一种弱电解质,在确定条件下水的离子积是常数。
了解测定溶液pH的方法。
利用pH,c(H +),c(OH-)等推断水溶液的酸碱性是本章的基础。
●新课导入建议追求健康长寿是人类共同的愿望。
人们首先要拥有健康,才有可能获得财宝、地位和幸福。
健康从哪里来呢?水是生命之源,假如没有水,就不行能有生命。
风靡日本、欧美等国的活性离子水是一种高品质的饮用水。
离子水比一般水分子团直径小,渗透作用快,有利于消退体内过多的自由基,能够延缓机体年轻,且对多种疾病有预防和挂念治疗的作用。
它的诞生,在全世界掀起了一场饮水领域的革命,善待生命,从水开头。
你知道水中有哪些粒子吗?【提示】水中有H2O、H+、OH-三种微粒。
●教学流程设计课前预习支配:(1)看教材P45~46,填写【课前自主导学】中的“学问1,水的电离”,并完成【思考沟通1】;(2)看教材P46~47页,填写【课前自主导学】中的“学问2,溶液的酸碱性与pH”,并完成【思考沟通2】。
⇒步骤1:导入新课并对本课时教材地位分析。
⇒步骤2:建议对【思考沟通1、2】多提问几个同学,使80%以上的同学都能把握该内容,以利于下一步对该重点学问的探究。
⇓步骤5:在老师指导下同学自主完成【变式训练1】和【当堂双基达标】中的1、4、5三题,验证同学对探究点的理解把握状况。
⇐步骤4:老师通过【例1】和教材P45~46页的讲解研析,对“探究1”的内容进行总结。
⇐步骤3:师生互动完成“探究1,影响水电离平衡的因素及水的离子积”可利用【问题导思】的设问由浅入深的进行,建议老师除【例1】外,再变换一下命题角度,可接受【老师备课资源】,以拓展同学的思路。

第二节水的电离和溶液的酸碱性(第一课时)教案茌平二中【课程分析】本节内容是以水的电离为突破口,理解影响溶液酸碱性的本质因素。
通过水的离子积的导出过程,加深学生对弱电解质电离平衡的理解,找到溶液发生酸碱性变化的平衡点。
水的电离平衡移动及溶液的离子积的教学,可使学生理解酸碱性的本质,从而进一步使学生理解溶液的酸碱性、溶液的pH、盐类的水解以及电解食盐水等知识的基础。
【学情分析】学生已经学习了电解质的有关知识,知道了电解质在水分子的作用下可以发生不同程度的电离,弱电解质存在电离平衡。
但对于水是一种极弱的电解质,并不熟悉。
另外,学生对于化学平衡常数、电离常数的知识比较熟悉,知道影响平衡常数的因素只有温度,即化学平衡常数是温度的函数,为学习水的离子积常数奠定了基础。
【课程目标】【知识与技能】1.知道水的离子积常数的含义。
2.学会判断溶液的酸碱性。
3.了解测定溶液pH的方法,能进行pH的简单计算。
【过程与方法】通过水的电离平衡分析,提高分析、解决问题的能力。
体会合作交流和讨论的学习方法。
【情感、态度与价值观】通过水溶液中H+与OH-互相依存、互相制约的关系的分析,树立矛盾的对立统一的辩证唯物主义世界观和方法论。
【教学重点】水的离子积,溶液中c(H+) 、pH与溶液酸碱性的关系。
【教学方法】理论推理拓展法、自学讨论法、归纳总结法、实验探究法。
【教学模式】“问题组式”教学。
把内容划分为几个阶段,每个阶段按“教师创设问题情景-----学生思考或讨论-------得出正确结果”的教学思路进行。
【教学过程】[引入]农夫山泉“弱碱性水”广告视频,今天我们就来探究溶液的酸碱性。
[板书] 第二节水的电离和溶液的酸碱性[提出问题]水能否发生电离?[学生活动]问题组一纯水导电实验实验目的:探究纯水是否电离及电离程度的大小。
[板书]一、水的电离1.水的电离[师生互动]多媒体演示水的电离过程。
[学生活动]写出水的电离方程式。
[学生活动]思考与讨论:写出水的电离常数表达式,推导水的离子积常数。

水的电离和溶液的酸碱性〔教案〕水的电离和溶液的酸碱性〔教案〕水的电离和溶液的酸碱性〔教案〕第一课时课程目的:1、理解水的离子积的含义2、掌握影响水电离平衡的因素 3、判断溶液酸碱性的根据 4、 pH值与溶液酸碱性的关系一、水的电离 1、水是一种极弱的电解质,能微弱的电离: H2O+H2O H3O+ + OH –简写为 H2O H+ + OH –根据水的电离平衡,写出相应的.平衡常数表达式_________ c (H+)·c (OH-) c (H2O) K电离= 1L H2O的物质的量为55.6moL,即H2O的浓度为55.6moL/L ,可视为常数c (H+)·c (OH –)=K电离·c (H2O) K电离与常数c (H2O)的积叫做水的离子积常数,用KW 表示 KW =c (H+)·c (OH–) 讨论:25℃时,水电离出来的[H+]=[OH—]=10—7mol/L ,说明水的电离程度如何?水是一种极弱的电解质〔通常的电流表无法检验其中离子〕问题考虑 1、水的电离是吸热反响还是放热反响?KW与什么因素有关? 2、水的离子积为多少? 3、条件改变对水的电离平衡及Kw的影响〔1.T;2.参加酸或碱;3.参加NaHSO4〕 T升高参加少量盐酸参加少量NaOH 参加NaHSO4 c (H+) c (OH –)平衡挪动方向 KW变化情况 H2O的电离程度归纳:①电离常数是表示弱电解质电离趋势的物理量。
K值越大,电离趋势越大。
②一种弱电解质的电离常数只与温度有关,而与该弱电解质的浓度无关。
③任何溶液中由水电离的c (H+)与c (OH –)总是相等的④H2O中加酸或加碱均能抑制H2O的电离,但水的离子积不变二、溶液的酸碱性水的离子积不仅适用于纯水,也适用于酸、碱、盐稀溶液 KW =c (H+)总·c (OH –) 总=1×10-14〔常温〕问题考虑 1、水中参加酸或者碱之后溶液中c (H+)与c (OH –)是否相等?2、酸性溶液中是否存在H+,碱性溶液中是否存在OH –?3、由上表分析^p 在酸性溶液中c (H+)与c (OH –)大小:碱性溶液中c (H+)与c (OH –)大小。
【课题】《水的电离和溶液的酸碱性》第1课时水的电离一、教材分析本节教材分为两部分,第一部分是水的电离,第二部分是水溶液的酸碱性。
它是在学习了化学平衡和弱电解质的电离平衡之后将要学习的内容,学起来相对容易,老师只是稍微加以引导,学生就能理解本节教材的内容。
二、学情分析学生在前面章节已经学习了化学平衡和弱电解质的电离平衡,已经具备了怎样分析化学平衡类型的方法和能力以及具备应用其解决简单实际问题的能力,有关化学平衡的计算规则和平衡移动原理同样适用。
三、教学目标1.知识与技能目标(1)了解水的离子积的含义;(2)初步学会有关水的离子积的简单计算。
2.过程与方法目标(1)指导学生阅读课本,培养学生自学能力;(2)通过问题讨论,培养学生分析和归纳知识的能力。
3.情感态度与价值观目标(1)通过水的电离平衡过程中H+、OH-关系的分析,理解矛盾的对立统一的辩证关系。
矛盾的对立统一;(2)激发学生学习化学的兴趣,培养学生严谨、认真的学习态度。
四、教学重难点1.教学重点了解水的离子积常数2.教学难点水溶液中c(H+)和c(OH—)的简单计算五、教学方法讲述法、自主学习法、讨论法、多媒体展示法、归纳总结法六、教学器具多媒体(PPT)七、教学过程【回顾引入】通过上一节课,我们学习了什么是电解质,什么是强电解质以及什么是弱电解质,主要是弱电解质的电离平衡及其影响因素。
在这里老师要问一下大家,哪些物质属于弱电解质?(学生整体回答)既然大家说到了水也是一种弱电解质,那么水这种弱电解质是如何电离的呢?好,今天我们来学习一下第二节水的电离和溶液的酸碱性,第一课时水的电离。
【板书】第二节水的电离和溶液的酸碱性第1课时水的电离一、水的电离【板书】水是一种极弱电解质,仅有微弱电离:【讲解】既然水是一种弱电解质,那么它是如何电离的呢?其实,纯水的导电性实验表明,水是一种极弱电解质,它可以发生微弱的电离,电离成H+和OH—。
【板书】H 2O + H 2O H 3O + + OH — 简写为:H 2O H + + OH —【讲解】在这里,大家要知道水电离出的H + 和 OH — 的浓度是相等的。
水的电离和溶液的酸碱性教案一、教学目标1.了解水的电离和溶液的酸碱性的概念和基本特征。
2.掌握水的电离的过程和离子产生的规律。
3.了解溶液酸碱性的判断原则和常用指示剂的作用。
4.掌握利用pH计测定溶液酸碱度的方法。
5.培养学生科学实验的能力和观察能力。
二、教学内容1.水的电离和离子产生的规律。
2.溶液的酸碱性的判断原则。
3.利用pH计测定溶液酸碱度的方法。
三、教学步骤1.导入(10分钟)通过展示一些酸碱指示剂的颜色变化和常见酸碱物质的化学方程式,引导学生思考“酸碱性是什么?”、“溶液的酸碱性如何判断?”等问题,并带入本节课的学习内容。
2.讲解(15分钟)详细讲解水的电离和溶液的酸碱性的概念和基本特征。
介绍水的电离过程和离子产生的规律。
讲解溶液酸碱性的判断原则,包括酸碱指示剂的使用和酸碱中性物质的化学方程式。
3.实验(25分钟)3.1 实验前准备准备好标有不同pH值的溶液,并将它们分别添加到几个试管中;准备好pH计和酸碱试纸。
3.2 实验过程让学生使用pH计测量不同pH值的溶液,并记录测量结果。
然后使用酸碱试纸将溶液进行初步酸碱性判断,并与pH计的结果进行比较。
4.讨论(10分钟)让学生针对实验结果进行讨论,探讨pH计测定溶液酸碱度的方法的优劣和注意事项。
5.总结(5分钟)总结讲解水的电离和溶液酸碱性的基本原理和常用判断方法。
6.作业布置(5分钟)布置相关的作业,鼓励学生通过实际生活的实例分析、搜集、总结关于水的电离和溶液酸碱性的知识。
四、教学手段多媒体教学、实验教学、小组讨论、问题解答五、教学评价教师通过酸碱指示剂实验、学生理解与回答问题以及作业的完成情况,对学生的学习情况进行评价。
同时,教师对学生在实验中的表现、知识的掌握程度、交流与合作能力等进行综合评价。
《水的电离和溶液的pH》教学设计方案(第一课时)一、教学目标1. 理解水的电离过程以及影响水电离的因素。
2. 掌握溶液pH值的定义和计算方法。
3. 了解溶液酸碱性的影响因素。
二、教学重难点1. 教学重点:水的电离过程及影响水电离的因素,pH值的定义和计算方法。
2. 教学难点:如何将理论知识与实际应用相结合,理解溶液酸碱性的影响因素。
三、教学准备1. 准备教学PPT和相关视频素材。
2. 准备实验器材,进行水的电离实验。
3. 准备一些常见溶液,让学生进行pH值测量和记录。
4. 准备一些与溶液酸碱性相关的案例,用于课堂讨论。
四、教学过程:本节课为高中化学课程《水的电离和溶液的pH》的第一课时,教学目标包括理解水的电离和溶液的pH概念,掌握测定溶液pH 的方法,以及学会运用pH值判断溶液酸碱性。
教学过程如下:1. 导入新课:通过展示水和酸碱性不同的溶液,引导学生思考水的性质和溶液酸碱性的关系,从而引出本节课的主题。
2. 讲授新课:(1)水的电离:通过实验展示水电离过程,引导学生观察实验现象,理解水的离子性质和水电离产生的氢离子、氢氧根离子对溶液酸碱性的影响。
(2)溶液的pH:通过讲解pH值的概念、计算方法和表示方法,让学生了解如何用pH值判断溶液酸碱性,并掌握测定溶液pH的方法。
可以通过演示实验和学生实验相结合的方式,让学生亲手操作测定溶液pH的仪器,学会如何准确测量溶液pH。
(3)应用举例:通过实例讲解如何根据溶液的pH值判断溶液的酸碱性,让学生学会将所学知识应用于实际生活。
3. 课堂互动:鼓励学生提出疑问,分享自己的想法和见解,通过讨论交流,加深学生对知识的理解和掌握。
4. 作业布置:布置与本节课内容相关的作业,包括理论题和实验题,要求学生运用所学知识解决实际问题。
5. 课堂小结:回顾本节课的重点内容,强调知识要点,帮助学生梳理所学知识,加深印象。
6. 拓展延伸:介绍一些与本节课内容相关的拓展知识,引导学生继续探究和学习。