构成物质的微粒
- 格式:doc
- 大小:422.00 KB
- 文档页数:11

微粒构成物质知识点总结一、微粒构成物质的基本概念1. 微粒概念微粒是物质的基本组成单位,是构成物质的微小颗粒。
微粒构成物质的基本概念是微观世界中对物质结构的描述,是我们认识和理解物质的基础。
2. 微粒的性质微粒具有质量、体积和能量等物理性质,不同的微粒具有不同的化学性质,如原子、分子、离子等微粒在化学反应中具有独特的反应性。
3. 微观世界与宏观世界微观世界是指微观尺度下的物质结构和性质,宏观世界是指人们能够直接感观到的物质现象和性质。
微粒构成物质的认识是通过对微观世界的研究来理解物质的宏观性质和现象。
二、原子1. 原子的发现与性质原子是物质的最小单位,是由质子、中子和电子三种亚原子粒子组成的。
质子带正电荷,中子不带电,电子带负电荷。
原子具有质量、体积和能量,并且具有化学性质。
2. 原子的结构原子的结构由原子核和电子构成。
原子核由质子和中子组成,电子以轨道方式围绕原子核运动。
原子的结构对于物质的性质和化学反应具有重要影响。
3. 元素和同位素元素是由同种原子组成的物质,同位素是指同一元素的原子核中质子数相同、中子数不同的原子。
同位素具有相同的化学性质,但物理性质有所不同,可以用于放射性同位素的应用和研究。
三、分子1. 分子的概念分子是由不同原子通过化学键结合而成的,是物质的基本结构单位。
分子可以包括原子间的共价键、离子键等化学键。
2. 分子的性质分子具有质量、体积和能量,不同种类的分子具有不同的化学性质。
分子的结构对于物质的性质和化学反应起着决定性的作用。
3. 分子的结构分子的结构由原子的排列和化学键的方式确定。
分子的结构决定了分子的性质和化学行为,是研究物质的关键。
四、离子1. 离子的概念离子是失去或获得电子而带有电荷的原子或分子。
正离子是失去电子而带正电荷,负离子是获得电子而带负电荷。
2. 离子的性质离子具有电荷、质量和化学性质。
正负离子之间通过静电作用相互吸引,形成化合物,影响物质的性质和化学反应。



构成物质的微粒1.微粒的基本性质2.离子(1)定义:带电的原子(或原子团)叫离子。
(2)分类:①阳离子:带正电的原子或原子团,如Na+、Mg2+、NH+4 。
②阴离子:带负电的原子或原子团,如Cl-、O2-、CO2-3 、SO2-4 。
3.原子结构(1)由于质子与核外电子的电量相等、电性相反,故原子呈电中性;(2)原子序数=质子数=核电荷数=核外电子数。
4.原子结构示意图数子电的上层子电层子子原)核质子数相同的原子属于同种元素;原子的最外层电子数决定元素的化学性质,一般来说最外层电子数相同的化学性质相似,但不是一定相似。
注意:氦和镁原子的最外层电子数均为2,但化学性质不相同。
5.相对原子质量(1)定义:以碳-12原子质量的1/12为标准,其他原子的质量跟它相比所得的比值,就是这种原子的相对原子质量,符号为Ar 。
(2)表达式:相对原子质量(Ar )=一个原子的实际质量一个碳-12原子质量的1/12(3)相对原子质量≈质子数+中子数注意:相对原子质量的单位为“1”,省略不写,不是“g ”。
原子原子核核外电子(每个电子带1个单位负电荷)质子(每个质子带1个单位正电荷)中子(不带电)7.化学符号周围数字的意义个子粒数个团子原或子数荷电带所化(1)a :表示有a 个R 粒子(原子、分子、离子)例:2H 表示两个氢原子;2H 2表示两个氢分子;2H +表示两个氢离子。
(2)b :表示一个粒子中含有b 个原子例:CO 2中的“2”表示一个二氧化碳分子中含有2个氧原子。
(3)c :表示一个R 离子带c 个正(或负)电荷例:Mg 2+中的“2”表示一个镁离子带2个单位的正电荷。
(4)d :表示(某化合物中)R 元素的化合价为±d 价例:FeO +2中的“2”表示氧化亚铁中,铁元素的化合价为+2价。
【解题技巧】1. 理解和熟记微粒的基本性质及相关的知识,需要根据所给的问题情景或图表信息等结合所学的知识及自己的生活经验细致地分析推理后,按照题目要求进行解答。
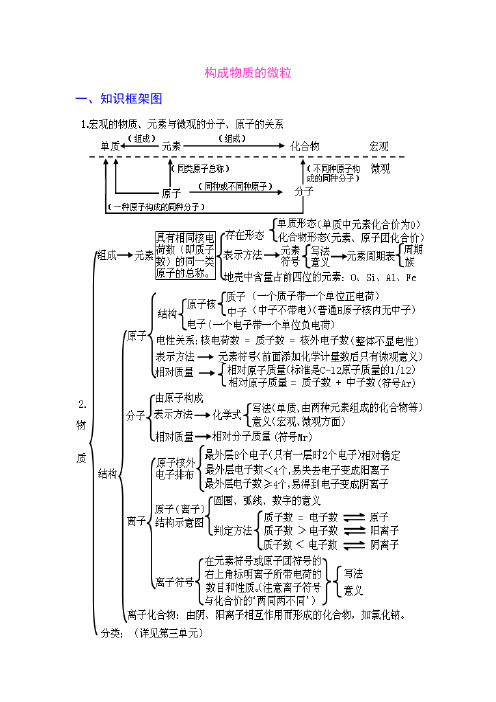
构成物质的微粒一、知识框架图二、学生应该掌握的核心知识构成物质的微粒(一)、概述微观的粒子有:原子、离子、分子、电子、质子等,它们都是微观概念,既表示种类又可表示个数。
分子、原子、离子都是构成物质的粒子。
A 、金属单质和稀有气体由原子直接构成;B 、非金属单质、非金属与非金属形成的化合物由分子构成。
C 、化合物中既有金属元素又有非金属元素的离子化合物是由离子构成。
(二)、分子:分子是保持物质化学性质的最小粒子。
分子由原子构成。
例:1个水分子由2个氢原子和1个氧原子构成A 、分子是构成物质的一种微粒,常见由分子构成的物质:水、氢气、氧气、氮气、二氧化硫、二氧化碳等。
【由分子构成的物质,在物理变化中,分子本身不发生改变;在化学变化中,分子本身发生改变,生成新的分子。
】B 、分子的微观特性:分子总是在不断地运动着;分子之间存在间隔;分子的质量很小。
(三)、原子:1、原子是构成物质的另一种微粒。
原子构成分子,原子也可直接构成物质,如金属汞、稀有气体等。
2、在化学变化中,分子本身发生变化,而原子本身没有变化,只是重新组合成新的分子,构成新的物质,所以,原子是化学变化中的最小粒子。
(注意:原子不是构成物质的最小粒子。
)化学反应的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子。
(四)、相对原子质量:以一种碳原子(碳-12)质量的1/12作为标准,其他原子的质量跟它相比较所得的数值,是该种原子的相对原子质量。
相对原子质量=一个碳原子的质量一个某原子的质量×12 (相对原子质量是个比,单位为1)相对原子质量≈质子数 +中子数 (五)、原子的构成原子的的构成:原子由核外带负电的电子和带正电的原子核构成,原子核由带正电的质子 和不带电的中子构成。
在不显电性的粒子里: 核电荷数=质子数=核外电子数注意:原子不是构成物质的最小粒子。
原子只是化学变化中的最小粒子; 普通氢原子核中只有质子无中子,氢原子的原子核就是一个质子。

原子:指化学反应中的最小微粒;元素:指拥有相同核电荷数的一类原子的总称;分子:是保持物体化学性质的最小微粒;离子:是指原子由于自身或外界的作用而失去或得到一个或几个电子使其达到最外层电子数为8个或2个的稳定结构。
这一过程称为电离。
电离过程所需或放出的能量称为电离能具体的理解如下:一、原子“原子是化学变化中的最小微粒”,这一概念有三层含义:1. 原子也是一种微观上的粒子。
2. 在化学变化中原子不能再分,不同的原子组合成分子。
3. 原子由更小的微粒:中子、质子、电子组成。
二、元素“同一类原子的总称称为元素”,这一概念的理解应注意以下几点:1. 元素是一个宏观的概念,与分子、原子不同,它只论种类,不论个数,没有数量意义。
2. 核电荷数或质子数是划分元素种类的唯一标准,也即核电荷数或质子数相同的原子或离子或同位素都是同一类元素,如氢原子H、氢离子H+、重氢原子H都是氢元素。
3. 同种类的元素可以有不同的存在状态,单质中的元素称为游离态,一般游离态的化学性质和物理性质与化合态不同。
三、分子“分子是保持物质化学性质的一种最小微粒”,这一概念包含三层含义:1. 分子是一种微观粒子,组成物质的微观粒子有多种(如原子、离子、质子等),分子只是其中的一种。
2. 分子不是最小的微粒,只是在“保持物质的化学性质”这一点上讲它是一种最小的微粒,相同的分子性质相同,不同的分子性质不同。
3. 分子是由更小的微粒:原子构成的。
“其实分子、原子、元素之间还是有很密切的联系的,从下面这个图可以大致看出来:一、原子、分子、元素之间的联系(1)原子构成分子;(2)分子构成物质,如碳原子和氧原子构成二氧化碳分子,二氧化碳分子构成二氧化碳;(3)原子可直接构成物质,如铁原子构成铁,氦气由氦原子构成;(4)(5)同类的原子总称为元素,而元素又组成物质。
二、运用分子、原子、元素概念进行描述时应注意的问题1. 直接由分子构成的物质(以二氧化碳为例)可以说:(1)二氧化碳由碳和氧两种元素组成(元素不讲个数)(2)二氧化碳由二氧化碳分子构成(宏观物质不讲个数)(3)二氧化碳分子由碳原子和氧原子构成(前后一致都不讲个数)(4)一个二氧化碳分子由一个碳原子和两个氧原子构成(都讲个数)2. 直接由原子构成的物质(如铁)可以说:(1)铁由铁元素组成(元素为宏观概念,只讲种类,不讲个数)(2)铁由铁原子构成(铁物质是宏观概念,不讲个数)水分子并不是由阴阳离子构成的,因此不是离子化合物;正象HCl分子也不是阴阳离子构成的,但在水中可以电离一样,只是水的电离趋势更小而已。
第二章物质的结构第1节构成物质的微粒考点梳理1.物质的构成物质都是由微观粒子构成的。
构成物质的微粒有分子、原子和离子。
分子是构成物质并能保持物质化学性质的一种微粒。
由分子构成的物质包括非金属单质。
如H2、O2、N2、O3等;非金属氧化物,如H2O、CO2、SO2等;酸,如HCl、H2SO4、HNO3等;有机物,如CH4、C2H5OH等。
原子是化学变化中的最小粒子。
由原子直接构成的物质有金属、稀有气体、C和Si等。
离子是带电的原子或原子团,也是构成物质的基本粒子,如氯化钠就是由氯离子和钠离子构成的。
2.粒子的特征(1)质量和体积都很小,大多数分子和原子的质量在10—26千克的数量级,原子的半径一般在10—10米的数量级。
(2)分子、原子都在不断地运动。
(3)分子间有间隔。
(4)离子是带电的微粒。
原子得、失电子后变成的微粒称离子。
3.物质与微观粒子模型符号是说明问题的一种简明易懂的形式。
从某种意义上讲,符号也是一种模型。
4.原子结构质子(每个质子带一个单位正电荷)(+) l原子核由夸克构成原子中子(不显电性)核外电子(每个电子带一个单位负电荷)(一)在原子结构中,要搞清楚以下几个问题:(1)质子数(核电荷数)=核外电子数,因而原子不显电性。
(2)近似相对原子质量=质子数+中子数。
原子的质量主要集中于原子核上(电子质量相对很小)。
(3)原子核内质子数不一定等于中子数。
普通氢原子的原子核内无中子。
(4)原子核内质子数决定了元素的种类;最外层电子数决定元素的化学性质。
5.原子结构模型的发展过程道尔顿提出原子学说→汤姆生模型→卢瑟福模型→波尔分层模型→电子云模型(1)道尔顿原子学说的主要观点:①原子是不能再分的粒子;②同种元素的原子的性质和质量都相同;③原子是微观上的实心球体。
(用现代的观点看都不正确。
)(2)汤姆生首先发现了电子,从而发现了原子还能再分而建立了汤姆生模型。
(3)卢瑟福发现了原子核,建立了卢瑟福模型。
(4)从科学家对原子模型的建立过程中,体验“提出假设→建立模型→实验→修正模型”的科学方法。
高频考点及真题演练高频考点一物质的构成考题一(2011·杭州)下列表中所列分子的性质和实验现象无关的是解析:B 中固体碘、碘蒸气都是I 2分子。
化学性质相同,都能使淀粉溶液变蓝色,而碘化钾不含I 2分子。
故不能使淀粉溶液变色;C 中由于分子间有间隙,所以乙醚可以液化;D 中由于分子运动速度随温度升高而加快,所以温度越高,水蒸发越快。
只有A 中,蔗糖溶于水形成糖水,蔗糖分子扩散到水分子中,分子没有变化。
答案:A真题演练l (2010·南昌)下列现象的微观解释中,不正确的是 ( ) A .氢气和液氢都可作燃料一一相同物质的分子,其化学性质相同 B .用警犬搜救地震中的被埋人员一一分子在不断运动C .用水银温度计测量体温一一温度升高,原子问的间隔变大D .水烧开后易把壶盖冲起一一温度升高,分子变大 【尝试自解】高频考点二 原子 原子的结构 考题二 (2011·义乌)如图是某化学反直的微观示意罔,相同的球代表同种原子。
下列说法不正确的是 ( )A .分子由原子构成B .该反应属于置换反应C .原子在化学反应中不可再分D .化学反应前后原子的种类和数目不变解析:分析该反应的微观示意图。
可以得出“分子由原子构成”、“原子在化学反应中不能再分”、且观察到反应前后原子的种类和数目都不变,2种单质分子反应后生成一种化合物分子,属于化合反应。
答案:B真题演练2(2010·莆田)钛(Ti)和钛合金被认为是21世纪的重要金属材料。
已知某种钛原子核内有22个质子,其相对原子质量约为48。
下列有关该原子的叙述正确的是( ) A.核内有22个中子B.质量为48 gC.核外有22个电子D.核电荷数为26【尝试自解】中考命题方向及模拟本节知识点不多,内容抽象,但难度不大,在中考命题中一般以选择题呈现,也有部分以填空、简答题形式呈现。
正确理解判断分子、原子、离子的概念.并能用分子、原子、离子观点解释一些现象和变化,特别是有关“分子在不停地运动,分子之间有间隙”解释现象出现的几率较高。
原子结构的考查往往与最新科技发现等结合,考查核外电子数,质子数或中子数的多少计算。
预计2012年对本节知识的考查将更加注意与生产、生活实际的结合,考查形式不变。
模拟预测题1 下列关于原子的叙述中,正确的是( )A.原子的质量主要集中在原子核上B.原子中质子数一定等于中子数C.原子一定是由质子、中子、电子三种微粒构成的D.原子核带正电荷,电子带负电荷,因此原子是显电性的模拟预测题2 请用分子、原子的知识,分析并回答下列问题:(1)体温计中的金属汞,由许许多多的汞_________构成。
(2)干冰升华,体积变大,主要是由于二氧化碳分子间_________变大造成的。
(系统复习,全面提升自我,请完成同步训练)同步训练构成物质的微粒1.用表示氢原子表示氧原子。
下列方框中,符合“2H 2O”所表示意义的是( )2.我国著名科学家、中国科学院院士张青莲教授主持测定了铟、铱、锑、铕等几种元素的相对原子质量新值,其中他测出的核电荷数为63的铕元素的相对原子质量的新值为152。
则下列说法正确的是( )A.铕元素的原子质子数为63B.铕元素的原子中子数为63C.铕元素的原子核外电子数为l52D.铕元素的原子的质量为1523.下列关于分子、原子和离子的说法中,正确的是( )A.分子、原子、离子都是不显电性的微粒B.分子一定比原子大C.分子是保持物质性质的一种微粒D.原子是化学变化中最小的粒子4.随着分子、原子研究技术的提高,科学家可以利用原子来“组装”分子。
若用这种技术组装成脱氧核糖分子(C5 H10O4),则该分子中不含有的原子是( )A.氯原子B.碳原子C.氧原子D.氢原子5.下面是甲、乙两种物质的结构示意图,图中小圆圈均代表碳原子。
这两种物质在氧气中完全燃烧后的产物都是二氧化碳,但它们的物理性质明显不同,如导电性、硬度等。
据此,下列说法错误的是( )A.甲、乙两种物质中的碳原子大小相同B.甲、乙两种物质都是碳单质C.甲、乙两种物质中原子的空间排列方式不同D.将甲、乙两种物质混合后得到的是纯净物6.两百多年前,法国化学家拉瓦锡用定量的方法研究空气成分,其中一项实验是加热红色氧化汞粉末得到汞和氧气,该反应的示意图如图所示。
下列说法正确的是( )A.在氧化汞分解过程中,原子的个数没有发生改变B.在氧化汞分解过程中,分子的种类没有发生改变C.氧化汞、汞、氧气都是化合物D.氧化汞、汞、氧气都是由分子构成的7.自第十一届奥运会以来,历届奥运会开幕式都要举行颇为隆重的“火炬接力”。
火炬的可燃物是丁烷(C4H10)。
它燃烧时,火苗高且亮,在白天,二百米以外也能清晰可见。
下面关于丁烷的叙述:①丁烷是由碳、氢两种元素组成的;②丁烷是由丁烷分子构成的;③丁烷分子是由碳、氢两种元素组成的;④丁烷是由4个碳原子和10个氢原子组成的;⑤丁烷分子是由碳原子和氢原子构成的。
其中正确的是( )A.①②③④⑤B.①②⑤C.②③④⑤D.①②④⑤8.电子数相同、质子数不同的两种粒子,它们可能是( )A.两种不同元素的原子B.两种不同元素的离子C.两种不同的分子D.同种元素的原子和离子9.现有四种粒子,其质子数、中子数和核外电子数如下表所示,其中属于同种元素的粒子是( )A.甲和乙B.丁和丙C.乙和丙D.甲和丙10.科学研究发现,氮气不活泼,在3000℃时仅有0.1%的分子分裂。
在0℃常压条件下,向密闭容器M中充入一定量的氮气,然后升高温度(不超过300℃,压强不变)。
若该密闭容器的体积增大了一倍,则M内分子变化的示意图合理的是( )11.如图甲是卢瑟福用α粒子轰击金原子而产生散射的实验,在分析实验结果的基础上,他提出了如图乙所示的原子核式结构,卢瑟福的这一研究过程是一个( )A.建立模型的过程B.得出结论的过程C.提出问题的过程D.验证证据的过程12.碳家庭中C60的分子结构形似足球(如图所示)。
关于C60的说法中错误的是( ) A.它是一种单质B.每个C60分子由60个碳原子构成C .它与金刚石是同一种物质D .它完全燃烧后的产物是CO 213.从下列图片中不能获取的信息是 ()A .分子之间有间隔B .硅原子由原子核和电子构成C .受热水分子运动速率加快D .构成物质的粒子有分子、原子和离子 14.水电解的微观过程可用下列图示表示,其微粒运动变化的先后顺序是______(选填序号)。
15.“见著知微”是化学学科的特点。
下图是一氧化碳燃烧的微观示意图。
请回答:(1)当煤气泄漏时会嗅到特殊臭味,这是因为分子在____________________。
(2)请另写一个与图中基本反应类型相同的化学方程式:____________________。
(3)将一氧化碳完全燃烧的产物通人紫色石蕊溶液中,观察到溶液颜色变为_____色。
(4)分析上述微观示意图,你能得到的一条结论是____________________。
16.某化学兴趣小组为探究分子的运动,设计了下列实验方案,并记录了实验现象(见下表)。
请你帮助该小组完成其他实验内容(填写在下列表格中)。
参考答案第二章物质的结构第1节构成物质的微粒真题演练l 答案:D解析:A中氢气和液氢都是由氢分子构成的,而同种分子的化学性质相同,A正确;警犬根据人与其他物质的不同气息判断是否有幸存者,说明分子在不断运动;C中温度升高,汞原子间的间隔变大;D中,水烧开后温度升高,分子间的间隔变大,分子本身大小不变。
真题演练2答案:C解析:本题考查原子结构中的各种微粒的数量关系。
在原子中,核电荷数=核内质子数=核外电子数,相对原子质量≈质子数+中子数,由此可判断出,该原子的核电荷数与核外电子数都为22,核内有26(48-22=26)个中子;其相对原子质量为48,原子的质量更小。
模拟预测题1 答案:A解析:原子中电子的质量很小,原子核的质量几乎与原子质量相当;原子中质子数与中子数无必然联系;有一个叫做氕的氢原子没有中子;原子中质子与电子所带电量相同,电性相反,故原子不显电性。
模拟预测题2 答案:(1)原子(2)间隙解析:从物质的构成微粒有分子、原子、离子知金属汞只能由汞原子构成;干冰升华,由固态变成气态,体积变大,主要是由于二氧化碳分子间隙变大。
同步训练1.答案:D解析:解题的关键是理解模型,表示两个水分子及每个水分子的构成,只有D图能表示两个水分子。
2.答案:A解析:根据原子中各种量之间的关系:质子数=核电荷数=核外电子数,相对原子质量一质子数+中子数,可得该元素原子的质子数、核外电子数都为63,中子数=l52—63=89。