HILIC色谱柱介绍
- 格式:doc
- 大小:79.00 KB
- 文档页数:4

Hillic色谱柱在液相紫外检测的应用一、引言色谱技术是现代分析化学中的一种重要手段,广泛应用于各个领域,特别是在生命科学、药物研发、环境监测等领域。
色谱柱是色谱技术的核心部件,其性能直接影响到色谱分离的效果。
Hillic色谱柱是一种新型的色谱柱,因其独特的性能和分离效果,在液相紫外检测中得到了广泛的应用。
本文将对Hillic色谱柱的原理与优势、在液相紫外检测中的应用以及未来发展方向进行探讨。
二、Hillic色谱柱的原理与优势Hillic色谱柱是一种基于离子交换的色谱柱,其原理是在色谱柱中加入适当的离子交换剂,通过离子交换作用实现对目标物质的分离。
相比于传统的色谱柱,Hillic色谱柱具有以下优势:1.高选择性:Hillic色谱柱采用离子交换剂作为固定相,可以根据目标物质带电性质的不同,实现高选择性的分离。
2.分离效率高:由于Hillic色谱柱采用离子交换作用,可以实现对目标物质的高效分离,缩短分析时间。
3.适用范围广:Hillic色谱柱可以用于不同类型样品的分析,如生物样品、环境样品等。
4.易于制备:Hillic色谱柱的制备相对简单,可以采用常规的色谱柱制备方法进行制备。
三、Hillic色谱柱在液相紫外检测中的应用Hillic色谱柱因其独特的性能和分离效果,在液相紫外检测中得到了广泛的应用。
具体来说,主要应用于以下几个方面:1.生物样品分析:生物样品中的蛋白质、核酸等生物大分子具有带电性质,可以通过Hillic色谱柱进行分离。
例如,可以采用Hillic色谱柱对蛋白质进行分离和纯化,或者对核酸进行富集和纯化。
2.环境样品分析:环境样品中的污染物大多带有一定的电荷,可以通过Hillic色谱柱进行分离。
例如,可以采用Hillic色谱柱对水中的重金属离子进行分离和测定。
3.药物分析:药物中的有效成分和杂质大多带有一定的电荷,可以通过Hillic色谱柱进行分离。
例如,可以采用Hillic色谱柱对药物中的有效成分进行分离和测定。

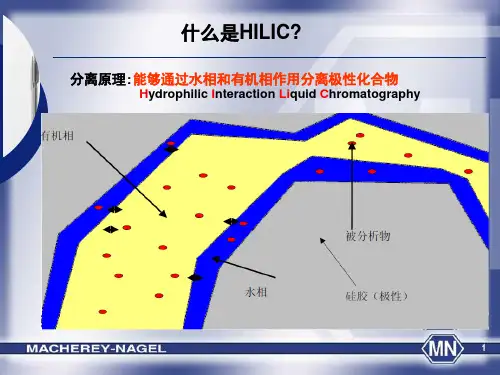
亲水相互作用色谱(HILIC)1.简介亲水色谱Hydrophilic Interaction LIquid Chromatography(HILIC)是一种用来改善在反相色谱中保留较差的强极性物质保留行为的色谱技术。
它通过采用强极性固定性,并且结合高比例有机相/低比例水相组成的流动相来实现这一目的。
而这样的流动相组成尤其有利于提高电喷雾离子化质谱(ESI-MS)的灵敏度。
HILIC 的分离机理在目前还存在着争议,主要包括以下三个方面:(1)分配机理(2)离子交换(3)偶极-偶极相互作用。
2.适用范围普通反相色谱难以保留的物质,强极性、亲水性物质。
3.使用(1)极性小物质先被洗脱,极性大物质、亲水性物质强保留后洗脱。
梯度洗脱时流动相极性逐渐增加。
(2)常用流动相:乙腈/水(缓冲盐)体系。
(3)常用缓冲盐溶液:甲酸胺溶液或醋酸铵溶液(一般10mM)。
(4)进样:常用进样溶剂为75/25乙腈/甲醇。
(5)平衡:开始进样前,用20倍柱体积的起始流动相平衡色谱柱。
(6)流动相中总是至少保持5%的极性溶剂以保证填料始终被水浸润,至少保持有机溶剂的比例不低于40%。
4.清洗与再生用50/50的乙腈/水清洗以去除极性污染物。
如果清洗无效,可用5/95的乙腈/水清洗色谱柱。
5.保存柱子保存在95%乙腈中。
不要将色谱柱保存在缓冲盐流动相中,如果流动相中含有缓冲盐,先用10倍柱体积的HPLC级水清洗色谱柱然后换上95%乙腈保存。
6.注意事项(1)不要使用磷酸盐缓冲体系,因为磷酸盐缓冲盐在HILIC色谱模式下会析出。
(2)避免使用水或DMSO做进样溶剂,尽量用100%乙腈溶解样品进样。

亲水作用色谱(HILIC)保留的数学模型1. 介绍亲水作用色谱(HILIC)是一种在分离化合物时非常有用的方法。
它基于化合物与水相互作用的程度来进行分离,通常用于极性化合物的分离。
亲水作用色谱的保留行为由一些数学模型来描述和预测,这些模型对于理解和优化分离过程至关重要。
本文将探讨亲水作用色谱保留的数学模型,以帮助读者深入了解该主题。
2. 亲水作用色谱保留的基本原理让我们简要回顾一下亲水作用色谱的基本原理。
在HILIC中,固定相是一种亲水性较强的材料,通常是含有羟基(OH)或氨基(NH2)的硅胶或树脂。
移动相则是一种有机溶剂和水的混合物。
在这种色谱中,极性化合物倾向于在固定相上吸附水分子,从而被保留在色谱柱上。
亲水作用色谱主要依赖于化合物与水的相互作用。
3. 亲水作用色谱的保留机理亲水作用色谱的保留行为可以通过一些数学模型来描述。
最常用的模型之一是水-有机溶剂分配模型,即扩散-限制模型(DLM)。
该模型基于固定相表面的水相分布和极性化合物在水相和有机溶剂相之间的分配行为。
通过这个模型,我们可以计算化合物在色谱柱中的停留时间,从而预测其在色谱图上的峰形状和峰高度。
4. 亲水作用色谱保留的数学模型除了扩散-限制模型,还有一些其他数学模型可以用来描述亲水作用色谱的保留行为。
其中,最著名的是极性引力模型(PGA),它基于极性化合物在水-有机溶剂混合物中的溶剂化自由能来预测保留行为。
还有一些基于水-有机溶剂分配系数的经验公式,如AB列方程等。
5. 个人观点和理解从数学模型的角度来看,亲水作用色谱的保留行为可以被理解为化合物在水相和有机相之间平衡的结果。
数学模型为我们提供了一种定量的手段,可以预测化合物在色谱柱中的行为,并为优化分离条件提供指导。
然而,这些数学模型也有其局限性,它们通常是基于一些假设和经验参数的,对于特定的化合物类别或实验条件可能不适用。
6. 总结亲水作用色谱的保留行为可以通过数学模型来描述和预测。

色谱柱类型
色谱柱可分正相模式色谱柱、反相模式色谱柱和亲水模式柱。
一、正相模式色谱柱
正相模式色谱柱采用极性固定相(如乙二醇、氨基与腈基等键合相);常用于分离中等极性和极性较强的化合物(如酚类、胺类、羰基类及氨基酸类等)。
二、反相模式色谱柱(RPC)
反相模式色谱柱:一般用非极性固定相,以硅胶为基质键合不同的基团(如C18、C8);适用于分离非极性和极性较弱的化合物。
在现代液相色谱中应用最多,据统计它占整个HPLC应用的80%左右。
由于超临界色谱的崛起,一些过去用正相色谱的实验逐渐被超临界色谱所代替,所以反相色谱柱的应用将会更加广泛。
随着色谱柱填料的快速发展,某些无机样品或易解离样品的分析也可用反相色谱法。
为控制样品在分析过程的解离,常用缓冲盐控制流动相的pH值。
硅胶基质键合相(C8和C18)色谱柱使用的pH值通常为2.5~7.5(2~8),太高的pH值会使硅胶溶解,太低的pH值会使键合的烷基脱落。
近年来技术的更新,利用包被、空间位阻、杂化颗粒等新技术,已经可以使硅胶基质的色谱柱使用范围扩大到pH为1~12,流动相为较强酸性或碱性时,可选择宽pH值的色谱柱。
三、亲水模式色谱柱(HILIC)
亲水(HILIC)模式不同于反相色谱技术,流动相为反相色
谱的流动相,它提供了相对于反相的互补选择性,通常可保留传统反相色谱方法无法保留的高极性化合物。
需要注意的是HILIC模式中硅胶基质无键合相的色谱柱,流动相pH适用范围。


亲水作用色谱HILIC亲水作用色谱(Hydrophilic Interaction Chromatography,HILIC)是一种基于相互作用原理的色谱技术,在许多领域中得到广泛应用。
相比于常规的反相色谱和离子交换色谱,HILIC具有独特的优势,能够有效地分离具有极性、亲水性及离子性特征的化合物。
HILIC分离技术的原理基于样品溶剂与固定相之间的水合作用。
传统的反相色谱使用非极性固定相和极性溶剂进行分离,而HILIC则使用极性固定相和非极性或含有一定水含量的溶剂。
这种水合作用可以通过氢键结合、疏水-极性相互作用等力学实现。
在HILIC中,固定相通常是富含极性基团的材料,如硅胶、氨基硅胶、氢氧化铯等。
而常用的流动相包括水、甲醇、乙腈等含有一定水含量的极性溶剂。
这些溶剂可以在流动相中形成水合包络,提供水合作用表面来吸附色谱柱中的样品分子。
HILIC分离技术在药物分析、食品检测和环境分析等领域中得到广泛应用。
例如,在药物分析中,许多药物和其代谢物具有较强的极性和水溶性特征,常规的反相色谱无法对其进行有效分离。
而HILIC可以通过调整流动相的极性和水含量,实现对这些极性化合物的有效分离和定量。
在食品检测中,HILIC可以用于分析和定量多种极性成分,如氨基酸、有机酸、多糖等。
这些化合物对食品质量及安全性具有重要影响,因此HILIC能够为食品行业提供快速、准确和高通量的分析手段。
在环境分析中,水中或土壤中常常存在一系列极性有机物,如农药、有机溶剂和抗生素等。
这些化合物的定量分析对于环境监测和保护至关重要。
通过使用HILIC色谱技术,可以高效地分离和测定这些环境有机污染物,为相关领域的决策和监控提供重要依据。
此外,HILIC还可以与其他色谱技术结合使用,如质谱联用(LC-MS)等。
这种联用技术可以克服HILIC分离中的一些缺点,如分离度不高、峰的峭度较差等,提高分析的选择性和灵敏度。
综上所述,亲水作用色谱HILIC是一种有效的极性分离技术,在药物分析、食品检测和环境分析等领域中具有广泛应用潜力。

TSKHILICAFCHICIEX系列色谱柱使用冲洗方法色谱柱的冲洗方法对于保护色谱柱、延长使用寿命、提高分离效果至关重要。
下面将分别介绍TSKHILIC、AFC、HIC和IEX系列色谱柱的冲洗方法。
1.TSKHILIC色谱柱的冲洗方法:a.初次使用:先用纯水冲洗柱床两倍柱床体积,以去除柱内可能存在的盐离子和有机溶剂。
b.然后,使用10-20mL纯水/乙醇(80:20,体积比)洗脱样品洗涤剂残留物,同时保护柱内填料。
c.最后,使用纯水冲洗柱床两倍柱床体积,以去除柱床中可能存在的溶剂残留物。
2.AFC色谱柱的冲洗方法:AFC(Affinity Chromatography)色谱柱是一种亲和色谱柱,常用于分离具有特定亲和性的分析物。
以下是一种常用的冲洗方法:a.初次使用:先用公认的吸附剂(如硫酸铵)溶液冲洗柱床两倍柱床体积,以平衡柱内填料,并去除可能存在的污染物。
b.然后,使用适宜pH值的缓冲液(如磷酸缓冲液)进行冲洗,以去除填料和样品中的杂质。
c.最后,使用缓冲液冲洗柱床两倍柱床体积,以达到柱床的稳定状态。
3.HIC色谱柱的冲洗方法:HIC(Hydrophobic Interaction Chromatography)色谱柱是一种疏水相色谱柱,常用于分离疏水性物质。
以下是一种常用的冲洗方法:a.初次使用:先用有机溶剂(如乙醇)冲洗柱床两倍柱床体积,以去除柱内可能存在的水分和杂质。
b.然后,使用含盐缓冲液进行冲洗,使样品组分与填料发生疏水相互作用,以达到最佳分离效果。
c.最后,用纯水冲洗柱床两倍柱床体积,以去除盐离子和有机溶剂残留物。
4.IEX色谱柱的冲洗方法:IEX(Ion Exchange Chromatography)色谱柱是一种离子交换色谱柱,常用于分离带有不同电荷的离子。
以下是一种常用的冲洗方法:a.初次使用:先用纯水冲洗柱床两倍柱床体积,以去除柱内可能存在的杂质。
b.然后,使用合适的缓冲液(含有对应离子交换基团的缓冲液)进行冲洗,以保持样品组分在填料上的稳定吸附。

HILIC柱使用注意
1.首次使用时,用50%水:50乙腈(缓冲终浓度10mM)平衡50倍
柱体积;
首次进样前,用流动相平衡20倍柱体积;
走梯度时,每个样之间平衡10倍柱体积。
2.柱体积:150mm*2.1mm,3µm→0.5mL;
100mm*2.1mm,3µm→0.4mL;
50mm*2.1mm,3µm→0.1mL。
3.pH适用范围:1-5,配完流动相后测pH。
4.流动相中至少有5%的极性溶剂(如水,甲醇或3%甲醇/2%水),
至少有40%有机溶剂(乙腈)。
5.乙酸铵或甲酸铵作为缓冲的重现性比甲酸或乙酸好。
如果必须用,
0.2%的浓度更合适。
6.样品溶剂最好是100%有机溶剂(如乙腈),尽量避免用水或者
DMSO溶样品。
7.洗针液和purge的极性溶剂浓度与流动相一样高。
8.流动相pH的选择:
甲酸铵:2.75—4.75
乙酸铵:3.76—5.75。
9.起始摸条件时,走梯度:95%乙腈→50%乙腈;若无保留,等度,
流动相用95:3:2(乙腈:甲醇:水缓冲液)。

hilic色谱梯度设置摘要:一、HILIC色谱的原理二、HILIC色谱梯度设置的重要性三、HILIC色谱梯度设置的方法1.选择合适的流动相2.梯度条件的设定3.梯度设置的方法四、HILIC色谱梯度设置的技巧1.梯度斜率的控制2.梯度过程中的流速控制3.梯度设置的优化正文:HILIC(高效离子交换液相色谱)是一种广泛应用于生物大分子分离和分析的液相色谱技术。
HILIC色谱梯度设置是实验过程中一个重要的步骤,可以影响到色谱结果的准确性和重复性。
本文将详细介绍HILIC色谱梯度设置的相关知识和操作技巧。
一、HILIC色谱的原理HILIC色谱是一种基于离子交换原理的液相色谱技术。
样品在离子交换填料的作用下,根据样品中各组分的解离度和亲疏水性差异进行分离。
二、HILIC色谱梯度设置的重要性HILIC色谱梯度设置直接影响到样品组分的分离效果。
合理的梯度设置可以使各组分在色谱柱中得到有效分离,从而提高分析结果的准确性和重复性。
三、HILIC色谱梯度设置的方法1.选择合适的流动相流动相是影响HILIC色谱分离效果的关键因素。
通常采用甲醇/水或乙腈/水作为流动相,根据样品特点选择合适的比例。
2.梯度条件的设定梯度条件包括初始条件、梯度起点和梯度终点的设定。
初始条件通常设定为较低的有机相比例,梯度起点和终点则根据目标组分的保留时间和样品浓度进行设定。
3.梯度设置的方法梯度设置的方法包括线性梯度、指数梯度和阶段梯度等。
根据样品特点和实验需求选择合适的梯度方法。
四、HILIC色谱梯度设置的技巧1.梯度斜率的控制梯度斜率过大或过小都会影响样品的分离效果。
合理的梯度斜率可以保证样品组分在色谱柱中得到有效分离。

HILIC色谱柱的使用注意事项a)HILIC色谱柱的平衡i.使用50倍柱体积的50/50的乙腈/水相缓冲溶液(缓冲液的最终浓度为10mM)平衡新色谱柱ii.在开始进样前,用20倍柱体积的起始流动相平衡色谱柱iii.进行梯度分析时,进样间隔需要用10倍柱体积起始流动相平衡色谱柱说明:色谱柱平衡不充分将导致保留时间漂移b)HILIC流动相需要注意的问题i.流动相中总是至少保持5%的极性溶剂(如5%水相缓冲液,5%甲醇或3%甲醇/2%水相缓冲液等),这保证HILIC硅胶填料始终被水浸润ii.在流动相或梯度中至少保持有机溶剂(如乙腈)的比例不低于40%iii.不要使用磷酸盐缓冲溶液体系,因为磷酸盐缓冲液在HILIC色谱模式下会析出;使用磷酸则没有问题iv.缓冲系统如甲酸铵或乙酸铵水溶液比甲酸或乙酸的水溶液有重现性更好的结果。
如果不能使用缓冲液而一定要使用流动相添加剂如甲酸,最好使用0.2%的浓度而非0.1%v.为得到最好的峰形,在流动相或梯度中总是保持缓冲系统的浓度为10mMc)HILIC进样溶剂需要注意的问题i.如果可能,尽量用100%乙腈溶解样品进样。
避免使用水配制样品溶液,请选择较弱的HILIC溶剂如乙腈、甲醇、异丙醇等配制样品溶液。
ii.最常用的进样溶剂为75/25 乙腈/甲醇,这个体系充分平衡了样品的溶解度和峰形两个因素。
iii.不要用水或DMSO做进样溶剂,它们将导致峰形变得很差iv.使用反相SPE技术将水或DMSO置换成乙腈再进样。
如果不能这样操作,用有机溶剂稀释水或DMSO。
d)其它有关使用HILIC的建议i.开始时可以运行一个95%乙腈至50%乙腈的梯度,如果样品不保留,使用95/3/2乙腈/甲醇/水相缓冲溶液的流动相进行等度分析ii.将流动相中的水换成甲醇、丙酮或异丙醇也可以增加极性化合物的保留iii.请确保弱洗针溶剂/冲洗溶剂包含和流动相一样的高比例有机相,否则峰形会受到影响、再生和保存第四节色谱柱清洗色谱柱清洗、A.清洗和再生压力骤然升高,保留时间或分离度发生波动往往表明色谱柱被污染了。
hilic色谱梯度设置
HILIC色谱(Hydrophilic Interaction Liquid Chromatography)
是一种在水相条件下进行的色谱分离技术,用于分离极性或亲水性化合物。
在HILIC色谱中,梯度设置是非常重要的,可
以影响到化合物的分离效果和分离时间。
以下是一些常用的HILIC色谱梯度设置的建议:
1. 初始条件:以高机动相浓度开始(例如80%有机溶剂),
以便快速溶解样品,并防止样品在开始时吸附在色谱柱上。
2. 初始梯度:在初始条件下,慢慢增加水相浓度(例如从80%有机溶剂线性梯度到50%水/50%有机溶剂),以便在样品进
入和适应色谱柱时实现最佳的保留和分离效果。
3. 定向梯度:在样品进入并适应色谱柱后,可以进一步调整梯度,以实现更好的分离和保留。
例如,可以使用一个定向梯度从高水相浓度逐渐增加有机溶剂浓度,以更好地分离和保留目标化合物。
4. 色谱柱洗脱:在完成样品分离后,可以使用一个较高的有机溶剂浓度洗脱残留的化合物,并将色谱柱回复到初始条件以进行下一次分析。
需要注意的是,HILIC色谱的梯度设置需要根据具体的分析目的、样品性质和色谱柱选择进行优化。
有时可能需要进行多次试验和调整才能找到最适合的梯度设置。
精选文档
1 / 4
亲水作用色谱(HILIC)是近年来色谱领域研究的热点之一。本文简介了HILIC的起源、定
义、分离特点;比较了HILIC和反相色谱(RPLC)的选择特性,讨论了HILIC与质谱联用
技术的特点,并对其使用中的注意事项进行了总结。
1. HILIC的概念
亲水色谱(HILIC)是一种用来改善在反相色谱中保留较差的强极性物质保留行为的色谱技
术。它通过采用强极性固定性,并且结合高比例有机相/低比例水相组成的流动相来实现这
一目的。而这样的流动相组成尤其有利于提高电喷雾离子化质谱(ESI-MS)的灵敏度。
2. HILIC的分离机制
HILIC的分离机理在目前还存在着争议,主要包括以下三个方面:(1)分配机理(2)离子
交换(3)偶极-偶极相互作用。更多的试验现象则表明HILIC的保留机理包含氢键作用、偶
极作用和静电作用等多种次级效应,很难将其区分开来。
3.HILIC影响保留的主要因素
普遍认为HILIC保留行为受到多种参数的影响,如固定相的官能团、有机改性剂的含量、
流速、柱温、流动相缓冲体系的pH值、缓冲盐的种类和浓度。
影响样品在固定相上的保留行为的最主要因素都是流动相中有机相的比例,例如乙腈的含
量的增加会显著增加样品的保留因子。在HILIC分离模式中,溶剂洗脱能力由弱到强为:
四氢呋喃<丙酮<乙腈<异丙醇<乙醇<甲醇<水, 流动相中水是最强的洗脱溶剂。一般采用乙
腈-水体系作为流动相,其中水相的比例为5%-40%以保证其显著的亲水作用。如图1所示,
将流动相中的水相用甲醇、乙醇、异丙醇代替,随着流动相极性的减小,待测物在柱上的保
留就会增强。
Figure 1. HILIC retention as a function of polar modifier. 100 mm length ACQUITY UPLC
BEH HILIC column. Peaks: 1 = methacrylic acid, 2 = cytosine, 3 = nortriptyline, 4 =
nicotinic acid.
4. HILIC与RP-HPLC的比较
传统的反相色谱(RPLC)对强极性和亲水性的小分子物质的保留和分离能力较弱,通常流
动相需要采用高比例的水相才能实现其保留,然而高比例的水相会导致一系列问题,比如固
定相的反浸润和ESI-MS灵敏度的下降。
HILIC正好可以解决这些问题,它提供了一种与传统RPLC互补的保留方式,能够使在RPLC
上保留较弱或没有保留的物质在HILIC柱上提供合适的保留,如图2所示:
精选文档
2 / 4
Figure 2: Chromatograms comparing the retention of allantoin on Atlantis HILIC Silica and
Atlantis dC18 columns. (a) Column: 50 mm×4.6 mm, 3-μm dp Atlantis dC18; mobile phase:
10 mM ammonium formate, pH 3; Shows no retention (k =0) of allantoin. (b) Column: 50
mm×4.6 mm, 3-μm dp Atlantis HILIC Silica; mobile phase: 95:5 (v/v) acetonitrile–water
containing 10 mM ammonium formate, pH 3; Shows retention (k =1) of allantoin.
另外,HILIC柱上的洗脱顺序与RPLC柱上的正好相反,极性较小的物质先出峰,极性较大
的物质后出峰。如图3所示:
Figure 3. Comparison of ESI+MS response using HILIC and RP conditions. SIR channels
of acetylcholine (m/z 146.2) and choline (m/z 103.9); Columns: 100 mm×2.1 mm, 1.7μm
(A) ACQUITY UPLC BEH C18 (B) ACQUITY UPLC BEH HILIC. Peaks: 1 = acetylcholine,
2 = choline
5.HILIC与质谱技术联用
HILIC可为强极性和强亲水性的化合物提供合适的保留。通过优化多个色谱参数,有利于
实现目标组分和基质中干扰物质的分离,从而降低基质效应的影响;而含有高比例水溶性有
机相的流动相又有利于提高质谱离子化效率,进而提高质谱分析的灵敏度。
精选文档
3 / 4
质谱响应在某种程度上是取决于流动相中有机相的比例。采用ESI源时,毛细管中离子
化的过程类似于一个电泳过程。由于毛细管被加高压,形成带电液滴。溶剂蒸发,离子向液
滴表面移动,当液滴表面电荷产生的库仑排斥力与液滴表面的张力大致相等时,液滴会分裂
成更小的液滴,对于半径<10nm的液滴, 液滴表面形成的电场足够强,电荷的排斥作用最
终导致部分离子从液滴表面蒸发出来,形成了气相离子。而有机相的表面张力比水相的表面
张力小得多。因此,在相同的条件下,流动相中有机相的比例越高,质谱的响应越高。从图
4可以看出,在HILIC柱上的响应比在RPLC柱上的响应高出十倍左右。
Figure 4. Chromatograms comparing the retention and MS response of analyte on C18 m
Inertsil ODS-3; mobilecolumn and HILIC column. (A) Column: 2.1×50mm, 3 phase:
methanol-water containing 0.2% formic acid (15:85, v/v) (B) Column: m ACQUITY UPLC
BEH HILIC; mobile phase: methanol-water containing2.1×50mm, 1.7 0.2% formic acid
(85:15, v/v)
6. HILIC柱的使用
(1)初次使用HILIC柱时,应采用50倍柱体积的乙腈-水(50:50)平衡,在进第一针前,
应用初始流动相平衡20倍的柱体积。
(2)HILIC柱冲柱子时,采用的是乙腈-水(50:50)来洗去极性物质。如果解决不了问题,
可以使用乙腈-水 (5:95) 来冲柱子。长时间不用时,将柱子保存在乙腈-水(95:5)中。
(3)要保证流动相中至少40%的有机相。流动相中使用添加剂时,醋酸铵、甲酸铵的重现
性优于乙酸和甲酸。如必须使用甲酸等,0.2%优于0.1%,不要使用磷酸。
(4)水是最强的洗脱溶剂,所以强洗和弱洗溶剂与反相系统的正好相反:弱洗是初始流动
相,即高比例的有机相。并且进样溶剂最好是100%的有机相。
1.HILIC柱如何平衡?
HILIC柱使用70%的乙腈水溶液平衡。
2.HILIC柱如何保存?
HILIC柱使用 90%的乙腈水溶液保存。
1. 一直使用Waters 的HILIC较多,感觉质量还行,但是要小心waters 的HILIC是分两
种类型的填料的 BEH HILIC和 HILIC。
精选文档
4 / 4
很多waters 的销售都不清楚之一点。但是大家一定要注意,这两款的区别是很大的,保留
的效果是不同的。
2. 费罗门公司的HILIC柱,感觉是小家碧玉型的,保留能力不是太强,但是清秀文雅, 峰
型很好看。
3. HILIC的 流动相推荐使用乙腈。
4. 推荐使用乙酸铵, 这也以后再说。
5.不能使用100% 的乙腈,推荐使用到95%就行了。
不能使用60%以下的乙腈。
所以梯度范围小。但是足够用了。
因为100%的乙腈可能对HILIC的中亲水的部分不利于键合相的伸展开。
使得保留性能下降。其中的解释也是经验,研究论文解释的也让人不太信服。所以大家可以
一起讨论一下这点。
使用甲醇的问题也是这样的。在甲醇分子附近,HILIC的保留能力下降了,色谱峰型较差。
这也是经验结果。
Pubmed compound XlogP -2 -3,
(专业文档是经验性极强的领域,无法思考和涵盖全面,素材和资料部分来自网
络,供参考。可复制、编制,期待你的好评与关注)