3、原电池正、负极规律 ①负极——电子 流出 的极。通常是活泼性 较强 的
金属,发生 氧化 反应 ②正极——电子 流入 的极。通常是活泼性 较弱 的金属 或非金属导体,发生 还原 反应
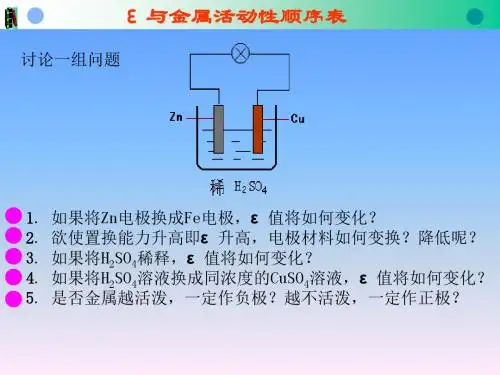
例如:如图,Zn电极是 (填“正”或“负” ,下同)
极,其电极反应为
,
Cu电极是 极,其电极反应为
,
该反应是
反应;
【复习】1、原电池的定义 2、原电池的构成条件 3、原电池的正负极规律
Cu
Zn
稀H2SO4
回顾旧知
1、原电池 将化学能转变为电能 的装置。 原电池反应的本质是发生____氧_ 化_还__原_____反应。 2、原电池的构成条件:
①有两种活泼性不同的金属(或其中一种为非金属导体) ②电解质溶液 ③构成闭合回路 ④能自发地发生氧化还原反应
介绍新知
锌半电池 负极反应:Zn-2e-= Zn2+ 铜半电池 正极反应:Cu2++2e- = Cu
电池总反应:Zn+Cu2+= Zn2++Cu
盐桥里装其它电解质 溶液行吗?
这样对电流有没有影 响?
科学视野
溶液的导电能力与离子的迁移速率有关 阴阳离子的迁移速率接近可以提高导电能力
298.15K时一些离子在水溶液中的离子迁移率U(m2•S-1 • V-1)
双液原电池构介成绍:新知
盐桥
__锌__半__电__池__ _铜__半__电__池__
介绍盐桥
盐桥中一般装有 饱和的KCl溶液和 琼脂制成的胶冻;
胶冻的作用是防 止管中溶液流出;
K+和Cl-能在胶冻 内自由移动。
介绍新知
盐桥的作用:
(1)传递阴阳离子,使两个烧杯中的溶液连 成一个通路 (2)平衡电荷,保持溶液电中性