高中化学竞赛 中级无机化学 金属原子簇
- 格式:ppt
- 大小:1.74 MB
- 文档页数:36

第十九章 过渡元素(II)Chapter 19 The Transition Elements (II)第VIIIB 族元素包括九种元素1.Ferrous metals :Iron (Fe) Cobalt (Co) Nickel (Ni)2.Platinum metals :Ruthenium (Ru) Rhodium (Rh) Palladium (Pd) Osmium (Os) Iridium (Ir) Platinum (Pt)铂系元素又被称为稀有元素,它们与金、银一起又称为贵金属(noble metals ) Valence electron configuration (n - 1)d x n s 2(x = 6、7、8) 例外:Ru 4d 75s 1, Rh 4d 85s 1, Pd 4d 105s 0, Pt 5d 96s 1§19-1 铁系元素 The Ferrous Elements包括:Iron (Ferrum) (Fe) Cobalt (Co) Nickel (Ni) 一、General Properties1.它们最外层4s 原子轨道上都有二个电子,只是次外层的3d 轨道上的电子数分别为6、7、8,而且原子半径又十分相近,所以它们的性质很相似。
2.Oxidation states :过渡元素(II)的最高氧化态,除了Os 、Ru 形成+8氧化态外,其它各元素的最高氧化态都小于8,这说明过渡元素(II)的d 轨道上的电子只能部分参与成键。
Fe 主要是+2、+3氧化态,也有+6氧化态;Co 主要是+2、+3氧化态,也有+4、+5氧化态的报导;Ni 主要是+2、+3氧化态,也有+4氧化态。
Fe 、Co 、Ni 的低氧化态(0、-1、-2)等出现在金属羰基配合物中,如:Fe(CO)5、-24Fe(CO)、-4Co(CO)、-262](CO)Ni [等。
二、The Simple Substances1.Physical properties :(1) 铁系元素的熔、沸点随原子序数的增加而降低,这可能是因为3d 轨道中成单电子数依次减少,金属晶体中自由电子数减少,金属键减弱的缘故;(2) 它们都具有金属光泽,都是铁磁性物质(ferromagnetism );(3) 密度随原子序数的增大而增大,这是由于铁系元素的原子半径随原子序数的增大而变小的缘故。



高中化学竞赛无机化学6高中化学竞赛中的无机化学部分,是一个充满挑战与趣味的领域。
在这其中,第六部分的知识更是涵盖了众多关键的概念和原理。
首先,让我们来聊聊原子结构。
原子是构成物质的基本单位,了解其结构对于理解化学性质至关重要。
原子核位于原子的中心,由质子和中子组成,而电子则围绕着原子核高速运动。
质子的数量决定了元素的种类,而原子的质量主要由质子和中子共同决定。
电子在不同的能级轨道上运动,其分布遵循特定的规律。
比如,能层、能级、原子轨道等概念,都是理解电子运动状态的重要基础。
说到化学键,这可是无机化学中的重点。
离子键是通过阴阳离子之间的静电作用形成的,通常在活泼金属与活泼非金属之间形成。
共价键则是原子之间通过共用电子对形成的,分为极性共价键和非极性共价键。
金属键则存在于金属单质中,是由金属阳离子和自由电子之间的相互作用形成的。
这些不同类型的化学键决定了物质的物理性质和化学性质。
比如离子化合物通常具有较高的熔点和沸点,而共价化合物的性质则较为多样。
元素周期表是无机化学的重要工具。
在高中化学竞赛中,对元素周期表的深入理解是必不可少的。
同一周期的元素,从左到右,原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。
同一主族的元素,从上到下,原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。
这些规律有助于我们预测元素的性质和化合物的形成。
再来看看无机化合物。
氧化物是其中的一大类,包括酸性氧化物、碱性氧化物和两性氧化物等。
酸和碱的性质和分类也是重要的考点。
强酸强碱在溶液中完全电离,而弱酸弱碱则部分电离。
盐的种类繁多,有正盐、酸式盐和碱式盐等。
了解它们的水解规律对于判断溶液的酸碱性非常关键。
化学反应速率和化学平衡也是竞赛中的重点。
影响化学反应速率的因素有浓度、温度、压强、催化剂等。
而化学平衡则是一个动态平衡,当外界条件改变时,平衡会发生移动。
通过勒夏特列原理,我们可以判断平衡移动的方向。
在无机化学的实验部分,各种实验操作和实验现象需要我们熟练掌握。
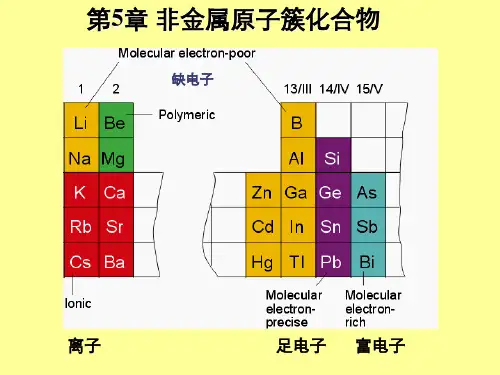


金属原子簇化合物金属原子簇化合物是由金属原子通过化学反应形成的簇状结构的化合物。
这些簇化合物具有特殊的性质和应用潜力,引起了科学家们的广泛关注和研究。
金属原子簇化合物的形成是通过金属原子之间的相互作用而实现的。
金属原子倾向于通过电子的共享或转移来形成金属键。
在形成簇化合物时,金属原子通过适当的化学反应被组合在一起,形成具有特定结构和组成的簇体。
这些簇体通常由几个到数百个金属原子组成,形成不同的形状和尺寸。
金属原子簇化合物的研究主要集中在以下几个方面:1. 结构和组成:研究金属原子簇化合物的结构和组成是了解其性质和行为的基础。
通过使用X射线衍射、质谱、光谱等技术,科学家们可以确定簇体的原子排列和组成,从而揭示其微观结构。
2. 物理性质:金属原子簇化合物具有与宏观金属不同的物理性质。
由于其尺寸较小,金属原子簇化合物可以显示出量子效应,如量子尺寸效应、表面效应等。
此外,金属原子簇化合物的电子结构和磁性也具有独特的特点。
3. 化学性质:金属原子簇化合物的化学性质也是研究的重点之一。
金属原子簇化合物可以与其他分子或原子发生反应,形成新的化合物。
这些反应可以产生一系列新的化学性质和应用,如催化、氧化还原反应等。
4. 应用潜力:金属原子簇化合物具有广泛的应用潜力。
由于其特殊的结构和性质,金属原子簇化合物可以应用于催化剂、传感器、电子器件等领域。
例如,纳米金属簇化合物可以用作高效催化剂,具有广泛的应用前景。
金属原子簇化合物是一类具有特殊结构和性质的化合物。
通过研究金属原子簇化合物的结构、物理性质、化学性质和应用潜力,科学家们可以更好地理解和利用这些簇化合物的特点。
随着技术的不断进步,金属原子簇化合物的研究将为我们提供更多的新材料和应用。


第十九章 过渡元素(II)Chapter19 The Transition Elements (II)第VIIIB 族元素包括九种元素1.Ferrous metals :Iron (Fe)Cobalt (Co) Nickel (Ni)2.Platinum metals :Ruthenium (Ru)Rhodium (Rh)Palladium (Pd) Osmium (Os) Iridium (Ir) Platinum (Pt)铂系元素又被称为稀有元素,它们与金、银一起又称为贵金属(noble metals ) Valence electron configuration (n - 1)d x n s 2(x = 6、7、8) 例外:Ru 4d 75s 1, Rh 4d 85s 1, Pd 4d 105s 0, Pt 5d 96s 1§19-1 铁系元素 The Ferrous Elements包括:Iron (Ferrum)(Fe) Cobalt (Co) Nickel (Ni) 一、General Properties1.它们最外层4s 原子轨道上都有二个电子,只是次外层的3d 轨道上的电子数分别为6、7、8,而且原子半径又十分相近,所以它们的性质很相似。
2.Oxidation states :过渡元素(II)的最高氧化态,除了Os 、Ru 形成+8氧化态外,其它各元素的最高氧化态都小于8,这说明过渡元素(II)的d 轨道上的电子只能部分参与成键。
Fe 主要是+2、+3氧化态,也有+6氧化态;Co 主要是+2、+3氧化态,也有+4、+5氧化态的报导;Ni 主要是+2、+3氧化态,也有+4氧化态。
Fe 、Co 、Ni 的低氧化态(0、-1、-2)等出现在金属羰基配合物中,如:Fe(CO)5、-24Fe(CO)、-4Co(CO)、-262](CO)Ni [等。
二、The Simple Substances 1.Physical properties :(1)铁系元素的熔、沸点随原子序数的增加而降低,这可能是因为3d 轨道中成单电子数依次减少,金属晶体中自由电子数减少,金属键减弱的缘故;(2)它们都具有金属光泽,都是铁磁性物质(ferromagnetism );(3)密度随原子序数的增大而增大,这是由于铁系元素的原子半径随原子序数的增大而变小的缘故。
