2024届高考化学一轮复习课件(人教版)第十一单元 有机化学 第5讲
- 格式:ppt
- 大小:5.15 MB
- 文档页数:109

第69讲 以物质制备为主的综合实验
[复习目标] 1.掌握物质制备型实验方案设计的原则。2.掌握解答物质制备型实验综合题的思维模型。
类型一 无机物的制备
1.常见的气体发生装置
辨认下列常见的气体发生装置,完成下列问题:
(1)①用氯化铵与消石灰制取氨气,化学方程式为_____________________________,选用装置:______(填字母,下同)。
答案 2NH4Cl+Ca(OH)2=====△CaCl2+2NH3↑+2H2O A
②用浓氨水与碱石灰制取氨气,选用装置:____________________________________。
答案 C
(2)①用碳酸钠与稀硫酸制取二氧化碳,选用装置:__________。
答案 C
②用石灰石与稀盐酸制取二氧化碳,选用装置:__________。
答案 B或C
(3)①用浓盐酸与二氧化锰制取氯气,化学方程式为______________________________,选用装置:______。
答案 MnO2+4HCl(浓)=====△MnCl2+Cl2↑+2H2O D
②用漂白粉与浓盐酸制取少量氯气,化学方程式为___________________________________,选用装置:______。
答案 Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O C
(4)铜与浓硝酸反应制取二氧化氮,选用装置:__________。
答案 C (5)实验室制取乙烯的装置,可以通过选用上面哪个装置进行改进?若橡皮塞最多只允许打两个孔,应如何改进所选实验装置: _____________________________________。
答案 D,将分液漏斗换成温度计(或将烧瓶换成蒸馏烧瓶,将导气管换成温度计)
(6)上述B装置还能制取的气体有:__________________________________________。

第34讲 分子的性质 配合物与超分子
[复习目标] 1.理解分子的极性。2.掌握范德华力的含义及对物质性质的影响。 3.理解氢键的含义, 能列举存在氢键的物质, 并能解释氢键对物质性质的影响。4.理解配位键的含义。5.了解超分子的概念。
考点一 键的极性与分子极性
1.键的极性
(1)极性键与非极性键的比较
极性键 非极性键
成键原子 不同种元素的原子间 同种元素的原子间
电子对 发生偏移(电荷分布不均匀)
不发生偏移(电荷分布均匀)
成键原子的电性 Hδ+—Clδ- 呈电中性
思考 如何判断共价键极性的强弱?
提示 成键元素电负性值差异越大,共价键的极性越强。
(2)键的极性对化学性质的影响
键的极性对羧酸酸性大小的影响实质是通过改变羧基中羟基的极性而实现的,羧基中羟基的极性越大,越容易电离出H+,则羧酸的酸性越强。
①与羧基相邻的共价键的极性越大,羧基中羟基的极性越大,则羧酸的酸性越强。
②烷基是推电子基团,从而减小羟基的极性,导致羧酸的酸性减小。一般地,烷基越长,推电子效应越大,羧酸的酸性越弱。
2.极性分子和非极性分子
(1)概念
极性分子:分子的正电中心和负电中心不重合,键的极性的向量和不等于零。
非极性分子:分子的正电中心和负电中心重合,键的极性的向量和等于零。
(2)极性分子和非极性分子的判断方法
①A—A型分子一定是非极性分子、A—B型分子一定是极性分子。
②判断ABn型分子极性的两条经验规律
a.中心原子A化合价的绝对值等于该元素原子最外层电子数,则为非极性分子,反之则为极性分子。
b.中心原子A没有孤电子对,则为非极性分子,反之则为极性分子。
一、有关羧酸酸性强弱的判断及归因分析
1.试比较下列有机酸的酸性强弱。
①CF3COOH ②CCl3COOH ③CHCl2COOH
④CH2ClCOOH ⑤CH3COOH
⑥CH3CH2COOH
答案 ①>②>③>④>⑤>⑥
2.酸性:氟乙酸大于氯乙酸的原因是电负性:F>Cl,C—F的极性大于C—Cl的极性,导致氟乙酸羧基中的羟基的极性更大,更易电离出H+,故氟乙酸的酸性大于氯乙酸的酸性。
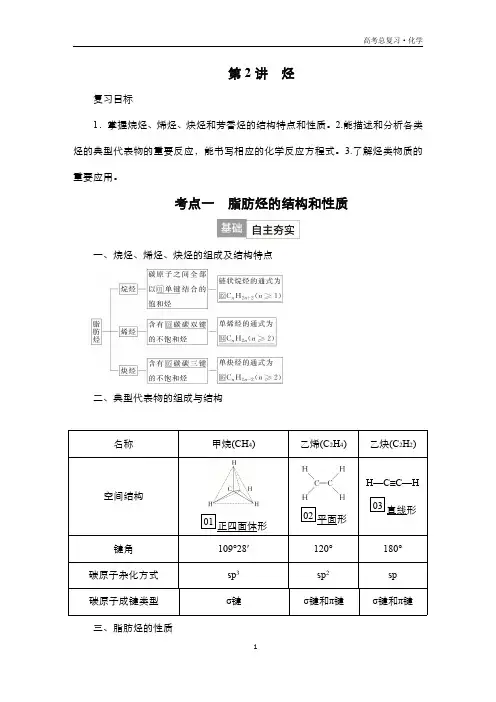
1第2讲烃
复习目标
1.掌握烷烃、烯烃、炔烃和芳香烃的结构特点和性质。2.能描述和分析各类
烃的典型代表物的重要反应,能书写相应的化学反应方程式。3.了解烃类物质的
重要应用。
考点一脂肪烃的结构和性质一、烷烃、烯烃、炔烃的组成及结构特点
二、典型代表物的组成与结构
名称甲烷(CH
4)乙烯(C
2H
4)乙炔(C
2H
2)
空间结构
01正四面体形02平面形H—C≡C—H
03直线形
键角109°28′120°180°
碳原子杂化方式sp3sp2sp
碳原子成键类型σ键σ键和π键σ键和π键
三、脂肪烃的性质
21.物理性质
物理性质变化规律
状态常温下01
≤4个碳原子的烃都是气态,随着碳原子数的增多,逐渐
过渡到02液态、固态
沸点随着碳原子数的增多,沸点逐渐03升高;同分异构体之间,支链越
多,沸点04越低
相对密度随着碳原子数的增多,相对密度逐渐增大,密度均比水05小
水溶性均难溶于水
2.化学性质
(1)氧化反应
烷烃烯烃炔烃
酸性
KMnO
4
溶液是
否褪色01不褪色02褪色03褪色
燃烧通
式CxH
y+04x+y
4O
2――→点燃05xCO
2+y
2H
2O
(2)烷烃的取代反应
①取代反应:有机物中某些原子或原子团被其他原子或原子团所替代的反应。
②烷烃的卤代反应。
3
如甲烷和氯气生成一氯甲烷:06CH
4+Cl2――→光照
CH3Cl+HCl。
a.反应条件:07光照。
b.无机试剂:08卤素单质。c.产物特点:09多种卤代烃混合物+HX(X为卤素原子)。d.量的关系:取代1mol氢原子,消耗101mol卤素单质。
(3)烯烃、炔烃的加成反应(写出有关反应方程式)
(4)烯烃、炔烃的加聚反应
①乙烯的加聚反应方程式:
420nCH
2===CH
2――――→催化剂
CH
2—CH2。
②乙炔的加聚反应方程式:
21nCH≡CH――――→催化剂CH===CH。
③1,3丁二烯的加聚反应方程式:22nCH
2===CH—CH===CH
2――――→催化剂
CH
2—CH===CH—CH2。
四、脂肪烃的来源和用途

1
高考题型专项突破 有机综合推断
(2022·全国乙卷节选)左旋米那普伦是治疗成人重度抑郁症的药物之一,以下是其盐酸盐(化合物K)的一种合成路线(部分反应条件已简化,忽略立体化学):
已知:化合物F不能与饱和碳酸氢钠溶液反应产生二氧化碳。
回答下列问题:
(1)C的结构简式为______________。
(2)写出由E生成F反应的化学方程式______________________________。
(3)E中含氧官能团的名称为______________。
(4)由G生成H的反应类型为____________。
(5)I是一种有机物形成的盐,结构简式为__________________。
[解题思路分析] A发生氧化反应生成B,B与C在NaNH2、甲苯条件下反应生成D,对比B、D的结构简式,结合C的分子式C8H7N,可推知C的结构简 2 式为;D与30% Na2CO3反应后再酸化生成E,E在浓硫酸、甲苯条件下反应生成F,F不能与饱和NaHCO3溶液反应产生CO2,说明不含羧基,再结合E的结构和F的分子式C11H10O2,推出E发生分子内酯化生成F,则F的结构简式为;F与(C2H5)2NH在AlCl3、甲苯条件下反应生成G,G与SOCl2在甲苯条件下反应生成H,H的分子式为C15H20ClNO,H与I反应生成J,结合G、J的结构简式知,H的结构简式为;I的分子式为C8H4KNO2,I是一种有机物形成的盐,则I的结构简式为。
[答案] (1)
(2)浓硫酸甲苯+H2O
(3)羟基、羧基 (4)取代反应
(5)
1.通过物理特征突破
有机化合物中各类代表物的状态、气味、溶解性、密度、熔点、沸点等往往
3
各有特点,解题时可考虑通过物理特征找到题眼。
2.根据反应物、产物分子式特征推断有机物结构及反应类型
分析反应物、产物的分子式特征,根据其差异,联想已有有机化学知识,猜想可能的有机反应类型,由此确定反应物、产物的结构特点,结合框图中的其他物质,确定具体的结构。如:

2014届三厂中学高三化学 一轮复习讲义 有机化学 编制:陈达 审核:张健 2013-12-26 总编号:56
1 专题十三 有机化学基础
第十一课时 糖类、油脂、蛋白质
【课堂目标】
1.了解糖类、油脂、蛋白质的组成、结构和主要性质及重要应用。
2.了解氨基酸的组成、结构特点和主要化学性质,了解氨基酸与人体健康的关系。
【基础梳理】
人体必须的六大营养要素为: 、 、 、维生素、水、无机盐。
活动一:糖类
1.“一单”——葡萄糖
最重要的是葡萄糖,它的化学式为 ,结构简式为 ,
是一种多羟基醛。
葡萄糖是还原性糖,其化学性质兼有醛基和羟基的性质:
①银镜反应——制镜业;
反应的化学方程式: 。
②被新制的Cu(OH)2悬浊液氧化——检测糖尿病患者;
反应的化学方程式: 。
③人体内氧化——维持生命活动需要的能量;
④加氢还原;
⑤在酒化酶作用下的分解反应——制酒精;
反应的化学方程式: 。
⑥酯化反应(1mol葡萄糖可与 mol乙酸发生酯化反应)。
葡萄糖的同分异构体是果糖(C6H12O6),它是一种多羟基酮:
CH2OH-(CHOH)3-CO-CH2OH ——用于糖果制造业。
2.“两二”——蔗糖和麦芽糖
蔗糖和麦芽糖化学式都为 ,是同分异构体,蔗糖是非还原性糖,麦芽糖是还原性糖。
蔗糖和麦芽糖发生水解反应的化学方程式分别为: