《中国药典》2010年版2部-方法验证
- 格式:pdf
- 大小:226.90 KB
- 文档页数:2

2010版中国药典2010版中国药典二部word版电子书凡例总则一、《中华人民共和国药典》简称《中国药典》,依据《中华人民共和国药品管理法》组织制定和颁布实施。
《中国药典》一经颁布实施,其同品种的上版标准或其原国家标准即同时停止使用。
《中国药典》由一部、二部、三部及其增补本组成,内容分别包括凡例、正文和附录。
除特别注明版次外,《中国药典》均指现行版《中国药典》。
本部为《中国药典》二部。
二、国家药品标准由凡例与正文及其引用的附录共同构成。
本部药典收载的凡例、附录对药典以外的其他中药国家标准具同等效力。
三、凡例是为正确使用《中国药典》进行药品质量检定的基本原则,是对《中国药典》正文、附录及与质量检定有关的共性问题的统一规定。
四、凡例和附录中采用的“除另有规定外”这一用语,表示存在与凡例或附录有关规定不一致的情况时,则在正文中另作规定,并按此规定执行。
2010版中国药典word版pdf版exe版五、正文中引用的药品系指本版药典收载的品种,其质量应符合相应的规定。
六、正文所设各项规定是针对符合《药品生产质量管理规范》(Good Manufacturing Practices, GMP)的产品而言。
任何违反GMP 或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》没有检出其添加物质或相关杂质,亦不能认为其符合规定。
七、《中国药典》的英文名称为Pharmacopoeia of The People’s Republic of China, 英文简称Chinese Pharmacopoeia;英文缩写为Ch.P.。
正文八、正文系根据药物自身的理化与生物学特性,按照批准的处方来源、生产工艺、贮藏运输条件等所制定的、用以检测药品质量是否达到用药要求并衡量其质量是否稳定均一的技术规定。
九、正文项下根据品种和剂型不同,按顺序可分别列有:(1)品名(包括中文名称、汉语拼音与英文名);(2)有机药物的结构式;(3)分子式与分子量;(4)来源或有机药物的化学名称;(5)含量或效价规定;(6)处方;(7)制法;(8)性状;(9)鉴别;(10)检查;(11)含量或效价测定;(12)类别;(13)规格;(14)贮藏;(15)制剂等。

无菌检查法无菌检查法系用于检查药典要求无菌的药品、医疗器具、原料、辅料及其他品种是否无菌的一种方法。
若供试品符合无菌检查法的规定,仅表明了供试品在该检验条件下未发现微生物污染。
无菌检查应在环境洁净度10000级下的局部洁净度100级的单向流空气区域内或隔离系统中进行,其过程必须严格遵守无菌操作,防止微生物污染,防止污染的措施不得影响供试品中微生物的检出。
单向流空气区、工作台面及环境应定期按《医药工业洁净室(区)悬浮粒子、浮游菌和沉降菌的测试方法》的现行国家标准进行洁净度验证。
隔离系统按相关的要求进行验证,其内部环境的洁净度须符合无菌检查的要求。
日常验证还需对试验环境进行监控。
菌检查人员必须具备微生物专业知识,并经过无菌技术的培训。
第一部分准备及保障1 洁净室(区)的要求无菌检查的所有操作均需在严格控制微生物污染的环境下进行,操作环境的无菌保障程度将直接影响无菌检查结果,为了保证无菌检查用洁净室(区)环境的稳定性,确保检查结果的可靠性,对洁净室(区)的环境质量采取合理的控制措施和评价方法是必要的。
无菌加查应在环境洁净度10000级下的局部洁净度100级的单向流空气区域内或隔离系统中进行,其过程必须严格遵守无菌操作,防止微生物污染。
单向流空气区、工作台面及环境应定期按《医药工业洁净室(区)悬浮粒子、浮游菌和沉降菌的测试方法》的现行国家标准进行洁净度验证。
隔离系统按相关的要求进行验证,其内部环境的洁净度须符合无菌检查的要求。
洁净室(区)应采光良好、避免潮湿。
远离厕所及污染区。
由1~2个缓冲间和操作间组成(操作间和缓冲间的门不应直对),操作间与缓冲间之间应具备灭菌功能的样品传递箱。
在缓冲间内应有拖鞋、无菌衣放置架和挂钩等,缓冲间可设手消毒设备,不应放置培养箱和其他杂物;洁净室(区)内应六面光滑平整,能耐受清洗消毒。
墙壁与地面、天花板连接处应呈凹弧形,无缝隙,不留死角。
操作间和缓冲间内不应安装下水道。
无菌操作室应具有空气除菌过滤的单向流空气装置,操作区洁净度100级或放置同等级别的超净工作台,室内温度控制18~26℃,相对湿度40%~60%。



附录Ⅻ A 无菌检查法无菌检查法系用于检查药典要求无菌的生物制品、医疗器具、原料、辅料、及其他品种是否无菌的一种方法。
若供试品符合无菌检查法的规定,仅表明了供试品在该检验条件下未发现微生物污染。
无菌检查应在环境洁净度10 000 级下的局部洁净度100 级的单向流空气区域内或隔离系统中进行,其全过程应严格遵守无菌操作,防止微生物污染,防止污染的措施不得影响供试品中微生物的检出。
单向流空气区、工作台面及环境应定期按《医药工业洁净室(区)悬浮粒子、浮游菌和沉降菌的测试方法》的现行国家标准进行洁净度验证。
隔离系统应按相关的要求进行验证,其内部环境的洁净度须符合无菌检查的要求。
日常检验还需对试验环境进行监控。
无菌检查人员必须具备微生物专业知识,并经过无菌技术的培训。
培养基培养基的制备培养基可按以下处方制备,亦可使用按该处方生产的符合规定的脱水培养基。
配制后应采用验证合格的灭菌程序灭菌。
制备好的培养基应保存在2℃~25℃、避光的环境,若保存于非密闭容器中,一般在三周内使用;若保存于密闭容器中,一般可在一年内使用。
1. 硫乙醇酸盐流体培养基酪胨(胰酶水解) 15.0g 酵母浸出粉 5.0g葡萄糖 5.0g 氯化钠 2.5gL-胱氨酸0.5g 新配制的0.1% 刃天青溶液 1.0 ml硫乙醇酸钠0.5g 琼脂0.75g(或硫乙醇酸) (0.3 ml) 水1000 ml除葡萄糖和刃天青溶液外,取上述成分混合,微温溶解,调节pH 为弱碱性,煮沸,滤清,加入葡萄糖和刃天青溶液,摇匀,调节pH 值使灭菌后为7.1 ±0.2 。
分装至适宜的容器中,其装量与容器高度的比例应符合培养结束后培养基氧化层(粉红色)不超过培养基深度的1/2 ,灭菌。
在供试品接种前,培养基氧化层的高度不得超过培养基深度的1/5 ,否则,须经100 ℃水浴加热至粉红色消失(不超过20 分钟),迅速冷却,只限加热一次,并防止被污染。
2.改良马丁培养基胨 5.0g 磷酸氢二钾 1.0g酵母浸出粉 2.0g 硫酸镁0.5g葡萄糖20.0g 水1000 ml除葡萄糖外,取上述成分混合,微温溶解,调节pH 值约为6.8 ,煮沸,加入葡萄糖溶解后,摇匀,滤清,调节pH 值使灭菌后为6.4 ±0.2 ,分装,灭菌。
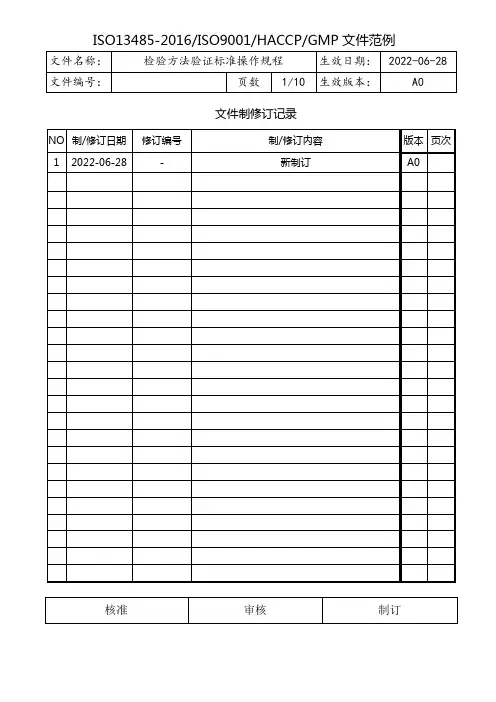
文件制修订记录目的:建立检验方法验证标准操作规程,规范验证操作。
适用范围:所有检验方法的验证。
责任者:质量保证部、质量控制部程序:1、检验方法验证的基本内容检验方法验证的基本内容包括方案的起草及审批,检测仪器的确认.适用性验证(包括准确度试验、精密度测定.线性范围试验、专属性试验等)和结果评价及批准四个欠的方面。
它的基本内容可以用下图表示。
2、检验方法验证的基本步骤首先是制定验证方案,然后对大型精密仪器进行确认,最关键的一步是检验方法的适用性试验,最后是检验方法评价及批准。
2.1验证方案的制定检验方法的验证方案通常由质量验证小组提出。
根据产品的工艺条件、原辅料化学结构、中间体、分解产物查阅有关资料,提出规格标准,确定检查项目,规定杂质限度,即为质量标准草案。
根据质量标准草案确定检查和试验范围,对检验方法拟定具体操作步骤,最后经有关人员审批方可实施。
2.2大型精密仪器的确认分析测试中所用的检测仪器一般可分为三类(1)普通仪器:崩解仪,折光仪、分析天平、酸度计、溶点测定仪、电导仪等:(2)较精密仪器:旋光仪、永停滴定仪、费休氏水分测定仪、自动滴定仪、药物溶出度仪、可见分光光度计、电泳仪等;(3)大型精密仪器:紫外分光光度计、红外分光光度计、气相色谱仪、高效液相色谱仪、薄层扫描仪等。
为了保证分析测试数据准确可靠,每台检测仪器在投入正式使用之前都应进行确认。
检测仪器的确认是检验方法验证的基础,应在其它验证试验开始之前首先完成。
检测仪器确认工作内容应根据仪器类型。
技术性能而定,通常包括:安装确认、校正、适用性预试验和再确认。
2.2.1安装确认同工艺验证中机械设备一样,仪器安装确认的土要内容包括如下各点:(1)要登记仪器名称.型号。
生产厂商的编号、生产日期.生产厂商名称,企业内部的固定资产设备登记号及安装地点;(2)收集汇编和翻译仪器使用说明书和维修保养手册;(3)检查并记录所验收的仪器是否符合厂方规定的规格标准:(4)检查并确保有该仪器的使用说明书。

细菌内毒素方法学验证方案生效日期:再验证时间:审批表1.概述细菌内毒素检查法在药品的热原限量控制中应用广泛,本方案通过对无菌氯化钠溶液、配套药盒和本公司所生产的锝[99m Tc]放射性药品的细菌内毒素检测,对生产过程进行质量控制。
因此对细菌内毒素检验方法的验证就显得尤为重要。
2.目的为了保证所购买的无菌氯化钠溶液、配套药盒和本公司所生产的锝[99m Tc]放射性药品的细菌内毒素检验方法的专属性和灵敏性,且保证检测结果可符合质量标准要求,特制定此方案。
3.范围本方案适用于无菌氯化钠溶液、配套药盒以及本公司所生产的锝[99m Tc]放射性药品的无菌检查方法的验证。
4.确认小组成员与职责成立确认小组,明确各成员及相应职责。
5.参考文件5.1确认与验证管理规程5.2《中国药典》2010年版二部附录XI E6.验证所需仪器和材料6.1验证中所用到的仪器:电子天平、电热干燥箱、恒温水浴箱、水银温度计和旋涡混合器,验证所涉及到的仪器均经过检定或确认合格,且在有效期内。
6.2验证所需试剂:具有国家主管部门的批准文号的鲎试剂和由中国药品生物制品检定所统一发放的细菌内毒素工作标准品。
7.验证标准在实验结果中,必须要阳性对照都为阳性、供试品阳性对照都为阳性且阴性对照都为阴性时,实验有效。
8.验证步骤8.1实验前准备验证前首先要进行细菌内毒素标准品的制备,内毒素限值的确定。
然后确认鲎试剂是否进行灵敏度复核和干扰试验。
确定干扰试验中的最大稀释倍数(MVD)。
8.1.1根据2010年版中国药典二部附录ⅪE细菌内毒素检查法中规定,细菌内毒素限值计算公式:L=K/M式中L为供试品的细菌内毒素限值,本品以EU/mg表示;K为人每千克体重每小时最大可接受的内毒素剂量,注射剂K=5EU/(kg.h);M为人用每千克体重每小时的最大供试品剂量,人均体重按60kg计算,人体表面积按1.62m2计算。
注射时间若不足1小时,按1小时计算。
本品以腺苷蛋氨酸计最大剂量为1000mg。




目录1.概述 (2)2.目的 (3)3.依据及参考文件 (3)4.验证小组和各部门职责 (3)5.验证时间安排.......................................................................................... 错误!未定义书签。
6.验证内容.................................................................................................. 错误!未定义书签。
7. 偏差处理及变更控制............................................................................ 错误!未定义书签。
8.验证结果评价内容.................................................................................. 错误!未定义书签。
附件1 :《培训确认》............................................................................ 错误!未定义书签。
附件2:《文件检查确认》...................................................................... 错误!未定义书签。
附件3 :《设备确认结果》.................................................................... 错误!未定义书签。
附件4 :《试验器材确认结果》............................................................ 错误!未定义书签。
⼲货分析⽅法的验证和确认。
本⽂将从四个⽅⾯来讲解分析⽅法的验证和确认,欢迎了解。
⼀、法规要求⼆、分析⽅法验证三、分析⽅法确认四、分析⽅法验证和确认总结⼀.法规要求:新版GMP(2010年修订)第⼆百⼆⼗三条 物料和不同⽣产阶段产品的检验应当⾄少符合以下要求:(⼀)企业应当确保药品按照注册批准的⽅法进⾏全项检验。
(⼆)符合下列情形之⼀的,应当对检验⽅法进⾏验证。
1.采⽤新的检验⽅法;2.检验⽅法需变更的;3.采⽤《中华⼈民共和国药典》及其他法定标准未收载的检验⽅法;4.法规规定的其他需要验证的检验⽅法。
(三)对不需要进⾏验证的检验⽅法,企业应当对检验⽅法进⾏确认,以确保检验数据准确、可靠。
法规要求:中国药典(2010年版)凡例1.检验⽅法和限度。
2.应将该⽅法与规定的⽅法做⽐较试验,根据试验结果掌握使⽤,但在仲裁时仍以本版药典规定的⽅法为准。
法规要求:分析⽅法确认或验证相关指南⼆.分析⽅法验证分析⽅法验证的定义;分析⽅法验证的⽬的;分析⽅法验证范围;分析⽅法验证的时机;需验证的分析⽅法类型;分析⽅法验证的具体内容;验证检测项⽬⼩结;分析⽅法验证的⽅式和步骤;分析⽅法验证常见问题;1.分析⽅法验证的定义是根据检测项⽬的要求,预先设置⼀定的验证内容,并通过设计合理的试验来验证所采⽤的分析⽅法能否符合检测项⽬的要求。
2.分析⽅法验证的⽬的(1)证明采⽤的分析⽅法是科学、合理。
(2)证明分析⽅法能有效控制药品的内在质量。
♦验证过程和结果均应记载在标准起草或修订说明中。
3.分析⽅法验证范围(1)适⽤范围:化学药品的理化分析⽅法和仪器分析⽅法的验证与确认;清洁验证⽅法的验证。
(2)不适⽤:化学药品的微⽣物⽅法;⽣物制品分析⽅法验证。
4.分析⽅法验证的时机(1)建⽴新的药品质量标准;(2)药品⽣产⼯艺变更;(3)制剂的组分变更;(4)对原分析⽅法进⾏修订时。
⽅法验证理由、过程和结果均应记载在药品标准起草说明或修订说明中。
2010版中国药典凡例总则一、《中华人民共和国药典》简称《中国药典》,依据《中华人民共和国药品管理法》组织制定和颁布实施。
《中国药典》一经颁布实施,其同品种的上版标准或其原国家标准即同时停止使用。
《中国药典》由一部、二部、三部及其增补本组成,内容分别包括凡例、正文和附录。
除特别注明版次外,《中国药典》均指现行版《中国药典》。
本部为《中国药典》二部。
二、国家药品标准由凡例与正文及其引用的附录共同构成。
本部药典收载的凡例、附录对药典以外的其他中药国家标准具同等效力。
三、凡例是为正确使用《中国药典》进行药品质量检定的基本原则,是对《中国药典》正文、附录及与质量检定有关的共性问题的统一规定。
四、凡例和附录中采用的“除另有规定外”这一用语,表示存在与凡例或附录有关规定不一致的情况时,则在正文中另作规定,并按此规定执行。
五、正文中引用的药品系指本版药典收载的品种,其质量应符合相应的规定。
六、正文所设各项规定是针对符合《药品生产质量管理规范》(Good Manufacturing Practices, GMP)的产品而言。
任何违反GMP 或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》没有检出其添加物质或相关杂质,亦不能认为其符合规定。
七、《中国药典》的英文名称为Pharmacopoeia of The People’s Republic of China, 英文简称Chinese Pharmacopoeia;英文缩写为Ch.P.。
正文八、正文系根据药物自身的理化与生物学特性,按照批准的处方来源、生产工艺、贮藏运输条件等所制定的、用以检测药品质量是否达到用药要求并衡量其质量是否稳定均一的技术规定。
九、正文项下根据品种和剂型不同,按顺序可分别列有:(1)品名(包括中文名称、汉语拼音与英文名);(2)有机药物的结构式;(3)分子式与分子量;(4)来源或有机药物的化学名称;(5)含量或效价规定;(6)处方;(7)制法;(8)性状;(9)鉴别;(10)检查;(11)含量或效价测定;(12)类别;(13)规格;(14)贮藏;(15)制剂等。