六方氮化硼和石墨的晶体结构比较相近
- 格式:doc
- 大小:36.00 KB
- 文档页数:3

专题04 物质结构与性质1.氮化硼(BN)是一种重要的功能陶瓷材料,以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:请回答下列问题:(1)由B2O3制备BF3、BN的化学方程式依次是、。
(2)基态B原子的电子排布式为_________;B和N相比,电负性较大的是___,BN中B元素的化合价为______。
(3)在BF3分子中,F-B-F的键角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为_______。
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______个氮原子、________个硼原子,立方氮化硼的密度是g·cm-3(只要求列算式,不必计算出数值。
阿伏伽德罗常数为N A)。
【答案】(1)B2O3+3 CaF2+3H2SO4 2 BF3↑+3 Ca SO4+3H2O B2O3+2NH32BN+3 H2O(2)1s22s22p1,N,+3(3)120º,sp2,正四面体(4)共价键(极性键),分子间作用力(5)4,4,。
【解析】(1)依据信息,书写化学方程式,依次为:B2O3+3 CaF2+3H2SO4 2 BF3↑+3 Ca SO4+3H2OB2O3+2NH32BN+3 H2O。
(2)基态B原子的电子排布式为1s22s22p1;B和N相比,电负性较大的是N,BN中B元素的化合价为+3。
(3)在BF3分子中,B原子杂化方式:sp2,键角是120º。
BF4-中心原子价层电子对为4,孤电子对为0,空间构型为正四面体。
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为共价键(极性键),层间作用力为分子间作用力。

一、选择题1.(0分)[ID :139814]下列各组物质中 ,化学键相同、晶体类型也相同的化合物是( ) A .Si 和SiO 2B .H 2O 和CO 2C .NaOH 和NaClD .KCl 和HCl2.(0分)[ID :139806]下列有关性质的比较中,正确的是 A .键的极性:N -H<O -H<F -H B .第一电离能:Na<Mg<Al C .硬度:白磷>冰>二氧化硅 D .熔点:>3.(0分)[ID :139800]氟在自然界中常以2CaF 的形式存在,下列关于2CaF 的表述正确的是A .2Ca +与-F 间仅存在静电吸引作用B .-F 的离子半径大于Cl -,则2CaF 的熔点高于2CaClC .阴阳离子比为2:1的物质均与2CaF 晶体构型相同D .2CaF 中的化学键为离子键,因此2CaF 在熔融状态下能导电4.(0分)[ID :139891]氧化亚铜(Cu 2O)主要用于制造杀虫剂、分析试剂和红色玻璃等。
在潮湿的空气中会逐渐氧化为黑色的氧化铜。
以肼(N 2H 4)为原料与醋酸铜反应制取Cu 2O 的反应为: 4 Cu (CH 3COO)2+N 2H 4+2H 2O=2Cu 2O ↓+N 2+8CH 3COOH 。
生成的沉淀需用水洗涤后,用乙醇洗涤。
下列说法不正确...的是A .N 2H 4能与水分子形成分子间氢键B .如图所示Cu 2O 的晶胞中,Cu +的配位数是4C .每生成标准状况下2.24 L N 2,反应转移电子数为0.4×6.02×1023D .沉淀用水洗后,再用乙醇洗可以除去Cu 2O 表面的水,防止被氧气氧化 5.(0分)[ID :139890]下列有关比较,正确的是A .在水中的溶解度:2533C H OH>CH OCHB .沸点:44CH >SiHC .熔点:晶体硅>金刚石D .键角:32NH <H O 6.(0分)[ID :139877]下列晶体属于离子晶体且阴、阳离子的立体构型相同的是 A .43NH NOB .34Si NC .44NH ClOD .34H PO7.(0分)[ID :139876]下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是 A .Cl 2+H 2O=HClO+HCl B .2Na 2O 2+2H 2O=4NaOH+O 2↑C .NH 4Cl+NaOH Δ−−→NaCl+NH 3↑+H 2OD .2FeCl 2+H 2O 2+2HCl=2FeCl 3+2H 2O8.(0分)[ID :139875]下列化合物中,含有极性共价键的离子化合物是 A .Na 2O 2B .N 2H 4C .CO 2D .NH 4NO 39.(0分)[ID :139874]利用Cl -取代 [Co(NH 3)5H 2O]3+离子中的H 2O 的方法制备配合物X :[Co(NH 3)5Cl]Cl 2。

氮化硼的空间结构
氮化硼的空间结构具有多种异构形式,包括六角氮化硼(h-BN)、菱形结构氮化硼(r-BN)、立方氮化硼(c-BN)和纤锌矿结构氮化硼(w-BN)。
其中,六方氮化硼具有类似石墨的层状结构,其颜色呈象牙白色,因此被称为“白石墨”。
在六方氮化硼中,每个层由B原子、N原子交替排列成环状六角形,这些六角形原子层沿C轴方向按AB-ABAB方式排列。
层内原子之间以很强的共价键结合起来,层间则以范德华力结合,结合力比较弱,使层与层之间容易滑动。
除了六方氮化硼,氮化硼还具有其他不同的空间结构。
例如,立方氮化硼是一种高温超导材料,其晶体结构为面心立方。
在立方氮化硼中,每个B原子与四个N原子形成共价键,形成稳定的立方结构。
此外,纤锌矿结构氮化硼也是一种常见的氮化硼异构体。
在纤锌矿结构氮化硼中,每个B原子与三个N原子形成共价键,形成类似金刚石的四面体结构。

六方氮化硼晶格结构
六方氮化硼(hBN)是一种具有特殊晶格结构的化合物。
它的晶格结构类似于石墨烯,由层状的六角环形结构组成。
下面详细介绍一下六方氮化硼的晶格结构:
六方氮化硼的晶格结构如图所示:
ABAB
/\/\/\/\
/\/\/\/\
A/\B/\A/\B/\
/\/\/\/\
//\/\/\/\
//\/\/\/\
CCCCCCCC
\/\//\//\//
\/\//\//\//
A\/B\/\/\/B\/\/\/B\/\/\/
\/C\/C\/C/
C\/\\/\/
\/\\/\/
AA
在六方氮化硼晶体中,氮原子(N)和硼原子(B)分别排列在不同的层中。
每一层都由两种原子交替堆积而成。
由于氮原
子与硼原子之间的价键较强,每层的原子之间非常结实,而不
同层之间仅通过弱的范德华力相互吸引,因此六方氮化硼具有
类似石墨烯的层状结构。
在晶体结构中,我们可以定义几个基本参数来描述晶格结构:a表示晶格常数,是指相邻两个A层之间的距离。
c表示晶格常数,是指相邻的A层和B层之间的距离。
α表示A层和B层之间的夹角,约为60°。
六方氮化硼的晶格结构使其具有一些特殊的性质,如高温稳
定性、优良的机械性能、优异的绝缘性等。
这些特性使得六方
氮化硼在许多领域有着广泛的应用,例如高温材料、陶瓷制品、电子器件、涂料等。

一、选择题1.下列关于晶体的说法中,不正确的是()①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性②含有金属阳离子的晶体一定是离子晶体③共价键可决定分子晶体的熔、沸点④MgO的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小⑤晶胞是晶体结构的基本单元⑥晶体尽可能采取紧密堆积方式,以使其变得比较稳定⑦CsCl和NaCl晶体中阴、阳离子的配位数都为6A.①②③B.②③④C.④⑤⑥D.②③⑦答案:D解析:①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性,故①正确;②金属晶体是由金属阳离子和自由电子构成的,所以含有金属阳离子的晶体不一定是离子晶体,可能是金属晶体,故②错误;③原子晶体中共价键可决定晶体的熔、沸点,但分子晶体中共价键不决定晶体的熔、沸点,故③错误;④MgO的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小,故④正确;⑤晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列,故⑤正确;⑥晶体尽可能采取紧密堆积方式,以使其变得比较稳定,故⑥正确;⑦NaCl为面心立方结构,钠离子的配位数为6,CsCl为体心立方结构,铯离子的配位数为8,故⑦错误。
所以为②③⑦故答案为D。
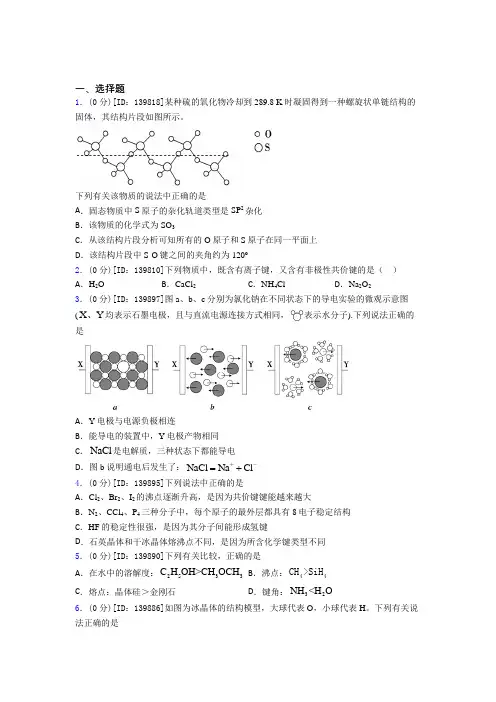
2.某种硫的氧化物冷却到289.8 K时凝固得到一种螺旋状单链结构的固体,其结构片段如图所示。
下列有关该物质的说法中正确的是A.固态物质中S原子的杂化轨道类型是SP2杂化B.该物质的化学式为SO3C.从该结构片段分析可知所有的O原子和S原子在同一平面上D.该结构片段中S-O键之间的夹角约为120º答案:B解析:A.由题给结构片段可知,每个硫原子的周围有4个氧原子,则固态物质中S原子的杂化轨道类型是SP3杂化,故A错误;B.由题给结构片段可知,每个硫原子的周围有4个氧原子,其中2个氧原子为该硫原子单独占有,还有2个氧原子为两个硫原子共有,则每个硫原子单独占有的氧原子数为3,氧化物的化学式为SO3,故B错误;C.由题给结构片段可知,每个硫原子的周围有4个氧原子,空间构型为四面体形,则所有的O原子和S原子不可能在同一平面上,故C错误;D.由题给结构片段可知,每个硫原子的周围有4个氧原子,空间构型为四面体形,不是平面三角形,则S-O键之间的夹角不可能约为120º,故D错误;故选B。

2020届高三化学二轮复习物质结构晶体专题训练1、太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、钴、硼、镓、硒等。
回答下列问题:(1)基态二价铜离子的电子排布式为__________________________________,已知高温下Cu2O比CuO更稳定,试从核外电子排布角度解释________________________________。
(2)铜的某种氧化物晶胞如图,该晶胞中阴离子的个数为____________。
(3)铜与(SCN)2反应生成Cu(SCN)2,1mol(SCN)2中含有π键的数目为______________,HSCN结构有两种,硫氰酸(H—S—C≡N)的沸点低于异硫氰酸(H—N===C===S)的原因是________________________________________________________________________。
(4)BF3能与NH3反应生成BF3·NH3。
B与N之间形成配位键,氮原子提供________,在BF3·NH3中B原子的杂化方式为________________。
(5)Co的一种氧化物CoO2晶体的层状结构如图所示(小球表示Co原子,大球表示O原子)。
下列用粗线画出的重复结构单元不能描述CoO2的化学组成的是________(填字母)。
(6)六方氮化硼晶体结构与石墨晶体相似,层间相互作用力为______。
六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构、硬度与金刚石相似,其晶胞如图,晶胞边长为361.5pm,立方氮化硼的密度是________g·cm-3(只列算式,N A为阿伏加德罗常数的值)。
答案(1)1s22s22p63s23p63d9(或[Ar]3d9)亚铜离子价电子排布式为3d10,核外电子处于稳定的全充满状态(2)4(3)4N A(或2.408×1024)异硫氰酸分子间可形成氢键,所以沸点较高(4)孤电子对sp3(5)D(6)分子间作用力(或范德华力)4×25N A×(361.5×10-10)32、铜元素可形成多种重要化合物。
一、选择题1.(0分)[ID :139818]某种硫的氧化物冷却到289.8 K 时凝固得到一种螺旋状单链结构的固体,其结构片段如图所示。
下列有关该物质的说法中正确的是A .固态物质中S 原子的杂化轨道类型是SP 2杂化B .该物质的化学式为SO 3C .从该结构片段分析可知所有的O 原子和S 原子在同一平面上D .该结构片段中S-O 键之间的夹角约为120º2.(0分)[ID :139810]下列物质中,既含有离子键,又含有非极性共价键的是( ) A .H 2OB .CaCl 2C .NH 4ClD .Na 2O 23.(0分)[ID :139897]图a 、b 、c 分别为氯化钠在不同状态下的导电实验的微观示意图(X Y 、均表示石墨电极,且与直流电源连接方式相同,表示水分子).下列说法正确的是A .Y 电极与电源负极相连B .能导电的装置中,Y 电极产物相同C .NaCl 是电解质,三种状态下都能导电D .图b 说明通电后发生了:NaCl Na Cl +-=+ 4.(0分)[ID :139895]下列说法中正确的是A .Cl 2、Br 2、I 2的沸点逐渐升高,是因为共价键键能越来越大B .N 2、CCl 4、P 4三种分子中,每个原子的最外层都具有8电子稳定结构C .HF 的稳定性很强,是因为其分子间能形成氢键D .石英晶体和干冰晶体熔沸点不同,是因为所含化学键类型不同 5.(0分)[ID :139890]下列有关比较,正确的是A .在水中的溶解度:2533C H OH>CH OCHB .沸点:44CH >SiHC .熔点:晶体硅>金刚石D .键角:32NH <H O6.(0分)[ID :139886]如图为冰晶体的结构模型,大球代表O ,小球代表H 。
下列有关说法正确的是A .冰晶体中每个水分子与另外4个紧邻的水分子形成四面体B .冰晶体具有三维骨架结构,是共价晶体C .水分子间通过H —O 形成冰晶体D .冰融化后,水分子之间空隙增大7.(0分)[ID :139884]下列关于晶体的说法一定正确的是A .分子晶体中都存在共价键B .图为3CaTiO 晶体中晶胞的结构模型,其中每个4Ti +和12个2O -紧邻C .2SiO 晶体中每个硅原子与2个氧原子以共价键相结合D .金属晶体的熔点都比分子晶体的熔点高8.(0分)[ID :139880]氮氧化铝(AlON )属于原子晶体,是一种超强透明材料,其制备反应为232高温Al O +C+N 2AlON+CO 。

一、选择题1.(0分)[ID:139821]下列叙述中,不正确的是()A.微粒半径由小到大顺序是H+<Li+<H-B.杂化轨道只用于形成σ键或用于容纳未参与成键的孤对电子C.[Cu(NH3)4]2+中H提供接受孤对电子的空轨道D.分子中中心原子通过sp3杂化轨道成键时,该分子不一定为四面体结构2.(0分)[ID:139815]有关晶体的结构如图所示,下列说法中不正确的是()A.在NaCl 晶体中,距Na 最近的Cl 形成正八面体CaF晶体中,每个晶胞平均占有4 个Ca2+B.在2C.在金刚石晶体中,碳原子与碳碳键个数的比为1:2D.该气态团簇分子的分子式为EF或FE3.(0分)[ID:139810]下列物质中,既含有离子键,又含有非极性共价键的是()A.H2O B.CaCl2C.NH4Cl D.Na2O24.(0分)[ID:139806]下列有关性质的比较中,正确的是A.键的极性:N-H<O-H<F-HB.第一电离能:Na<Mg<AlC.硬度:白磷>冰>二氧化硅D.熔点:>5.(0分)[ID:139882]碳元素有多种同素异形体,其中C60、石墨与金刚石的结构如图所示。
已知C60的结构是由正五边形和正六边形组成的凸32面体。
下列有关说法正确的是A.C60中含有20个正五边形和12个正六边形B.石墨的层内碳原子之间只存在σ 键C.石墨中层间碳原子之间存在化学键D.如图所示的金刚石晶胞中有8个碳原子6.(0分)[ID:139880]氮氧化铝(AlON)属于原子晶体,是一种超强透明材料,其制备反应为232高温Al O +C+N 2AlON+CO 。
下列描述错误的是A .AlON 和金刚石均含共价键B .AlON 和金刚石晶体类型相同C .AlON 和23Al O 的化学键类型不同D .AlON 和23Al O 晶体类型相同7.(0分)[ID :139877]下列晶体属于离子晶体且阴、阳离子的立体构型相同的是 A .43NH NOB .34Si NC .44NH ClOD .34H PO8.(0分)[ID :139872]关于晶体的叙述中,正确的是 A .分子晶体中,共价键的键能越大,熔、沸点越高 B .分子晶体中,分子间作用力越大,该分子越稳定 C .共价晶体中,共价键的键能越大,熔、沸点越高D .某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体 9.(0分)[ID :139842]下列物质形成的晶体中,属于分子晶体的是 A .CO 2B .NaOHC .金刚石D .NaCl10.(0分)[ID :139835]邻二氮菲(phen)与Fe 2+生成稳定的橙红色邻二氮菲亚铁离子()23Fe phen +⎡⎤⎣⎦,可用于2Fe +浓度的测定,邻二氮菲的结构简式如图所示。
六方氮化硼(白石墨)为松散、润滑、易吸潮的白色粉末,真密度2.27/cm3,莫氏硬度为2,机械强度低,但比石墨高(见表1)。
无明显熔点,在0。
1Mpa氮气中于3000℃升华。
在氮或氩气中的最高使用温度℃,在氧气气氛中的稳定性较差,使用温度1000℃以下。
六方氮化硼膨胀系数低,导热率高,所以抗热震性优良,在1200~20℃循环百次也不破坏。
表2为BN和几种膨胀系数陶瓷性能的比较。
从表中看出,BN的膨胀系数相当于石英,但导热率却为石英的10倍。
六方氮化硼属六方晶系,具有类似石墨的层次结构,故有白石墨之称。
其晶体结构和石墨结构的对比示如表3 ,每一层有B、N 原子相间排列成六角环状网络。
层内原子之间呈很强的共价结合,所以结构紧密。
层间为分子健结合,结合弱,故容易削弱。
层内B -N 原子间距为0。
142nm, 弹性模量E 为910Gpa ,而层间原子间距为0。
335nm 弹性模量只有30 Gpa BN 与石墨不仅结构一致,而且晶格常数十分相似。
表1 BN陶瓷的机械强度及其与石墨和Al2O3的对比。
表 3 BN 和石墨的晶体结构六方氮化硼是热的良导体,又是典型的电绝缘体。
常温电阻率可达1016~1018 即使在1000℃,电阻率仍有104~106Ω。
cm . BN 的介电常数3~5 ,介质损耗为( 2~8 ) *10—4 ,击穿强度为Al2O3的两倍,达30~40 Kv/mm。
六方氮化硼具有良好的润滑性,抗氧化性,抗腐蚀性,绝缘性,导热性和化学稳定性。
可以用于制造TiB2/BN复合陶瓷,还可以用于高级耐火材料和超硬材料,水平连轧钢的分离环,用于耐高温润滑剂和高温涂料同时还是合成立方氮化硼的原料.六方氮化硼有优良的化学稳定性。
对大多数金属熔体,如钢、不锈钢、Al、Fe、Ge、Bi、Si、Cu、Sb、Sn、In、Cd、Ni、Zn等既不润湿又不发生作用。
因此,可用作高温电偶保护套,熔化金属的坩埚、器皿、输送液体金属的管道、泵零件、铸钢的磨具以及高温电绝缘材料等。

全国课标卷高考题(2011-2018)+参考答案(高清 校对)2018课标I 2018课标Ⅱ 2018课标Ⅲ 2017课标I 2017课标Ⅱ 2017课标Ⅲ 2016课标I 2016课标Ⅱ 2016课标Ⅲ 2015课标I 2015课标Ⅱ 2014课标I 2014课标Ⅱ 2014大纲 2013课标I 2013课标Ⅱ 2013大纲 2012课标 2012大纲 2011课标 2011大纲1.(2011课标)氮化硼(BN )是一种重要的功能陶瓷材料,以天然硼砂为起始物,经过一系列反应可以得到BF 3和BN ,如下图所示:请回答下列问题:(1)由B 2O 3制备BF 3、BN 的化学方程式依次是_________、__________;(2)基态B 原子的电子排布式为_________;B 和N 相比,电负性较大的是_________,BN 中B 元素的化合价为_________;(3)在BF 3分子中,F-B-F 的键角是_______,B 原子的杂化轨道类型为_______,BF3和过量NaF 作用可生成NaBF 4,BF 4-的立体结构为_______;(4)在与石墨结构相似的六方氮化硼晶体中,层内B 原子与N 原子之间的化学键为________,层间作用力为________;(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm ,立方氮化硼晶胞中含有______个氮原子、________个硼原子,立方氮化硼的密度是_______g·cm -3(只要求列算式,不必计算出数值。
阿伏伽德罗常数为N A )。
2.(2012课标) VIA 族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA 族元素的化合物在研究和生产中有许多重要用途。
请回答下列问题:(1)S 单质的常见形式为S 8,其环状结构如下图所示,S 原子采用的轨道杂化方式是______;(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O 、S 、Se 原子的第一电离能由大到小的顺序为______;(3)Se 原子序数为______,其核外M 层电子的排布式为______;(4)H 2Se 的酸性比H 2S__________(填“强”或“弱”)。

2020届高考化学二轮题型对题必练-----无机化工流程题1.工业上用铝土矿主要成分为,还有少量的,等杂质提取氧化铝作冶炼铝的原料,提取的操作过程如下:和II步骤中分离溶液和沉淀的操作是:;沉淀M中除含有泥沙外,一定还含有,固体N是;滤液X中,含铝元素的溶质的化学式为,它属于填“酸”、“碱”或“盐”类物质;实验室里常往溶液中加人填“氨水”或“NaOH溶液”来制取,请写出该反应的离子方程式步骤中发生的化学反应有和用化学方程式表示2.氮化硼是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到和BN,如下图所示:请回答下列问题:由制备、BN的化学方程式依次是______、______;基态B原子的电子排布式为______;B和N相比,电负性较大的是______,BN 中B元素的化合价为______;在分子中,的建角是______,B原子的杂化轨道类型为______,和过量NaF作用可生成,的立体结构为______;在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为______,层间作用力为______;六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为,立方氮化硼晶胞中含有______个氮原子、______个硼原子,立方氮化硼的密度是______只要求列算式,不必计算出数值,阿伏伽德罗常数为3.随着工业的迅速发展,废水的种类和数量迅猛增加,对水体的污染也日趋广泛和严重,威胁人类的健康和安全.因此工业废水的处理是当代一个重要的课题.臭氧是一种强氧化剂,在处理含氰废水过程中由于无二次污染,而备受关注.该过程由两步反应组成:总反应的化学方程式为______ ,该反应______ .工业含磷废水中含大量的,可通过投放镁盐进行除磷.投放的镁盐让磷酸根形成沉淀而除磷.如图1显示,沉淀过程的 pH 对废水中磷的去除率影响很大.从如图可知,最佳除磷的pH范围是______ 当pH 较高时,磷去除率下降的原因是______ .若处理后的废水中时,试计算溶液中的写出计算过程,已知若废水中还含有大量的,投放镁盐,可得到磷酸氨镁晶体,可用作化肥.写出该反应的离子方程式______ .实验表明,其他条件相同时学科王,温度越高,残余磷浓度越高.已知 时,~反应时间t的变化曲线如图若保持其他条件不变,请在坐标图中,画出 时~反应时间t的变化曲线示意图.4.由含碘废水制取碘酸钾的一种工艺如图:写出在日常生活中的一个重要应用______。
六方氮化硼的电子结构与润滑性能的关系的探讨
六方氮化硼(hexagonal boron nitride,简称"h-BN")是一种二维的氮化物,
其化学结构与石墨烯非常相似,可用于润滑。
近年来,h-BN已经成为摩擦学研究
的一个重要课题,特别是在微纳米尺度的研究领域,因为其具备了体积小、刚度大、易去除、抗热伤害等优势,可作为一种出色的润滑剂。
h-BN电子结构中具有明确的三维晶格和晶胞结构,它由氮原子层组成,结构
中的每个硼原子周围都有三个氮原子,这种共价键的特殊性,使h-BN产生出独特
的结构性质,也使其被广泛应用到各个行业中。
h-BN具有优异的润滑性,它分子表面的低滑性可以减少摩擦阻力,而其高抗
拉强度、高弹性模量和抗热伤害能力,使其能在较长时间内保持强有力的润滑效果。
此外,h-BN分子表面对水分子非常疏水,可避免界面被水份污染而形成润滑膜损坏。
另一方面,它还具有一定的绝缘能力,可减少电路相互之间的干扰。
综上所述,h-BN在电子结构、绝缘能力和润滑性等方面具有诸多的优势,它
可以用于润滑和摩擦学行业,为大家带来应用价值。
六方氮化硼晶面结构
六方氮化硼(h-BN)是由氮原子和硼原子组成的六角网状层面结构晶体,是氮化硼所有物相中唯一存在于自然界的物相结构。
其外观为质地柔软、松散、有光滑感、易吸潮的白色粉末,具有类似于石墨烯的层状结构特征,因此又被称为“白石墨”。
从分子结构图来看,六方氮化硼属于六方晶系,具有和石墨烯相同的六方晶体结构,是由多层结构堆叠起来的,不同层之间B-N-B通过范德华作用力链接起来。
其晶格常数a=±,c=±,密度
ρ=/cm³。
以上内容仅供参考,建议查阅专业化学书籍获取更准确的信息。
氮化硼英文名:Boron Nitride 分子式:BN 分子量:24.83 质量标准:企业标准(QJ/YH02?08-89)氮化硼是由氮原子和硼原子构成的晶体,该晶体结构分为:六方氮化硼(HBN)、密排六方氮化硼(WBN),其中六方氮化硼的晶体结构具有类似的石墨层状结构,呈现松散、润滑、易吸潮、质轻等性状的白色粉末,所以又称“白色石墨”。
理论密度2.27g/cm3,莫氏硬度为2。
六方氮化硼是具有良好的电绝缘性,导热性,化学稳定性;无明显熔点,在0.1MPA氮气中3000℃升华,在惰性气体中熔点3000℃,在中性还原气氛中,耐热到2000℃,在氮气和氩中使用温度可达2200℃,在氧气气氛中稳定性较差,可使用至900℃。
六方氮化硼的膨胀系数相当于石英,但导热率却为石英的十倍。
氮化硼的技术指标: 1、规格99 ,BN≥99%B2O3≤0.5%粒度D50(um)≤2.0 2、规格98 ,B N≥98% B2O3≤0.5%粒度D50(um)≤2.0 氮化硼的各项性能参数:(1)高耐热性:3000℃升华,其强度1800℃为室温的2倍,1500℃空冷至室温数十次不破裂,在惰性气体中2800℃不软化。
(2)高导热系数:热压制品为33W/M.K 和纯铁一样,在530℃以上是陶瓷材料中导热最大的材料。
(3)低热膨胀系数:2×10-6的膨胀系数仅次于石英玻璃,是陶瓷中最小的,加上其具有高导热,所以抗热震性能很好。
(4)优良的电性能:高温绝缘性好,25℃为1014Ω—CM,2000℃还可达到103Ω—CM,是陶瓷中最好的高温绝缘材料,击穿电压3KV/MM,低介电损耗108HZ时为2.5×10-4,介电常数为4,可透微波和红外线。
(5)良好的耐腐蚀性:与一般金属(铁、铜、铝、铅等)、稀土金属,贵重金属,半导体材料(锗、硅、砷化钾),玻璃,熔盐(水晶石、氟化物、炉渣)、无机酸、碱不反应。
(6)低的摩擦系数:u为0.16,高温下不增大,比二硫化钼,石墨耐温高,氧化气氛可用到900℃,真空下可用到2000℃。
六方氮化硼和石墨的晶体结构比较相近,为类似石墨的层状结构。
机械性能上,氮化硼是一种软性材料,氮化硼是一种软性材料,它的莫氏硬度为2。
但热压制品的硬度受到B2O3含量的影响,二者成正比关系。
氮化硼截面之洞摩擦系数很低,仅为0.03~0.07,但如果反复摩擦,则由于其软弱的表面的磨损,使其值增至0.11~0.23/BN粉末的摩擦系数在室温到150℃之间增加到0.4,其值一直波动到500℃,然后在600℃降低到0.1,这是由于杂质B2O3熔化所致,到900℃,由于发生比较强烈的氧化,其值又迅速升高。
氮化硼的机械强度比心里高,但比氧化铝低得多,不过它在高温下没有象石墨那样的负载软化现象,出此,可以在高温下发挥其特性。
由于BN晶体呈层状结构,由片状晶体热压成型的致密BN瓷体有一定程度的定向排列,这种微观组织结构使BN制品的某些性能具有较明显的各向异性特性。
热压BN的机械性能在平行于受压方向的强度比垂直于受压方向的强度为大。
氮化硼的机械弛度在很大程度上还受到材料中杂质含量的影响,最典型的是B2O3,它作为纳合剂对团体BN的结合起着重要的作用,一旦温度提高特别在越过B2O3的熔点时,使BN的相互结合力减弱,其材体的强度就急剧下降。
例如,含B2O3的BN,室温弯曲强度可达1000公斤/厘米2,到1000℃时只有140公斤/厘米2;弹数模量从25 时的84×104公斤/厘米2下降到1000℃的的7×104公斤/厘米2。
通过对BN在高温真空或向温惰性气氛中处理后的强度测定,就更能说明这个问题。
表1—3列出了BN在1400℃真空中处理后的失重和强度。
BN试样是是含有14%B2O3的“900℃BN”热压而成。
从表中看出,试样经过不问时间处理后,试样中的B2O3有不同程度的损失,试样的强度开始有增加继而就下降。
表1—4说明BN在N2或Ar气氛中高温处理后,由于B2O3从热压BN中挥发除去而使强度受到影响。
试样先在1800 ℃CN2或Ar中处理到恒重,然后测定其断裂模量,结果显示出由于B203的损失而有约70%的强度损失。
可见B2O3对热压BN的结合强度起着重要作用。
热压氮化硼的机械强度
机械强度kg/cm^2 氮化硼石墨氧化铝
平行于热压方向垂直于热压方向
抗压强度3150 2380 350~800 12000~29000
抗弯强度600~800 400~500 150~250 3500
抗拉强度1100 500 —— 2100
弹性模量84*10^4 35*10^4 —— 370*10^4
热压氮化砌还有—个难得可贵的性能是可机械加工件,它可以象石墨一样容易地干法车、铣、刨、钴、切、磨并且由于BN比石墨更加致密,故加工精度更高,可以达到0.01毫米。
由于这一可加工特性,所以在选择用陶瓷材料制作复杂形状的零部件时,尽管BN原料价格比A12O3等高数倍,但人们还是宁愿选用它。
三、热性能
氮化硼的耐温性很好,它实际上无明显的熔点,只有在高于3个大气压的氮压力下才于3000℃以上熔化,在1大气压的氮气中,于3000℃升华。
则在2045℃时的分解压已达158毫米汞杜,而在1390℃时其稳定性仍很好,分解压仅10-4毫米汞柱,至2727℃,其分解压几乎达760毫米汞柱。
BN在高温下无软化现
象。
热压BN具有很高的使用温度,在氮气或怕性气氛小酌最高使用温度可到2800℃,在氨气氛中甚至加热到3000℃而仍不分解。
不过它在氧化气氛中的稳定性较差,使用温度只能限于900℃以下。
在连续和强烈地加热情况下,BN会燃炼火焰呈绿白色,同时发出B2O3烟。
在4×10-3毫米汞柱的真空个,热压则于1800℃就开始迅速分解,分解为元素B和N。
氮化硼与其他陶瓷材料相比,具有较低的膨胀系数,大多数实验数值在2~2.75╳10-5/度的范围。
表1—6为热压BN的热膨胀系数。
氮化硼与其他陶瓷材料的热性能比较
氮化硼氧化铍氧化铝滑石瓷氧化锆氟树脂石英玻璃
最高使用温度空气900
氩气2800 2000 1750 1100 2000 250 1300
导热系数0.06 0.61 0.06 0.006 0.005 —— 0.004~0.01
卡.厘米.秒.度
膨胀系数
*10^-6/℃2~7.5 7.8 8.6 8.7 10.0 —— 0.5
热压氮化硼具有与不锈钢相似的导热系数,在陶瓷材料中,BN的导热性能仅次于BeO。
但值得指出,BN的导热系数随温度的上升而下降的趋势不大,如表1—7所示。
在600以上,BN的导热系数高于BeO的,在1000℃时,垂直c轴向的导热系数高于所有已知的电绝缘体的热导率而名列陶瓷材料之前茅,其值为
0.064卡/厘米•秒•度。
如果加有某些特殊添加物时,其热导率可进一步提南到
1.0卡/厘米•秒•度以上。
有趣的是,由BCl3与NH3在高温反应合成的BN粉却是一种优良的热绝缘体,因为其体积密度相当低,仅0.1克/厘米3。
由于氮化硼具有较低的热膨胀、较高的导热系数,所以相应地BN的热稳定性相当优良,材料反复经受强烈热震也不破坏。
不破坏。
例如,热压BN试柠任1000温度场个保持20分钟后,立即移入空气中冷却或用风扇冷却至室温,再送回1000℃的温度场中,如此反复冷热循环数百次也不见材料开裂破坏。
但经过这样反复热震后的材料,其强度受到一定的损失,其损失程度取决于BN的纯度及试样的大小而不等,最高可达30%。
受潮的试样直接投入600℃以上的炉内会发生碎裂,这种现象可解释为由于吸潮而在体内形成的水化物(H3BO3之类)在受热后急速分解时形成的水蒸汽的压力所造成;除此之外,由于热压BN在团体结构上存在着细微孔隙和表面微裂纹等缺陷,因此与液体介质接触后,吸附介质的劈裂作用也是引起碎裂的一个重要因素。
常见的工程材料,导热与导电性能一般总是—致的。
例如,金属是优良的导电体,也是优良的导热体;非金属是电的绝缘体,又是热的绝缘体。
而氮化硼却是一种别具一格的材料。
它既是热的优良导体,又是电的优良绝缘体。
热压BN的常温体积电阻值大于1011欧姆—匣米,但随着相对湿度而有变化。
高纯度且干燥的BN,其最大体积电阻值可达1016~1018欧姆—厘米,即使在1000℃高温下,其值仍有10~104欧姆—厘米。
纯的BN和含有B2O3的BN制品,两者的电阻值有很大的差异,后者由于存在B2O3,起电阻值比前者为低,当在950℃~1350℃之间B2O3破除去时,其电阻值就增加。
氮化硼的介电常数在陶瓷材抖中也可算是小的,其值3~5。
介质损耗低,但潮湿度对其有较大的影响。
氮化硼具有很高的电击穿强度,约为Al2O3材料的四倍,其值为30~千伏/毫米。
氮化硼超导状态的转化温度为-271℃,半导体限制区宽度为E0=4.6ev。
与其它材料比较,氮化硼具有优良的电性能,所以作为高频绝缘、高压绝缘和高温绝缘的材料是很理想的。
表1—10表示BN与某些材料的电性能比较。
氮化硼和某些材料的电性能
材料使用温度℃击穿强度kv/mm介电常数介质损耗tgδ*10^-4体积电阻Ω-cm 氮化硼2800 30~40 3~5 2~8 10^16~10^5(20-1000℃)
氧化铝1750 7~15 8~9 4 10^10~10^6(20-1000℃)
滑石瓷1100 10~14 5.5~7.5 6 10^16
镁橄榄石瓷1100 14 6 1 10^17
酚醛树脂100 10~15 5~8 —— 10^12~10^15
氟树脂250 35 2 2 10^15
石英玻璃1300 16 3.5~4.0 3 10^15~10^4(20-1000℃)
参考资料:/question/34898817.html?si=1。