鲁科GH 化反应原理Z3J2弱电解质的电离 盐类的水解 知识框架 典型习题及习题答案与解析
- 格式:doc
- 大小:2.00 MB
- 文档页数:5

《弱电解质的电离盐类的水解》导学案第二课时〘学习目标〙〖知识与技能〗1、认识盐类水解的原理2、认识盐类水解的规律,学会判断盐溶液的酸碱性3、学会正确书写盐类水解的离子方程式。
4、认识水解平衡的移动〖过程与方法〗体会“溶液的酸碱性------溶液中H+和OH-浓度的关系------溶质微粒与溶剂微粒之间的相互作用”这种分析问题的思路,把握住问题的本质,把握研究溶液体系溶质与溶剂间相互作用的思想方法。
〖情感态度与价值观〗学习运用相互联系、相互影响的观点认识客观世界,树立正确的世界观和价值观。
〘学习重点、难点〙盐类水解的原理影响水解的因素〘课前预习〙1、写出下列物质的电离方程式:(1)H2O(2)CH3COOH(3)H2CO3(4)NH3·H2O(5)HCN2、根据不同的分类依据可以对物质进行不同的分类。
若根据生成盐的酸和碱强弱可以把盐分成哪几类?请完成下表。
3、测定溶液酸碱性的方法有哪些?具体怎样操作?4、根据所学的知识填写下表5、酸溶液显酸性,碱溶液显碱性,盐溶液一定显中性吗?你能联系生活实际举些例子吗?〘学案导学〙二、盐类的水解1、盐类水解的原理〘探究活动一〙盐溶液都显中性吗?以学习小组为单位,利用你们的实验器材测定浓度均为0.1mol/L的醋酸钠溶液、碳酸钠溶液、氯化钠溶液、氯化铵溶液、硫酸铝溶液和硝酸钾溶液的酸碱性,并做好实验记录。
〘探究活动二〙醋酸钠溶液为何显碱性?第一阶段:在醋酸钠溶液中存在电离平衡体系吗?溶液中存在的其它离子会对该平衡体系产生影响吗??第二阶段:氢离子和醋酸根离子的反应对水的电离平衡产生了何种影响?(氢离子和氢氧根离子的浓度还相等吗?)〘探究活动三〙:氯化铵溶液为何显酸性?〖过程展示〗〘探究活动四〙NaCl溶液与KNO3溶液为何呈中性?从盐的类别来分析,哪几类盐溶液会呈现酸性或碱性?〘归纳总结〙(1)概括什么样的反应过程是水解反应?(2)书写水解离子方程式要注意什么?(3)结合课本内容总结盐类水解的规律。

鲁科版(2019)高二选择性必修第一册第3章物质在水溶液中的行为第2节弱电解质的电离盐类的水解课时3水解平衡的移动和水解原理的利用学校:___________姓名:___________班级:___________考号:___________一、单选题1.下列措施能使AlCl 3溶液的水解平衡正向移动且使溶液的pH 增大的是 A .加热 B .通CO 2气体 C .加水 D .通HCl 气体 2.一定条件下,3CH COONa 溶液中存在水解平衡323CH COO H O CH COOH OH --++。
下列说法正确的是( )A .加入少量NaOH 固体,()-3c CH COO 减小B .升高温度溶液的pH 增大C .稀释溶液,溶液的pH 增大D .通入少量HCl 气体,水解平衡常数减小3.在一定条件下,23Na CO 溶液中存在水解平衡:2323CO H O HCO OH ---++。
下列说法正确的是( )A .稀释溶液,各物质浓度均减小,平衡不移动B .通入2CO ,平衡向正反应方向移动C .升高温度,()()-32-3c HCO c CO 减小D .加入NaOH 固体,溶液pH 减小4.下列相同物质的量浓度的铵盐溶液中,4NH +浓度最大的是( )A .43NH HCOB .44NH HSOC .43NH NOD .34CH COONH 5.下列应用与碳酸钠或碳酸氢钠能发生水解的事实无关的是( )A .实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞B .泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将其混合就可产生大量二氧化碳的泡沫C .厨房中常用碳酸钠溶液洗涤餐具上的油污D .可用碳酸钠与醋酸制取少量二氧化碳6.同时对农作物施用含N 、P 、K 的三种化肥,给定下列化肥:①K 2CO 3、②KCl、③Ca (H 2PO 4)2、④(NH 4)2SO 4、⑤NH 3·H 2O 。


高中化学第3章物质在水溶液中的行为3.2 弱电解质的电离、盐类的水解(第3课时)影响盐类水解的因素和盐类水解的应用课时练鲁科版选修4编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(高中化学第3章物质在水溶液中的行为3.2 弱电解质的电离、盐类的水解(第3课时)影响盐类水解的因素和盐类水解的应用课时练鲁科版选修4)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为高中化学第3章物质在水溶液中的行为3.2 弱电解质的电离、盐类的水解(第3课时)影响盐类水解的因素和盐类水解的应用课时练鲁科版选修4的全部内容。
影响盐类水解的因素和盐类水解的应用1.下列做法中用到物质氧化性的是( )A.明矾净化水B.纯碱除去油污C.臭氧消毒餐具D.食醋清洗水垢【答案】C【解析】O3消毒是利用其强氧化性。
A项中是利用Al3+水解生成Al(OH)3胶体的吸附性;B项中是利用Na2CO3水解显碱性使油污水解,以上水解都不是氧化还原反应;D项是利用CH3COOH 的酸性。
2.下列说法正确的是( )A.将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同B.配制一定浓度的FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度C.用加热的方法可以除去KCl溶液中的Fe3+D.洗涤油污常用热的碳酸钠溶液【答案】D【解析】A项,氯化铝溶液蒸干、灼烧后得到氧化铝,而硫酸铝溶液蒸干、灼烧后得到的仍是硫酸铝;B项,所加酸应是稀硫酸,不能引入新杂质;C项,加热法不能除去Fe3+。
3.在蒸发皿中加热、蒸干并灼烧(低于400 ℃)下列物质的溶液,可以得到原物质的是( )A.氯化铝B.碳酸氢钠C.硫酸铁D.高锰酸钾【答案】C【解析】AlCl 3发生水解反应:AlCl3+3H2O Al(OH)3+3HCl,生成的HCl挥发而使水解平衡向右移动,致使生成Al(OH)3沉淀,灼烧得Al2O3;NaHCO3、KMnO4受热后分别分解得到Na2CO3、K2MnO4和MnO2,只有Fe2(SO4)3蒸干后得到原物质。

高中化学学习材料唐玲出品第二节弱电解质的电离盐类的水解[同步试题]1、向醋酸溶液中滴加NaOH溶液,则()A 醋酸的电离平衡向左移动B 溶液的pH减小C 醋酸根离子的物质的量减小D 醋酸的浓度减小2、下列事实可证明氨水是弱碱的是()A 氨水能跟氯化铁溶液反应生成氢氧化铁B 铵盐受热易分解C 0.1mol•L-1氨水可以使酚酞试液变红D 0.1mol•L-1氯化铵溶液的pH约为53、下列叙述正确的是()A 强电解质水溶液的导电性不一定比弱电解质强B 氯气的水溶液能导电,所以氯气属于电解质C 硫酸铜晶体含有一定量的结晶水,所以硫酸铜晶体能导电D 在一定条件下,电解质的电离都能达到电离平衡4、下列物质中,导电性最差的是()A 熔融氢氧化钠B 石墨棒C 盐酸溶液D 固态氯化钾5、在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是()A 将pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所加的水量少B 盐酸和醋酸都可用相应的钠盐与浓硫酸反应制取C 相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH变化大D 相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等6.在pH为3的FeCl3溶液,pH为11的Na2CO3溶液和pH为3的盐酸中由水电离出来的H+的浓度分别为:C1、C2、C3它们之间的关系是A.C1<C2<C3B.C1=C2>C3C.C1>C2>C3D.无法判断7. 在一定条件下发生下列反应,其中属于盐类水解反应的是A.NH4++2H2O NH3·H2O+H3O+B.HCO3-+ H2O H3O+ + CO32-C.HS-+H+=== H2SD.Cl2+H2O H++Cl-+HClO8. 物质的量浓度相同的下列溶液中,NH4+浓度最大的是A. NH4ClB. NH4HSO4C. CH3COONH4D. NH4HCO39. 蒸干FeCl3水溶液后再强热,得到的固体物质主要是A.FeCl3B.FeCl3·6H2OC.Fe(OH)3 D. Fe2O310. 一元酸HA溶液中,加入一定量强碱MOH溶液后,恰好完全反应,反应后的溶液中,下列判断正确的是()A.c(A-) ≥ c(NH4+) B. c(A-) ≤ c(M+)C. 若MA不水解,则c( OH―)<c(A-)D.若MA水解,则c( OH―)>c(A-)11. 当Mg(OH)2在水中达到溶解平衡时:Mg(OH)2Mg2++2OH-要使Mg(OH)2进一步溶解,应向溶液中加少量的固体是A. NH4ClB. NaOHC. Na2CO3D.干冰12. 某氨水中c(NH4+)=0.5 mol / L时达到电离平衡,若向其中加入c(NH4+)=0.5 mol / L的NH4Cl溶液后,NH3·H2O的电离程度将A.增大B. 减少C.不变 D.无法判断13.已知K2HPO4溶液中,HPO42―的水解程度大于电离程度,对于平衡:HPO42― + H2O H3O++ PO43-,欲使溶液中c(HPO42-)、c(H3O+)、c(PO43-)三种离子溶度均减小,可采用的方法是()A.加水B.加热C.加消石灰D.加硝酸银13. 将氨水逐滴加入到稀盐酸中,使溶液为中性,则此时A [NH4+]=[Cl-]B [NH4+]>[Cl-]C [NH4+]<[Cl-]D [NH4+]与[Cl-]之间关系不确定14. 物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其pH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是A. HX、HZ、HYB. HZ、HY、HXC. HX、HY、HZD.HY、HZ、HX15. 浓度均为0.1 mol / L的①NaHCO3、②Na2CO3、③NaCl、④NaHSO4四种溶液,按pH值由小到大排列的顺序是A. ①②③④B.④③①②C.③④①② D.②①④③16. 用一价离子组成四种盐,AC、BD、AD、BC的1mol·L-1溶液,在室温下前两种溶液的pH=7,第三种溶液的pH >7,最后一种溶液的pH< 7,则()A B C D碱性AOH>BOH AOH<BOH AOH>BOH AOH<BOH酸性HC>HD HC>HD HC<HD HC<HD17. 下列各组物质能一起混合施用的是A. 铵态氮肥和草木灰(含K2CO3)混合施用B. 化肥和农家肥(如绿肥)混合施用C. 重钙施入碱性土壤中D. 复合肥(如磷酸氢二铵)和生石灰一起施用18、在一定温度下,有a盐酸,b硫酸,c醋酸,三种酸:(1)当三种酸物质的量浓度相等时,c(H+)由大到小的顺序是(2)若三者c(H+)相同,物质的量浓度由大到小的顺序是(3)将c(H+)相同的三种酸均加水稀释至原来的100倍,c(H+)由大到小的顺序是19、在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如右图所示。
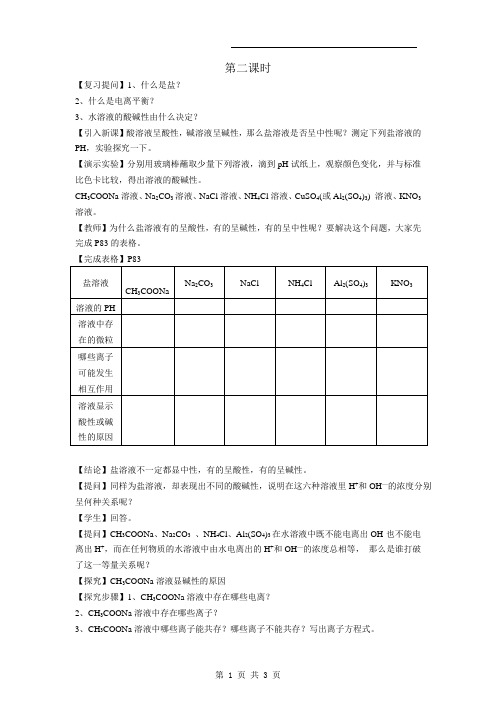
第二课时【复习提问】1、什么是盐?2、什么是电离平衡?3、水溶液的酸碱性由什么决定?【引入新课】酸溶液呈酸性,碱溶液呈碱性,那么盐溶液是否呈中性呢?测定下列盐溶液的PH,实验探究一下。
【演示实验】分别用玻璃棒蘸取少量下列溶液,滴到pH试纸上,观察颜色变化,并与标准比色卡比较,得出溶液的酸碱性。
CH3COONa溶液、Na2CO3溶液、NaCl溶液、NH4Cl溶液、CuSO4(或Al2(SO4)3) 溶液、KNO3溶液。
【教师】为什么盐溶液有的呈酸性,有的呈碱性,有的呈中性呢?要解决这个问题,大家先完成P83的表格。
【结论】盐溶液不一定都显中性,有的呈酸性,有的呈碱性。
【提问】同样为盐溶液,却表现出不同的酸碱性,说明在这六种溶液里H+和OH—的浓度分别呈何种关系呢?【学生】回答。
【提问】CH3COONa、Na2CO3、NH4Cl、Al2(SO4)3在水溶液中既不能电离出OH -也不能电离出H+,而在任何物质的水溶液中由水电离出的H+和OH—的浓度总相等,那么是谁打破了这一等量关系呢?【探究】CH3COONa溶液显碱性的原因【探究步骤】1、CH3COONa溶液中存在哪些电离?2、CH3COONa溶液中存在哪些离子?3、CH3COONa溶液中哪些离子能共存?哪些离子不能共存?写出离子方程式。
4、CH3COONa在水溶液中反应的本质和结果是什么?【学生】回答。
【板书】CH 3COO- + H2O CH3COOH + OH-【迁移•运用】NH4Cl溶液为什么显酸性?Al2(SO4)3溶液为什么显酸性?【板书】NH 4+ + H2O NH3•H2O + OH—【说明】水解反应的特点——将水解离开来,再与弱离子结合。
【练习】写出下列物质的水解反应。
(1)FeCl3(2)NaF(3)CuSO4(4)K2CO3(5)Al2(SO4)3【板书】二、盐类的水解1、定义:在溶液中盐电离产生的离子与水电离产生的H+或OH—结合生成弱电解质的反应,叫做盐类的水解。
典型例题一【题1】下列关于电解质的电离平衡状态的叙述中,正确的是(D)A.弱电解质的电离达到平衡状态后,电离就停止了B.弱电解质的电离达到平衡状态后,分子的消耗速率和离子的生成速率相等C.弱电解质的电离达到平衡状态后,分子和离子的浓度相等D.弱电解质的电离达到平衡状态后,外界条件改变,电离平衡可能要发生移动【解析】电离平衡也是一种平衡,因而是一种动态平衡,所以A描述错误。
可以从直接因素来表达,二者已达平衡,一定要体现正反应方向和逆反应方向,或者说各组分的浓度,含量不随时间变化而变化的意思,所以B、C也错误了。
外因会影响平衡,所以D正确。
【题2】下列叙述正确的是(C)A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)增大【解析】A中氨水是弱碱,如果恰好反应生成硫酸铵,则铵根水解后溶液呈酸性,要使溶液显中性则需要氨水过量,则有c(SO42-)<c(NH4+)。
B中不同浓度的醋酸电离度不同,所以不存在简单的比例关系。
C中pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,恰好生成醋酸钠,溶液显碱性,滴入石蕊变红。
D中往氨水中加入少量硫酸铵固体会抑制氨水的电离,则溶液中c(OH-)/c(NH3•H2O)减小。
【题3】将0.1 mol/L醋酸溶液加水稀释,下列说法正确的是(D)A.溶液中[H+]和[OH-]都减小B.溶液中[H+]增大C.醋酸电离平衡向左移动D.溶液的pH增大【解析】CH3COOH H++CH3COO-,加水稀释有利于更多的醋酸分子电离,平衡向正反应方向移动,但氢离子浓度减小,必然会使氢氧根离子浓度增大,pH 增大,因为二者乘积是个定值,故A、B、C错误,D正确。
高中化学学习材料(灿若寒星**整理制作)高二化学专项练习(4)弱电解质的电离 盐类的水解一、填空题1.下列说法下列正确的是A 、强电解质的水溶液中不存在溶质分子,弱电解质的水溶液中存在溶质分子和离子B 、强电解质的水溶液导电性强于弱电解质的水溶液C 、强电解质都是离子化合物,弱电解质都是共价化合物D 、强电解质易溶于水,弱电解质难溶于水2. 已知HClO 是比H 2CO 3还弱的酸,氯水中存在下列平衡:Cl 2+H 2OHCl+HClO ,HClO H ++ClO — ,达平衡后,要使HClO 浓度增加,可加入 A 、H 2S B 、CaCO 3 C 、HCl D 、NaOH3.将浓度为0.1mol ·L -1HF 溶液加水不断稀释,下列各量始终保持增大的是 A. c (H +) B. )(HF K a C. )()(+-H c F c D. )()(HF c H c + 4.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )A. a 、b 、c 三点溶液的pH :c<b<aB. a 、b 、c 三点醋酸的电离程度:a<b<cC. 用湿润的pH 试纸测量a 处溶液的pH ,测量结果偏大D. a 、b 、c 三点溶液用1mol/LNaOH 溶液中和,消耗NaOH 溶液体积:c<a<b5.下列电离方程式中正确的是A 、NaHCO 3溶于水:NaHCO 3 = Na + + H + + CO 32—B 、NaHSO 4溶于水: Na HSO 4 = Na + + H + + -24SOC 、HF 溶于少量水中:HF=H + + F -D 、(NH 4)2SO 4溶于水: (NH 4)2SO 42NH 4+ + -24SO 6. 下列事实一定能说明HNO 2 是弱电解质的是①常温下NaNO 2 溶液的PH 大于7 ②用HNO 2溶液做导电实验灯泡很暗 导电能力 加水体积O a b c③HNO 2和NaCl 不能发生反应 ④0.1mol/LHNO 2溶液的PH=2.1A 、①③B 、②③C 、①④D 、②④7. 已知:(1)PH=2的次碘酸(HIO )溶液与PH=12的NaOH 溶液等体积混合,所得溶液呈酸性;(2)0.01mol/L的HIO 3或HMnO 4溶液与PH=12的 Ba(OH)2溶液等体积混合所得溶液均呈中性。
第2节弱电解质的电离盐类的水解第2课时盐类水解的实质与规律1.下列溶液中,因电离产生的离子发生水解而显酸性的是()A.NaHCO3B.NaHSO3C.CuSO4D.Ca(NO3)2答案 C解析A项,HCO-3+H2O H2CO3+OH-,HCO-3O2-3+H+,HCO-3的水解程度大于电离程度,溶液显碱性;B项,HSO-3的电离程度大于水解程度,溶液显酸性;C项,Cu2++2H2O Cu(OH)2+2H+,溶液显酸性;D项,Ca2+、NO-3不水解,溶液显中性。
考点盐类水解实质与规律题点盐溶液的碱性判断与比较2.pH=4的醋酸和氯化铵溶液中,水的电离程度前者与后者比较()A.大于B.小于C.等于D.无法比较答案 B解析醋酸电离出的H+抑制水的电离,使水的电离程度减小;NH4Cl电离出的NH+4结合水电离出的OH-生成弱电解质NH3·H2O,促进水的电离,使水的电离程度增大。
考点盐类水解实质与规律题点盐溶液酸碱性判断与比较3.物质的量浓度相同的下列溶液中,含粒子种数最多的是()A.CaCl2B.CH3COONaC.NH3D.K2CO3答案 D解析任何水溶液中都存在H2O??H++OH-。
A项,CaCl2不发生水解,溶液中存在的粒子有Ca2+、Cl-、H+、OH-、H2O共5种粒子;B项,由于CH3COONa发生水解:CH3COO -+H2O CH3COOH+OH-,溶液中存在Na+、CH3COOH、CH3COO-、H2O、H+、OH -共6种粒子;C项,在溶液中存在平衡:NH3+H2O NH3·H2O NH+4+OH-,溶液中存在NH+4、NH3·H2O、NH3、H2O、H+、OH-共6种粒子;D项,K2CO3在溶液中存在水解平衡:CO2-3+H2O HCO-3+OH-、HCO-3+H2O H2CO3+OH-,溶液中存在H2O、K +、CO2-3、HCO-3、OH-、H+、H2CO3共7种粒子。
鲁科高二化选修一、化学反应原理Z 3、物质在水溶液中的行为j2、弱电解质的电离盐类的水解知识框架鲁科高二化选修一、化学反应原理Z 3、物质在水溶液中的行为j2、弱电解质的电离盐类的水解典型习题1.(2012-上海高考)常温下a mol·L-1CH3COOH稀溶液和bmol·L-1KOH稀溶液等体积混合,下列判断一定错误的是()A. 若c(OH-)>c(H+) ,a=bB. 若c(K+)>c(CH3COO-) ,a>bC. 若c(OH-)=c(H+) ,a>bD. 若c(K+)<c(CH3COO-) ,a<b2.(2012-四川高考10.)常温下,下列溶液中的微粒浓度关系正确的是( )A.新制氯水中加入固体NaOH:c(Na+) = c(Cl-) + c(ClO-) + c(OH-)B.pH = 8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-) > c(H2CO3)C.pH = 11的氨水与pH = 3的盐酸等体积混合:c(Cl-) = c(NH4+) > c(OH-) = c(H+)D.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+) – 2c(OH-) = c(CH3COO-) – c(CH3COOH)3.(2012·江苏高考-化学·T15) 25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。
下列有关离子浓度关系叙述正确的是( )A.pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)B.W点表示溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)C.pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol·L-1D.向W点所表示溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)4.实验测得常温下0.1mol·L―1某一元酸(HA)溶液的pH不等于1,0.1mol·L―1某―元碱(BOH)溶液=10―12,将此两种溶液等体积混合后,所得溶液里各离子浓度由大到小排列顺序是( )A.c(A―)>c(B+)c(H+)>c(OH―)B.c(B+)>c(A―)>c(OH―)>c(H+)C.c(B+)=c(A―)>c(H+)=c(OH―)D.c(B+)>c(A―)>c(H+)>c(OH―)5.25℃时,在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L-1的CH3COOH溶液,溶液的pH与醋酸体积关系如图,下列分析正确的是()A.在A、B间任一点(不包括A、B),溶液中一定有:c(Na+)=c(CH3COO-)>c(OH-)>c(H+)B. 在B点: a>12. 5 ,且有c(Na+)= c(CH3COO-)= c(OH-)= c(H+)C. 在C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)D.在D点,c(CH3COO-)+c(CH3COOH)=2c(Na+)6.(2011-上海高考)常温下用pH为3的某酸溶液分别与pH都为11的氨水、氢氧化钠溶液等体积混合得到a、b两种溶液,关于这两种溶液酸碱性的描述正确的是( )A.b不可能显碱性B.a可能显酸性或碱性C.a不可能显酸性D.b可能显碱性或酸性7.(2011全国I卷)室温时,将浓度和体积分别为C1、V1的NaOH溶液和C2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是( )A.若PH>7,则一定是C1V1=C2V2B.在任何情况下都是C(Na+)+C(H+)=C(CH3COO-)+C(OH-)C.当PH=7时,若V1=V2,一定是C2>C1D.若V1=V2,C1=C2,则C(CH3COO-)+C(CH3COOH)=C(Na+)8.(1)常温下有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和NaNO3溶液中的一种.已知A、B溶液中水的电离程度相同,A、C溶液的pH相同。
则:①B是溶液; C是。
②常温下,若B溶液中c(OH-)与C溶液中的c(H+)相同,B溶液的pH用pHb表示,C溶液的pH用pHc表示,则pHb+pHc = (填某个数)。
(2)已知某溶液中存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)则:(I)上述关系一定不正确的是(填序号)。
(II)若溶液中只有一种溶质,则该溶液中离子浓度的大小顺序为_______(填序号)。
(III)若四种离子浓度关系有c(NH4+) = c(Cl- ),则该溶液显(填“酸性”、“碱性”或“中性”)。
9.(16分)(2012·北京高考)直接排放含SO2的烟气会形成酸雨,危害环境。
利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是。
(3)吸收液吸收SO2的过程中,pH随n(SO32-)∶n(HSO3-)变化关系如右表。
①由右表判断NaHSO3溶液显性,用化学平衡原理解释:。
②当吸收液呈中性时,溶液中离子浓度关系正确的是。
A.c(Na+)=2c(SO32-)+c(HSO3-)B.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)C.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)(4)当吸收液的pH降至约为6时,再送至电解槽再生。
再生示意图如右上图。
①HSO3-在阳极放电的电极反应式是。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。
简述再生原理:。
鲁科高二化选修一、化学反应原理Z 3、物质在水溶液中的行为j2、弱电解质的电离盐类的水解典型习题答案1.D2.D3. BC4.B5.D6.A B7.A8.(1) ①CH3COONa;盐酸②14(2)(I)②(II)①(III)中性9.(1)SO2+H2O H2SO3、2H2SO3+O22H2SO4(2)2OH-+SO 2SO32-+H2O(3)①酸NaHSO3溶液中存在HSO3-SO32-+H+和HSO3-+H2O H2SO3+OH-,HSO3-的电离程度强于水解程度②AB(4)①HSO3-+H2O-2e-SO42-+3H+②H+在阴极得电子生成H2,溶液中c(H+)降低,促使HSO3-电离生成SO32-,且Na+进入阴极室,吸收液得以再生。
j2、弱电解质的电离盐类的水解典型习题解析1.D [点拨]本题考查电解质溶液的知识,意在考查思维的缜密性。
若a=b ,恰好反应生成弱酸强碱盐CH3COOK溶液呈碱性,A项正确;若a>b,反应后溶液中溶质为CH3COOK和CH3COOH,该溶液可能呈中性,则C项正确;若该溶液中CH3COOH很少,CH3COOH的电离程度小于CH3COO-的水解程度,溶液呈碱性,即c(H+)<c(OH-) ,又因电荷守恒c(H+)+c(K+)=c(OH-)+c(CH3COO-) ,故c(K+)>c(CH3COO-) ,B项正确;若溶液中c(K+)<c(CH3COO-) ,利用电荷守恒c(H+)+c(K+)=c(OH-)+c(CH3COO-) 知溶液中一定存在c(H+)>c(OH-) ,溶液显酸性,而a<b,溶液一定呈碱性,二者矛盾,D项一定错误,故选D 。
2.(2012-四川高考10.)解析:要会运用溶液中的守恒解题。
在任何溶液中都存在电荷守恒,选项A的溶液中电荷守恒为:c(Na+)+c(H+)=c(ClO-)+c(Cl-)+c(OH-),故A错;NaHCO3溶液的pH=8.3,说明其水解程度大于电离程度,则c(H2CO3)>c(CO2-3),故B错;pH=11的氨水与pH=3的盐酸等体积混合时,氨水是过量的,溶液不显中性,故C错;D选项中的CH3COOH与NaOH反应,得到的是等浓度的CH3COOH和CH3COONa的混合溶液,由电荷守恒得:c(CH3COO-)+c(OH-)=c(H+)+c(Na+),由元素守恒得:2c(Na+)=c(CH3COO-)+c(CH3COOH),将电荷守恒关系式乘以2与元素守恒关系式相加得:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH),移项得:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH),故D正确。
答案:D3. 【解析】c(CH3COOH)随着pH的增大而减小,故虚线是CH3CHOOH ;c(CH3COO-)随着pH的增大而增大,故实线是c(CH3COO-). 由图像可知,pH=5.5时c(CH3COO-)>c (CH3COOH),故A错;c(Na+)+c(H+)=c(CH3COO-)+c(OH-) 是电荷守恒关系,是正确的,故B正确;pH=3.5溶液中c(Na+)+c(H+)=c(CH3COO-)+c(OH-),再把题干中的c(CH3COOH)+c(CH3COO-)=0.1mol·L-1代入上式移项后即可得C :c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol·L-1,故C正确;向W点所表示溶液中通入0.05molHCl气体,原有平衡被打破,建立起了新的平衡,因HCl+CH3COONa==NaCl+CH3COOH,故得到的是CH3COOH和NaCl的混合溶液,溶液中电荷守恒关系为:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(Cl-),将物料守恒式c(Na+)=c(Cl-)代入上述电荷守恒式得质子守恒式:c(H+)=c(CH3COO-)+c(OH-),故D错。
【答案】BC4. B5.D6.A B7.A8.(1) ①CH3COONa ;盐酸②14 (2)(I)②(II)①(III)中性9. (1)SO2+H2O H2SO3、2H2SO3+O22H2SO4(2)2OH-+SO 2SO32-+H2O(3)①酸NaHSO3溶液中存在HSO3-SO32-+H+和HSO3-+H2O H2SO3+OH-,HSO3-的电离程度强于水解程度②AB(4)①HSO3-+H2O-2e-SO42-+3H+②H+在阴极得电子生成H2,溶液中c(H+)降低,促使HSO3-电离生成SO32-,且Na+进入阴极室,吸收液得以再生。