实验室制取氯气装置图
- 格式:docx
- 大小:60.84 KB
- 文档页数:2

第3课时 氯气的实验室制法1.掌握氯气的制备原理及装置。
2.能结合实验室制取Cl 2的装置特点设计制备其他气体的实验装置,培养科学探究与创新意识,提升实验能力。
一、氯气的实验室制法1.反应原理(1)在实验室中,通常用浓盐酸与二氧化锰反应来制取氯气,反应的化学方程式:MnO 2+4HCl(浓)=====△MnCl 2+Cl 2↑+2H 2O ,离子方程式:MnO 2+4H ++2Cl -=====△Mn 2++Cl 2↑+2H 2O 。
(2)该反应的氧化剂是MnO 2,浓盐酸既表现还原性,又表现酸性。
2.制备装置(1)气体发生装置类型:固+液――→△气。
(2)发生装置所用主要仪器:分液漏斗、圆底烧瓶、酒精灯。
(3)除杂装置:装置C 的作用是除去Cl 2中少量的HCl 气体;装置D 的作用是干燥氯气(或除去氯气中的水蒸气)。
3.收集方法(1)向上排空气法(氯气的密度大于空气的)。
(2)排饱和食盐水法(氯气在饱和氯化钠溶液中的溶解度很小,用此法可除去实验中挥发产生的氯化氢气体)。
4.验满方法(三种方法)(1)观察到E 中充满黄绿色气体,则证明已集满。
(2)将湿润的淀粉碘化钾试纸靠近盛氯气的瓶口,观察到试纸立即变蓝,则证明已集满。
(3)将湿润的蓝色石蕊试纸靠近盛氯气的瓶口,观察到试纸立即发生先变红后褪色的变化,则证明已集满。
5.尾气处理烧杯F 中盛放的液体是NaOH 溶液,该液体的作用是吸收过量的氯气,防止污染环境。
(1)实验室制取的Cl 2中混有HCl 气体,可通过盛有碱石灰的干燥管除去( ) (2)MnO 2与稀盐酸在加热条件下也可制取Cl 2( ) (3)在实验室制取Cl 2的试剂中,HCl 只做还原剂( ) (4)Cl 2尾气可用饱和的澄清石灰水吸收处理( ) (5)实验室可以用排水法收集Cl 2( )1.制取Cl 2的原理是利用强氧化剂氧化浓盐酸中的Cl -生成Cl 2。
(1)在反应MnO 2+4HCl(浓)=====△MnCl 2+Cl 2↑+2H 2O 中,氧化剂是 ,还原剂是 ,氧化剂和还原剂个数之比为 。

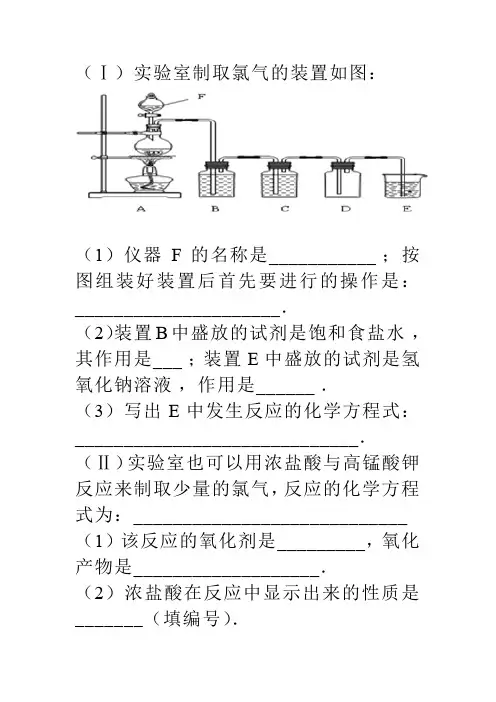
(Ⅰ)实验室制取氯气的装置如图:
(1)仪器F的名称是___________ ;按图组装好装置后首先要进行的操作是:_____________________.
(2)装置B中盛放的试剂是饱和食盐水,其作用是___ ;装置E中盛放的试剂是氢氧化钠溶液,作用是______ .
(3)写出E中发生反应的化学方程式:_____________________________.(Ⅱ)实验室也可以用浓盐酸与高锰酸钾反应来制取少量的氯气,反应的化学方程式为:____________________________ (1)该反应的氧化剂是_________,氧化产物是___________________.
(2)浓盐酸在反应中显示出来的性质是_______(填编号).
①只有还原性②还原性和酸性
③只有氧化性④氧化性和酸性
(3)若用足量的浓盐酸与一定量的二氧化锰反应,产生的氯气在标准状况下的体积为11.2L,则反应中被氧化的HCl的质量为多少?(要求计算过程)。






以下是实验室制取氯气的装置,在图中饱和食盐水的作用是吸收氯化氢
吸收氯化氢
,浓硫酸的作用是干燥
干燥
,F中盛放的溶液是氢氧化钠溶液
氢氧化钠溶液
,起的作用是吸收尾气
吸收尾气
.
考点:气体的净化(除杂);气体的干燥(除水);碱的化学性质.专题:实验性简答题.分析:实验室可以采用加热二氧化锰固体和浓盐酸的方法制取氯气,产生的氯气中混有氯化氢、水蒸气,氯气有毒,必须进行尾气处理,可以使用氢氧化钠溶液吸收.解答:解:加热二氧化锰固体和浓盐酸的方法制取氯气时,产生的氯气中容易混有氯化氢气体,要除去氯化氢气体,所选的除杂试剂只能吸收氯化氢而不能吸收氯气,故可以使用饱和食盐水将其除去,浓硫酸具有吸水性,可以除去氯气中混有的水蒸气,氯气有毒,必须进行尾气处理,防止其造成空气污染.
所以本题答案为:吸收氯化氢,干燥,氢氧化钠溶液,吸收尾气.。

考点37 氯气的实验室及工业制法聚焦与凝萃1.掌握氯气的实验室制法; 2.了解氯气的工业制法。
解读与打通常规考点1.氯气的实验室制法(1)反应原理:MnO 2+4HCl(浓)=====△MnCl 2+Cl 2↑+2H 2O①盐酸是浓盐酸,一般为12mol·L -1、1.9g·mL -1,稀溶液中的HCl 不能被MnO 2氧化;HCl 是还原剂,但还表现出酸性。
②必须加热,在常温下,MnO 2与浓盐酸是不反应的。
(2)实验装置图:图中:A 是分液漏斗,加浓盐酸;B 是圆底烧瓶,用于反应,液体不超过容积的2/3,加热时必须垫石棉网;C 是洗气瓶,瓶中装饱和食盐水,除去Cl 2中混有的HCl(氯气在饱和食盐水中比在水中溶解度小,可减少氯气的损耗);D 是洗气瓶,瓶中装浓H 2SO 4,干燥Cl 2;E 为收集装置,用向上排空气法收集Cl 2,进气管伸入集气瓶的底部;F 是尾气吸收装置,因氯气有毒,多余氯气要用NaOH 的溶液将其吸收(用水和石灰水吸收效果都不好。
) (3)氯气的检验:氯气可用湿润的KI 淀粉试纸检验,试纸变蓝,其原理是:Cl 2+2KI=2KCl +I 2,置换出的碘与淀粉反应生成蓝色物质。
隐性考点2.工业制法——电解饱和食盐水法 2NaCl +2H 2O=====通电2NaOH +H 2↑+Cl 2↑融合与应用例1.实验室用如下图所示装置制备Cl 2,并进行Cl 2的性质实验。
(1)A中加入KMnO4固体(反应后产物是MnCl2),B中盛有浓盐酸,烧瓶中发生反应的化学方程式为。
(2)C中盛有紫色石蕊试液,C中的现象是;D中有白色沉淀生成,D中盛放的试剂可能是;E 中溶液由无色变为蓝色,E中盛放的试剂可能是。
(3)F中一般盛放,其作用是。
【答案】(1)2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O(2)先变红后褪色AgNO3溶液KI淀粉溶液(3)NaOH溶液吸收多余的Cl2(2)产生的Cl2通入紫色石蕊试液中,Cl2与水反应产生的盐酸使石蕊由紫色变为红色,产生的HClO又可将红色漂白。
第二章 第二节 氯及其化合物第3讲 氯气的实验室制法【讲】知识点1氯气的实验室制法 1.反应原理(1)化学方程式:MnO 2+4HCl(浓)=====△MnCl 2+Cl 2↑+2H 2O 。
(2)原理:利用强氧化剂氧化浓盐酸中的Cl -生成Cl 2,该反应中MnO 2为氧化剂,浓盐酸为还原剂并且该实验还体现了浓盐酸的酸性。
2.仪器装置(1)气体发生装置类型:固+液――→△气(2)发生装置所用仪器:分液漏斗、圆底烧瓶、酒精灯。
(3)除杂装置:装置C 的作用是除去Cl 2中少量的HCl 气体。
装置D 的作用是干燥氯气(或除去氯气中的水蒸气)。
3.收集方法(1)向上排空气法(氯气密度大于空气)。
(2)排饱和食盐水法(氯气在饱和氯化钠溶液中的溶解度很小,用此法可除去实验中挥发产生的氯化氢气体)。
4.验满方法观察到E 中充满黄绿色气体,则证明已集满。
5.尾气处理烧杯F 中盛放的液体是NaOH 溶液。
该液体的作用是吸收过量的氯气,防止污染环境。
6、注意事项:(1)实验室制取氯气的反应原理是选用氧化剂(如MnO 2、KMnO 4等)将盐酸中的部分氯离子氧化而得到氯气。
(2)制取的氯气有毒,且在加热时容易逸出,所以应选用分液漏斗,而不用长颈漏斗。
(3)尾气处理时,不能用澄清石灰水吸收氯气,因为澄清石灰水中Ca(OH)2的含量少,吸收不完全。
(4)实验结束后,先使反应停止并排出装置中残留的氯气,再拆卸装置,避免污染空气。
【练】1.下列关于实验室制氯气的说法中错误的是( ) A .该反应是一个氧化还原反应,其中二氧化锰是氧化剂 B .HCl 表现还原性和酸性C .该反应的离子方程式为MnO 2+4H ++4Cl -=====△MnCl 2+2H 2O +Cl 2↑D .该方法是瑞典化学家舍勒最先发现的 答案 C解析 由MnO 2+4HCl(浓)=====△MnCl 2+2H 2O +Cl 2↑可知,二氧化锰是氧化剂,HCl 中氯元素部分化合价升高,HCl 既表现还原性,又表现酸性;氯化锰是可溶于水的强电解质,在离子方程式中应写成离子符号。
实验室制取氯气装置图公司标准化编码 [QQX96QT-XQQB89Q8-NQQJ6Q8-MQM9N]
以下是实验室制取氯气的装置,在图中饱和食盐水的作用是吸收氯化氢
吸收氯化氢
,浓硫酸的作用是干燥
干燥
,F中盛放的溶液是氢氧化钠溶液
氢氧化钠溶液
,起的作用是吸收尾气
吸收尾气
.
考点:气体的净化(除杂);气体的干燥(除水);碱的化学性质.专题:实验性简答题.分析:实验室可以采用加热二氧化锰固体和浓盐酸的方法制取氯气,产生的氯气中混有氯化氢、水蒸气,氯气有毒,必须进行尾气处理,可以使用氢氧化钠溶液吸收.解答:解:加热二氧化锰固体和浓盐酸的方法制取氯气时,产生的氯气中容易混有氯化氢气体,要除去氯化氢气体,所选的除杂试剂只能吸收氯化氢而不能吸收氯气,故可以使用饱和食盐水将其除去,浓硫酸具有吸水性,可以除去氯气中混有的水蒸气,氯气有毒,必须进行尾气处理,防止其造成空气污染.
所以本题答案为:吸收氯化氢,干燥,氢氧化钠溶液,吸收尾气.。