《铁丝在氧气中燃烧》实验技巧
- 格式:doc
- 大小:23.00 KB
- 文档页数:1


铁丝在氧气中燃烧的研究摘要“铁丝在氧气中燃烧”的实验,以小木炭块为铁丝引燃物较好。
当铁丝直径为 0.20 mm 时,最好3根拧在一起燃烧,当铁丝直径小于0.20 mm时,还要增加根数;用直径为0.38 mm的废石棉网铁丝1根、直径为0.23 mm的自行车闸钢丝1根或2根(拧在一起)、直径为0.50 mm的炮线1根为燃烧对象时,效果都好,尤其钢丝燃烧时的火星四射更美观。
关键词铁丝燃烧引燃物铁丝直径燃烧条件氧气“铁丝在氧气中燃烧”是初中化学教科书中证明氧气化学性质的一个学生实验(或演示实验,或学生活动与探究实验)。
该实验与“木炭在氧气中燃烧”、“硫在氧气中燃烧”及“蜡烛在氧气中燃烧”实验相比,有些化学教师觉得在操作上有困难,实验成功率较低。
为此,一些化学教师对该实验进行了改进,如“用酒精引燃铁丝”[1]、“用直径小于0.18 mm的细铁丝在酒精灯火焰上加热后直接伸入集气瓶”[2]等。
这些改进仅是单纯从一个角度考虑,且优势不太明显。
为了明确做好该实验的条件,笔者做了较系统、详细的研究。
1 实验过程1.1 直径不同的铁丝(钢丝)在纯氧气中燃烧第1步:选取容积为320 mL的集气瓶10个,用排水法集满氧气。
第2步:分别用火柴棒、绿豆大小的木炭块作为铁丝(钢丝)的引燃物;以相同直径的铁丝(钢丝)不同根数做燃烧对象进行实验;以不同直径的铁丝(钢丝)为燃烧对象进行实验,实验情况见表1。
表1 直径不同的铁丝(钢丝)在纯氧气中的燃烧情况铁丝直径及其来源燃烧对象铁丝燃烧情况说明铁丝燃烧部分照片0.20 mm废石棉网或铁纱窗的铁丝1根铁丝燃烧成功率高,但燃烧不太剧烈,火星四射的效果明显。
缺点:一是铁丝在燃烧过程中容易断掉,熔断率约50%。
二是铁丝太细,当坩埚钳夹住燃烧的铁丝插入集气瓶中时容易发生摆动,铁丝燃烧端在集气瓶中的位置不太好控制。
燃烧时间约2~5秒。
2根铁丝拧在一起燃烧成功率高,比1根铁丝燃烧均匀和剧烈,火星四射的效果明显,火星强度比1根铁丝大。

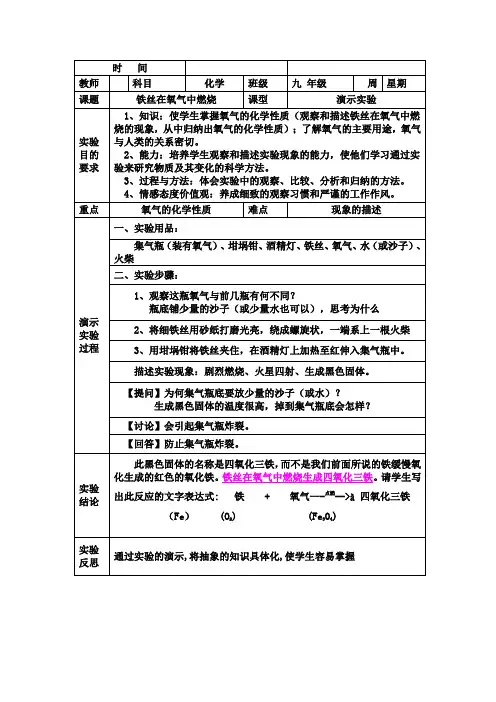
第1篇一、实验目的1. 观察铁丝在氧气中燃烧的现象。
2. 了解铁丝燃烧的化学原理。
3. 掌握实验操作技能。
二、实验原理铁丝在氧气中燃烧,生成四氧化三铁(Fe3O4),反应方程式为:3Fe + 2O2 → Fe3O4实验中,铁丝与氧气接触,温度升高,当达到铁丝的着火点时,铁丝开始燃烧。
燃烧过程中,铁丝表面形成一层熔融的四氧化三铁,阻止了氧气与铁丝的进一步接触,使燃烧反应逐渐减弱直至熄灭。
三、实验仪器与药品1. 仪器:酒精灯、火柴、铁丝、镊子、集气瓶、砂纸、剪刀、烧杯、玻璃棒。
2. 药品:氧气、稀盐酸。
四、实验步骤1. 准备工作:将铁丝剪成长约5cm的小段,用砂纸打磨表面,去除氧化层。
2. 点燃酒精灯,将铁丝放在火焰上加热,使其表面氧化层熔化。
3. 用镊子夹住铁丝,迅速将其伸入集气瓶中,使铁丝与氧气充分接触。
4. 观察铁丝燃烧现象,记录实验数据。
5. 将燃烧后的铁丝取出,放入烧杯中,加入少量稀盐酸,观察反应现象。
五、实验现象1. 铁丝在氧气中燃烧时,发出明亮的火花,产生大量的热量。
2. 燃烧后的铁丝表面形成一层黑色的熔融物,为四氧化三铁。
3. 燃烧后的铁丝放入稀盐酸中,产生气泡,说明铁丝表面的四氧化三铁与盐酸反应生成氯化铁。
六、实验数据1. 燃烧时间:约10秒。
2. 燃烧温度:约2000℃。
七、实验分析1. 铁丝在氧气中燃烧时,燃烧温度较高,燃烧时间较短。
2. 燃烧过程中,铁丝表面形成的四氧化三铁起到了保护作用,使铁丝与氧气接触面积减小,燃烧反应逐渐减弱。
3. 燃烧后的铁丝放入稀盐酸中,发生反应生成氯化铁,说明铁丝表面形成的四氧化三铁与盐酸反应。
八、实验结论1. 铁丝在氧气中燃烧时,产生明亮的火花,燃烧温度较高,燃烧时间较短。
2. 燃烧过程中,铁丝表面形成的四氧化三铁起到了保护作用,使铁丝与氧气接触面积减小,燃烧反应逐渐减弱。
3. 燃烧后的铁丝放入稀盐酸中,发生反应生成氯化铁。
九、实验注意事项1. 实验过程中,注意安全,避免火灾发生。

铁丝在氧气中燃烧的实验现象
一、实验目的
1. 了解铁丝在氧气中燃烧的现象。
2. 探究铁丝在氧气中燃烧的原理。
二、实验原理
铁丝在氧气的燃烧过程本质上是一种化学反应,即铁(Fe)与氧(O2)反应,产生热量和氧化铁粉(Fe2O3)。
因此,铁丝在氧气中的燃烧现象可以被解释为一种物理和化学的过程。
三、实验材料
1. 铁丝
2. 氧气
3. 水
四、实验方法
1. 将铁丝焊接在一根聚乙烯管的两端,将管内注入水。
2. 将另一根聚乙烯管的一端连接到一个氧气罐,另一端放入水中。
3. 将氧气开启,将氧气推进到水中,使水里面充满氧气。
4. 把铁丝点燃,观察铁丝在氧气中燃烧时的变化情况。
五、实验现象
当铁丝置于氧气中燃烧时,会发生以下现象:
1. 铁丝明显的燃烧,伴有铁丝融化的蓝色火焰。
2. 氧气内的热量使铁丝发热,并不断变短。
3. 铁丝燃烧时,会产生黑色的烟尘,即氧化铁粉(Fe2O3)。
六、实验结论
铁丝在氧气中燃烧的现象表明,它发生了一种物理与化学的反应,铁(Fe)与氧(O2)反应,产生热量和氧化铁粉(Fe2O3)。
课外延伸拓展能力下部(没有接触到细沙,如图所示),但不见铁丝燃烧,反复实验均未成功。
同学们认为可能导致失败的原因主要有哪几种?培养学生观察实验现象能力,分析推理,归纳总结能力。
学生总结归纳以下三点。
A.B.C.【实验改进】根据以上假设,我们应对实验改进为:(1) ;(2) ;(3) 。
学生结合生活和实践经验,归纳出:(1)用砂纸将铁丝表面的锈除去。
(2)待火柴快烧尽再将铁丝放入集气瓶中。
(3)将铁丝和火柴伸至集气瓶中上部,再缓缓伸至集气瓶底部。
【中考题】小明对铁丝在氧气中燃烧为什么会火星四射进行探究.下表是他将纯镁条和不同含碳量的铁丝(镁条和铁丝直径均为0.4mm)放入氧气中燃烧时的实验现象的记录.请你分析回答:物质镁条含碳0.05%的铁丝含碳0.2%的铁丝含碳0.6%的铁丝燃烧时的现象剧烈燃烧,发出耀眼白光,无火星剧烈燃烧极少火星剧烈燃烧少量火星未填(1)表中“未填”部分的内容应为_____;(2)与氧气反应的化学方程式是_____.该反应属于_____反应(填“化合”或“分解”).(3)通过以上探究,你认为铁丝在氧气中燃烧产生火星四射现象的原因可能是_____.学生利用已知条件归纳出:(1)剧烈燃烧,火星四射;(2)3Fe + 2O2Fe3O4 ;化合;(3)铁丝中含碳量≥0.6%.课外延伸拓展能力【拓展延伸】(1)一个同学发现“铁丝”在纯净氧气中燃烧起来,观察到火星四射,并有黑色固体生成,请写出该反应的化学方程式;(2)Fe2O3高温时会分解成Fe3O4和一种气体,请写出此反应的化学方程式__________;(3)有些超市的食品密封包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色_____,就说明包装盒破损进气,这样售货员就能及时发现并处理。
图片展示。
学生合作探究,讨论归纳。
[拓展延伸](1)3Fe + 2O2Fe3O4 (2)6Fe203 4Fe304+02↑ (3)由黑色变成红色。


铁丝在氧气中燃烧实验失败的原因及改进方法铁丝在氧气中燃烧实验失败的原因可能有很多,可以简单分为以下几类:
一、氧气浓度不足。
当氧气浓度较低时,铁丝就不能在其中燃烧,所以如果实验失败,可能是氧气不足的原因。
二、火焰太弱。
火焰太弱可能是氧气不足的结果,也可能是铁丝本身的原因,可能是铁丝的粗细不一,太细的铁丝无法引起燃烧,太粗的铁丝则无法在氧气中挥发热量。
三、火焰太大。
如果火焰太大,可能是铁丝接触点太多,造成火焰过大。
改进方法:
1、检查氧气浓度,确保氧气浓度在正常范围内;
2、选择合适粗细的铁丝,如果太粗,可以将铁丝细分成若干段;
3、确保铁丝不能太多地接触,避免出现火焰过大的情况;
4、使用正确的燃烧工具,如火把等;
5、实验前要仔细确认实验仪器、材料的操作步骤;
6、火焰和铁丝之间保持一定距离,以免超出最佳燃烧条件,影响实验效果。

铁丝在氧气中燃烧的实验改进装置一、实验背景铁丝在氧气中燃烧是一种常见的化学实验,通过此实验可以观察到铁丝在氧气中燃烧的现象,同时也可以了解到化学反应的基本原理。
然而,传统的铁丝在氧气中燃烧实验存在一些问题,例如火焰不稳定、实验过程容易受到环境因素的影响等。
因此,需要对该实验进行改进。
二、改进方案1. 实验材料(1)铁丝:用于进行燃烧反应。
(2)氧气:提供反应所需的氧气。
(3)点火器:用于点燃铁丝。
(4)试管架:用于固定试管。
(5)试管:用于装载铁丝和氧气。
2. 实验步骤(1)准备试管和试管架,并将试管放置在试管架上。
(2)将适量的铁丝放入试管中,并将其密封。
(3)连接好供氧装置,并向试管中注入足够的氧气。
(4)使用点火器点燃铁丝,观察反应过程并记录相关数据。
3. 实验注意事项(1)在进行实验时,需要注意安全问题,避免发生意外事故。
(2)实验过程中需要严格控制氧气的流量,以避免反应过程中出现不稳定的火焰。
(3)为了保证实验结果的准确性,需要对实验条件进行严格控制,例如温度、湿度等环境因素。
三、改进效果通过对传统铁丝在氧气中燃烧实验进行改进,可以有效地提高实验的可重复性和准确性。
新的改进方案可以使火焰更加稳定,并且能够在更加恒定的环境条件下进行实验。
同时,新方案也可以减少环境因素对实验结果的影响,从而使得实验结果更加可靠。
四、结论综上所述,通过对铁丝在氧气中燃烧实验进行改进,可以提高实验效果和准确性。
新方案具有简单易行、操作简便等特点,在化学教育和科学研究中具有广泛应用前景。

2013-10教学实践细铁丝在氧气中燃烧的实验,是学习氧气化学性质时的一个重要的实验,是很有代表性的一个实验,该实验的教学让学生认识这样几个问题:(1)某些在空气中不能燃烧的物质可以在氧气中燃烧;(2)某些物质燃烧的点燃方法比较特殊;(3)有些物质燃烧时没有火焰出现;(4)由于燃烧放出热量大,生成物是高温的物质会下落到瓶底,所以实验前需要在瓶底放一些水或细沙,防止瓶底炸裂。
该实验一般是需要把铁丝绕成螺旋状,并在下端系一根火柴,让火柴先燃烧给铁丝加热,使铁丝达到着火点。
关于铁丝绕成螺旋状的原因,很多资料都说是为了增大铁丝与氧气的接触面积,也有说是为了使铁丝变短,便于加热达到着火点。
这两种解释的道理毫不相关,是不是都正确呢?为了验证这两种解释,我利用实验进行了探究。
要验证的问题有两个:一是绕成螺旋状是不是使铁丝燃烧的必要条件;二是铁丝燃烧前是否需要把它全部或大部分加热。
为此,我设计的实验及准备的材料是:1.铁丝是从石棉网上拆下来的,经过砂纸打磨,铁丝长度约12cm,直径约近0.4mm。
2.集气瓶容积约162mL,集气后剩余水约15~17mL,所以瓶中所盛氧气约145mL,理论上足够铁丝燃烧。
3.氧气为加热高锰酸钾制取,并用排水法收集氧气。
4.下表中的五个实验中的每个实验重复做四次。
铁丝处理及点燃方法如下表的五种:铁丝形状点燃铁丝的方法绕成螺旋状(1)下端系一根火柴,用火柴点燃,让火焰尽量加热铁丝的大部分到红热(2)无火柴,用酒精灯加热至全部红热不绕成螺旋状,铁丝是直的(3)下端系一根火柴,火柴燃着时铁丝竖直放置,尽量让火焰把铁丝加热,达到2~3cm红热(4)下端系一根火柴,火柴燃烧时铁丝水平放置,让火焰只加热铁丝最下端不到1cm处(5)不系火柴,用酒精灯火焰尽量使铁丝加热到红热五个实验的现象分别为:(1)铁丝在集气瓶中剧烈燃烧,火星四射,一根铁丝燃烧有时不能持续地出现火星,燃烧到后半部分时,有时不出现火星四射现象,铁丝下端有个红白色小球越来越大,铁丝变短。

铁在氧气中燃烧的实验在一个阳光明媚的下午,我们决定来点儿不一样的实验,铁在氧气中燃烧。
听起来是不是挺酷的?先说说这个实验的材料,铁丝、氧气,还有火焰。
火焰啊,可是能把人心里小鹿乱撞的东西。
我们把一根铁丝夹在夹子上,像是准备要给它穿衣服一样。
然后,准备好火焰,点燃的时候,心里小激动,脑海里闪过“来吧,燃烧吧”的念头。
火苗一蹿,啊,这可不是闹着玩的,瞬间整个铁丝就开始发光,像是得了神一样。
这时候,大家都围过来了,眼睛都瞪得像铜铃,嘴巴张得大大的,完全被眼前的景象吸引住了。
铁丝在空气中燃烧,散发出耀眼的光芒,简直就像是小太阳降临人间。
你知道的,氧气是个好东西,它跟铁结合的时候,能产生一种叫做“氧化铁”的东西。
这个词听上去有点儿高大上,其实就是铁跟氧气亲密接触后,变得像铁锈一样。
这个过程真的是太神奇了,就像是魔法在眼前上演。
等到铁丝烧到一半,空气中的氧气仿佛都变得稀薄起来。
好像铁丝在说:“我需要更多的氧气!”而我们则在一旁像个小观众,哈哈,真想给它加点儿氧气,让它燃烧得更旺。
这个实验让我想到人生啊,有时候我们也是需要一些“氧气”的,才能燃烧出自己的光芒。
对了,大家别忘了安全哦,火可不是好玩的玩意儿,实验室的规矩可得遵守。
随着时间的推移,铁丝逐渐变成了一种黑乎乎的物质,看到这儿,有人忍不住问:“这是啥?为什么变成这样?”我心里乐开了花,没想到大家对科学也这么好奇。
这就是铁氧化后的结果,形成了氧化铁。
看着这个变化,我想起了许多东西,人生中的经历也是如此,很多时候我们都是在不断地变化和成长。
突然间,实验室里的一位小伙伴喊:“哇,真美!”我们大家都转过头,看到铁丝发出的火光映照在每个人的脸上,简直像是让人心中充满了希望。
此时此刻,所有的烦恼似乎都被这股热情驱散了。
我们都忍不住在想,科学原来可以这么迷人,这些简单的反应却能让人感觉到无穷的魅力。
在这个过程中,大家也在不停地讨论,各种各样的想法纷至沓来。
有人说:“这就像我们的梦想,有时候需要一点点火焰。
《铁在氧气中燃烧实验的创新设计》铁在氧气中燃烧实验一直是化学课程中的经典实验之一,通过这个实验,我们可以直观地观察到金属铁与氧气反应产生的现象。
在这篇文章中,我将从实验的设计和原理入手,探讨铁在氧气中燃烧实验的创新设计,以及对这一实验的深入理解。
希望通过这篇文章的阐述,让读者对这一经典实验有更全面、深入的认识和理解。
1. 实验目的:观察铁在氧气中燃烧的现象,了解金属与氧气反应的过程和产物。
2. 实验设计:1) 实验器材:铁丝、点燃用的火柴、试管、架子、砂子。
2) 实验步骤:a. 将铁丝用火柴点燃,使其处于燃烧状态。
b. 将燃烧的铁丝放入试管中,然后用砂子将试管口封住。
c. 观察试管内的现象。
3. 实验原理:铁与氧气反应生成氧化铁,释放出大量的热量和光亮。
4. 创新设计:在传统的实验设计基础上,可以对实验器材进行调整,例如采用更细、更纯净的铁丝,以及针对不同压力氧气的反应进行实验。
5. 实验结果分析:观察到燃烧的铁丝变成了黑色的铁烬,试管内壁也有一层铁色的氧化物沉淀。
6. 深度理解:铁在氧气中的燃烧反应是一种氧化还原反应,是化学中常见的反应类型。
通过这个实验,我们可以更直观地感受到金属与氧气反应的剧烈性质,加深对化学知识的理解。
总结:铁在氧气中燃烧实验是化学课程中的一大亮点,通过这一实验,学生可以更深入地理解氧化还原反应的基本原理,以及金属与氧气反应的特点。
通过对实验设计的创新,可以让学生更深入地理解这一实验的原理和意义。
个人观点:铁在氧气中燃烧实验是化学教学中不可或缺的一环,通过这一实验,可以激发学生对化学现象的兴趣,培养学生的观察力和实验能力,是一种非常有效的教学手段。
对实验设计的创新可以更好地引导学生思考和探索,促进他们对化学知识的深入理解。
通过本文的阐述,相信读者对铁在氧气中燃烧实验的创新设计和深入理解有了更全面的认识。
在进行这一实验时,我们可以进行更多的思考和探索,从而更好地理解化学反应的本质。
铁丝在氧气中燃烧实验失败的原因及改进
方法
铁丝在氧气中燃烧是一个经典的化学实验,但在实际操作中,有时会出现实验失败的情况。
那么,为什么实验失败了?如何改进?
一般来说,实验失败的原因有以下几点:
氧气的浓度不够,一般情况下,氧气的浓度应大于21%,这样才能够支撑铁丝在氧气中燃烧。
氧气中可能含有其他气体,这些气体会与铁丝燃烧时形成反应,使燃烧失败。
铁丝的温度可能不够高,铁丝的温度应该超过600℃才能在氧气中燃烧。
还有一些不可控的因素,会对实验结果造成影响,比如温度、湿度等。
针对这些原因,要想让实验成功,需要改进以下几点:
应确保氧气的浓度足够,可以使用气体分析仪来测量氧气浓度;应保证气体中无其他物质,可以在实验前对气体进行分析;
应确保铁丝温度足够高,可以使用火花塞等工具来加热铁丝。
以上就是铁丝在氧气中燃烧实验失败的原因及改进方法。
只有综合运用这些改进方法,才能保证实验成功,并得到满意的实验结果。
铁丝在空气和氧气中燃烧的实验现象以铁丝在空气和氧气中燃烧的实验现象为标题,我们来探索一下这个现象的原因和背后的化学反应。
我们需要了解什么是燃烧。
燃烧是一种氧化反应,即物质与氧气发生化学反应释放能量的过程。
燃烧通常需要三个要素:燃料、氧气和点火源。
在这个实验中,铁丝就是我们的燃料,而空气和氧气则作为氧化剂提供氧气。
在常温下,铁丝是不会自燃的,因为铁丝的燃点相对较高。
然而,当我们将铁丝加热到足够高的温度时,铁丝就会开始燃烧。
这是因为高温使铁丝表面的氧气分子与铁丝表面的铁原子发生反应,形成了铁的氧化物。
这个反应是一个放热反应,释放出大量的热能。
铁丝在空气中燃烧的化学反应可以用以下方程式表示:4Fe + 3O2 -> 2Fe2O3 + 热能在这个方程式中,4个铁原子与3个氧气分子反应生成了2个铁的氧化物分子,并释放出热能。
铁的氧化物在实验中呈现出红色的火焰,这是因为铁的氧化物对热的辐射具有特定的能量级,发出了红光。
当我们将实验环境从空气改为纯氧气时,铁丝的燃烧现象会变得更加明显。
这是因为氧气是一种更强的氧化剂,可以更有效地供应氧气给铁丝,使其燃烧得更加旺盛。
铁丝在氧气中燃烧的化学反应方程式与在空气中的反应方程式相同。
除了氧化反应,铁丝在燃烧过程中还伴随着其他的化学反应。
例如,铁丝在高温下与空气中的氮气反应,形成了氮氧化物。
这些氮氧化物在实验中呈现出淡黄色的火焰。
总结一下,铁丝在空气和氧气中燃烧的实验现象是由铁丝与氧气发生氧化反应而产生的。
这个反应释放出大量的热能,并产生了铁的氧化物和氮氧化物。
通过这个实验,我们可以更好地理解燃烧的本质和化学反应的原理。
希望通过这篇文章的介绍,读者能够对铁丝在空气和氧气中燃烧的实验现象有一个更清晰的理解,并对燃烧的化学反应产生兴趣。
通过实验,我们可以不断探索和发现更多有趣的化学现象,丰富我们的科学知识。
《铁丝在氧气中燃烧实验》改进技巧
铁丝在氧气中燃烧火星四射原因:铁中碳燃烧产生的气体使铁燃烧生成的熔化物向四周飞溅形成的。
含碳不同的铁丝在氧气中燃烧的现象:工业级较纯铁丝(含碳0.05﹪),不能燃烧或燃烧不能持久,火星极少量;低碳钢铁丝(含碳0.2﹪),燃烧但不能持久,火星少量;中高碳钢铁丝(含碳0.6﹪),剧烈燃烧,火星四射。
铁丝在氧气中燃烧注意事项:1、选用中高碳钢铁丝,如纱窗的钢丝或圆珠笔中的弹簧或石棉网上的铁丝。
2、铁丝的粗细要合理,铁丝不能太细,太细易烧断;铁丝也不能太粗,太粗不易引燃。
3、铁丝不能部分生锈,铁丝燃烧时容易在生锈部分烧断。
4、铁丝绕成螺旋状,铁丝在燃烧匙的把柄上绕成螺旋状,缠绕时尽量紧密一些,螺旋状铁丝8—10cm长即可。
5、引燃铁丝的木条粗细,要看铁丝的粗细,若是纱窗的钢丝,用牙签就可以引燃,而圆珠笔中的弹簧或钢丝,则用火柴棍粗细的木条,长1.5cm即可。
6、铁丝伸入集气瓶时机,要待火柴棍即将燃尽方可伸入瓶中,以免木条燃烧消耗集气瓶中氧气,造成集气瓶中氧气含量不高,铁丝无法燃烧。
7、铁丝伸入集气瓶要由上到下慢慢伸入,这样才能充分利用瓶中氧气,使铁丝燃烧长久一些。
8、集气瓶的容积要大,尽量选用250ml的集气瓶。
9、集气瓶事先要放少量水或一层细沙,防止铁丝燃烧生成的熔融物炸裂瓶底。