2019高考化学三轮冲刺大题提分大题精做7电解工艺流程
- 格式:docx
- 大小:33.32 KB
- 文档页数:6

题型十八化学工艺流程题通关演练(建议完成时间:30分钟)1.(2018·皖北联考)氢溴酸在医药和石化工业上有广泛用途。
下图是模拟工业制备氢溴酸粗产品并精制的流程:根据上述流程回答下列问题:(1)混合①中发生反应的离子方程式为________________________________。
(2)混合①中使用冰水的目的是______________________________________。
(3)操作Ⅲ一般适用于分离________混合物。
(填序号)a.固体和液体 b.固体和固体c.互不相溶的液体 d.互溶的液体(4)混合②中加入Na2SO3的目的是____________________________________。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。
于是甲乙两同学设计了简单实验加以探究:甲同学假设工业氢溴酸呈淡黄色是因为其中含有Fe3+,则用于证明该假设所用的试剂为________,若假设成立可观察到的现象为__________________;乙同学假设工业氢溴酸呈淡黄色是因为其中含有________________,其用于证明该假设所用的试剂为____________。
解析SO2与Br2在水中发生氧化还原反应,反应放热,为防止溴蒸发,用冰水降温。
操作Ⅰ、Ⅲ均是蒸馏,操作Ⅱ是过滤。
混合②中加入Na2SO3的目的是除去粗产品中未反应完的溴。
检验Fe3+常用KSCN溶液;工业氢溴酸中可能含有溴而呈淡黄色,可用四氯化碳萃取而证明。
答案(1)SO2+Br2+2H2O===4H++2Br-+SO2-4(2)降低体系温度,防止溴蒸发,使反应完全(3)d (4)除去粗产品中未反应完的溴(5)KSCN溶液溶液变成红色Br2CCl4(其他合理答案也可)2.(2018·马鞍山模拟)钴酸锂(LiCoO2)锂离子电池是一种应用广泛的新型电源,实验室尝试利用废旧钴酸锂锂离子电池回收铝、铁、铜、钴、锂元素,实验过程如下:(1)碱浸泡过程中,铝被溶解的离子方程式为____________________________________________________________________________________________。

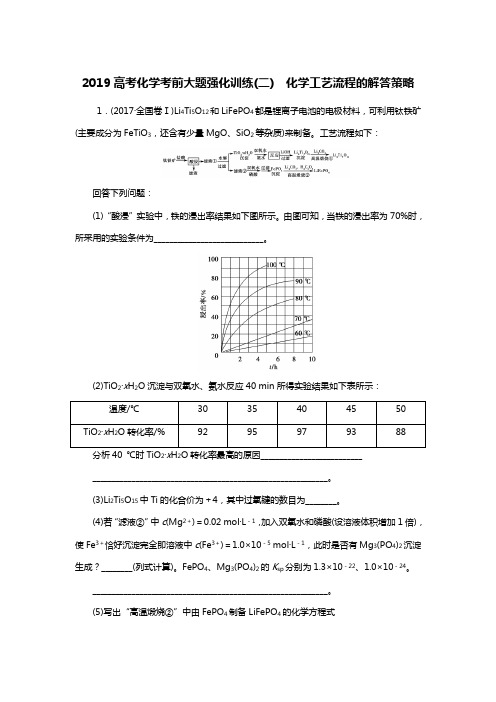
2019高考化学考前大题强化训练(二) 化学工艺流程的解答策略1.(2017·全国卷Ⅰ)Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备。
工艺流程如下:回答下列问题:(1)“酸浸”实验中,铁的浸出率结果如下图所示。
由图可知,当铁的浸出率为70%时,所采用的实验条件为____________________________。
(2)TiO2·x H2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:温度/℃30 35 40 45 50 TiO2·x H2O转化率/% 92 95 97 93 8822____________________________________________________________。
(3)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为________。
(4)若“滤液②”中c(Mg2+)=0.02 mol·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 mol·L-1,此时是否有Mg3(PO4)2沉淀生成?________(列式计算)。
FePO4、Mg3(PO4)2的K sp分别为1.3×10-22、1.0×10-24。
____________________________________________________________。
(5)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式_________________________________________________________________________________________________________________________。

大题精做七电解工艺流程1.焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。
回答下列问题:(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。
写出该过程的化学方程式__________。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:`①pH=4.1时,Ⅰ中为__________溶液(写化学式)。
②工艺中加入Na2CO3固体、并再次充入SO2的目的是__________。
(3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。
阳极的电极反应式为_____________。
电解后,_____________室的NaHSO3浓度增加。
将该室溶液进行结晶脱水,可得到Na2S2O5。
(4)Na2S2O5可用作食品的抗氧化剂。
在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.01000mol·L−1的碘标准液滴定至终点,消耗10.00mL。
滴定反应的离子方程式为_____________,该样品中Na2S2O5的残留量为____________g·L−1(以SO2计)。
【解析】(1)亚硫酸氢钠过饱和溶液脱水生成焦亚硫酸钠,根据原子守恒可知反应的方程式为2NaHSO3===Na2S2O5+H2O;(2)①碳酸钠饱和溶液吸收SO2后的溶液显酸性,说明生成物是酸式盐,即Ⅰ中为NaHSO3;②要制备焦亚硫酸钠,需要制备亚硫酸氢钠过饱和溶液,因此工艺中加入碳酸钠固体、并再次充入二氧化硫的目的是得到NaHSO3过饱和溶液;(3)阳极发生失去电子的氧化反应,阳极区是稀硫酸,氢氧根放电,则电极反应式为2H2O-4e−===4H++O2↑。
阳极区氢离子增大,通过阳离子交换膜进入a室与亚硫酸钠结合生成亚硫酸钠。
阴极是氢离子放电,氢氧根浓度增大,与亚硫酸氢钠反应生成亚硫酸钠,所以电解后a室中亚硫酸氢钠的浓度增大。

2019届高考化学主观题押题练习—27题工艺流程图题(B卷)1、工业上电解精炼铜的阳极泥是重要的二次资源,从阳极泥(含铜、银、金、铅等单质)中提取金和制备AgCl的工艺如下:已知:分金液的主要成分为H[AuCl4];分金渣的主要成分为PbSO4和AgCl;分银液的主要成分为[Ag(SO 3)2]3-,且存在[Ag(SO3)2]3-Ag++22SO3回答下列问题:1.“分铜”时,铜单质参与反应的离子方程式为___________;如果温度过高,铜的浸出率会降低,原因是____________。
2.“分铜渣”中的成分有Au、Ag、AgCl和__________。
3.“分金”时,溶解单质金的化学方程式为________;除HC1、NaC1O3可溶解金外,“王水”也可溶解金,“王水”的成分为_____________(写试剂的名称)。
4.从“分金液”中提取金时,氧化剂和还原剂的物质的量之比为_______________。
5.向“分银液”中加入适量的H2SO4调到pH=4时“沉银”,能够析出AgCl的原因是___________。
6.AgCl能溶于氨水,发生反应AgCl(s)+2NH 3(aq)[Ag(NH3)2](aq))+Cl-(aq),其平衡常数K=2.0×10-3,现用1L某浓度氨水(溶质视为NH3)完全溶解0.1mol AgCl,所需氨水浓度至少为____________mol·L-15)。
2、从工业废钒中回收金属钒既避免污染环境又有利于资源综合利用。
某工业废钒的主要成分为V2O5,、VOSO4和SiO2等,下图是从废钒中回收钒的一种工艺流程:1.为了提高“酸浸”效率,可以采取的措施有 (填两种)。
2.“还原”工序中反应的离子方程式为 。
3.“沉钒”得到NH 4VO 3沉淀,需对沉淀进行洗涤,检验沉淀完全洗净的方法是 。
4.写出流程中铝热反应的化学方程式 。
5.电解精炼时,以熔融NaCl 、CaCl 2和VCl 2为电解液(其中VCl 2以分子形式存在)。

专题10 第28题工业流程题一、试题解读化学工艺流程题是高考的必考题型,题目综合性强,难度大,通常以化工生产中流程图的形式,以陌生元素或陌生化合物知识为载体,综合考查元素化合物知识、氧化还原反应方程式的书写、实验基本操作、实验步骤的分析、实验方案的评价、产率的计算、K sp的应用、绿色化学思想的体现等,可以说是真正的学科内综合题,无所不考。
二、试题考向三、必备知识知识点1 工业流程的三个阶段原料预处理的常用方法知识点2常考化工术语及操作1. 常考化工术语2. 常见的操作与思考角度3. 循环物质的确定4. 副产品的判断5. 滤渣、滤液成分的确定要考虑样品中原料和杂质的成分在每一步骤中与每一种试剂反应的情况:(1) 反应过程中哪些物质(离子)消失了?(2) 所加试剂是否过量或离子间发生化学反应,又产生了哪些新离子?要考虑这些离子间是否会发生反应?6.物质分离、提纯的六种物理方法和八种化学方法知识点3.陌生氧化还原反应方程式书写的具体步骤1.常见氧化剂及其还原产物2.常见还原剂及其氧化产物四、高考回顾1.(2018年全国1卷)焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。
回答下列问题:(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。
写出该过程的化学方程式__________。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:①pH=4.1时,Ⅰ中为__________溶液(写化学式)。
②工艺中加入Na2CO3固体、并再次充入SO2的目的是__________。
(3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。
阳极的电极反应式为_____________。
电解后,__________室的NaHSO3浓度增加。
将该室溶液进行结晶脱水,可得到Na2S2O5。
(4)Na2S2O5可用作食品的抗氧化剂。
2019届高考化学人教版三轮冲刺专题强化训练元素化合物的综合应用——化学工艺流程题1、NaBiO3可作为钢铁分析中测定锰的氧化剂,Bi2O3在电子行业有着广泛应用,可利用浮选过的辉铋矿(主要成分是Bi2S3,还含少量SiO2等杂质)来制备。
其工艺流程如下:回答下列问题:(1)辉铋矿的“浸出液”中铋元素主要以Bi3+形式存在,写出Bi2S3与FeCl3溶液反应的离子方程式:_________________________________;加入盐酸,既可提高铋的浸出率,又可________________________;滤渣1的主要成分是________和硫。
(2)NaBiO3是为数不多的钠盐沉淀之一,由溶液3制得纯净的NaBiO3,操作2包括________________。
(3)Bi2O3与Na2O2可在熔融状态下反应制得NaBiO3,其副产物为________。
(4)写出“煅烧”中由碱式碳酸铋[(BiO)2CO 3]制备Bi 2O 3的化学方程式: ____________________________________。
(5) 某工厂用m 1kg 辉铋矿(含Bi 2O 360%)制备NaBiO 3,最终得到产品m 2kg ,产率为___________________。
答案 (1)Bi 2S 3+6Fe 3+===2Bi 3++6Fe 2++3S 抑制溶液中Bi 3+的水解 SiO 2(2)过滤、洗涤、干燥 (3)Na 2O(4)(BiO)2CO 3=====煅烧Bi 2O 3+CO 2↑ (5)233m 2168m 1×100% 解析 由题中信息可知,辉铋矿经氯化铁和盐酸的混合液浸取后,硫化铋中的硫离子被氧化为硫单质,过滤后除去二氧化硅和硫等滤渣,向滤液中加入足量的铁粉把铋置换出来得到海绵铋,海绵铋经盐酸和双氧水溶解得到氯化铋溶液,向氯化铋溶液中加入氢氧化钠溶液和次氯酸钠溶液把氯化铋氧化为铋酸钠;向氯化铋溶液中加入碳酸铵可以生成碳酸氧铋沉淀,碳酸氧铋经煅烧得到氧化铋。
题型十七化学工艺流程题通关演练(建议完成时间:20分钟)1.氢溴酸在医药和石化工业上有广泛用途。
下图是模拟工业制备氢溴酸粗产品并精制的流程:根据上述流程回答下列问题:(1)混合①中发生反应的离子方程式为________________________________.(2)混合①中使用冰水的目的是_______________________________________。
;(3)操作Ⅲ一般适用于分离________混合物。
(填序号)a.固体和液体 b.固体和固体c.互不相溶的液体 d.互溶的液体(4)混合②中加入Na2SO3的目的是____________________________________。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。
于是甲乙两同学设计了简单实验加以探究:甲同学假设工业氢溴酸呈淡黄色是因为其中含有Fe3+,则用于证明该假设所用的试剂为________,若假设成立可观察到的现象为__________________;乙同学假设工业氢溴酸呈淡黄色是因为其中含有________________,其用于证明该假设所用的试剂为____________。
;解析SO2与Br2在水中发生氧化还原反应,反应放热,为防止溴蒸发,用冰水降温。
操作Ⅰ、Ⅲ均是蒸馏,操作Ⅱ是过滤。
混合②中加入Na2SO3的目的是除去粗产品中未反应完的溴。
检验Fe3+常用KSCN溶液;工业氢溴酸中可能含有溴而呈淡黄色,可用四氯化碳萃取而证明。
答案(1)SO2+Br2+2H2O===4H++2Br-+SO错误!(2)降低体系温度,防止溴蒸发,使反应完全(3)d (4)除去粗产品中未反应完的溴(5)KSCN溶液溶液变成红色Br2CCl4(其他合理答案也可)2.(2018·马鞍山模拟)钴酸锂(LiCoO2)锂离子电池是一种应用广泛的新型电源,实验室尝试利用废旧钴酸锂锂离子电池回收铝、铁、铜、钴、锂元素,实验过程如下:(1)碱浸泡过程中,铝被溶解的离子方程式为__________________________ _________________________________________________________________.(2)滤液A中加入草酸铵溶液,使Co元素以CoC2O4·2H2O沉淀形式析出。
大题精做五 物质制备类化工工艺流程1.(2018北京卷)磷精矿湿法制备磷酸的一种工艺流程如下:已知:磷精矿主要成分为Ca 5(PO 4)3(OH),还含有Ca 5(PO 4)3F 和有机碳等。
溶解度:Ca 5(PO 4)3(OH)<CaSO 4·0.5H 2O(1)上述流程中能加快反应速率的措施有__________。
(2)磷精矿粉酸浸时发生反应:2Ca 5(PO 4)3(OH)+3H 2O+10H 2SO 4====△10CaSO 4·0.5H 2O+6H 3PO 4①该反应体现出酸性关系:H 3PO 4__________H 2SO 4(填“>”或“<”)。
②结合元素周期律解释①中结论:P 和S 电子层数相同,__________。
(3)酸浸时,磷精矿中Ca 5(PO 4)3F 所含氟转化为HF ,并进一步转化为SiF 4除去。
写出生成HF 的化学方程式:__________。
(4)H 2O 2将粗磷酸中的有机碳氧化为CO 2脱除,同时自身也会发生分解。
相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。
80℃后脱除率变化的原因:____________________。
(5)脱硫时,CaCO 3稍过量,充分反应后仍有SO 2−4残留,原因是__________;加入BaCO 3可进一步提高硫的脱除率,其离子方程式是____________________。
(6)取a g 所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用b mol ·L −1NaOH 溶液滴定至终点时生成Na 2HPO 4,消耗NaOH 溶液c mL ,精制磷酸中H 3PO 4的质量分数是________。
(已知:H 3PO 4摩尔质量为98g ·mol −1)【解析】磷精矿粉酸浸后生成粗磷酸和磷石膏,粗磷酸经过脱有机碳、脱硫等步骤获得精制磷酸。
研磨能增大反应物的接触面积,加快反应速率,加热,升高温度加快反应速率;流程中能加快反应速率的措施有:研磨、加热。
大题精做七电解工艺流程1.焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。
回答下列问题:(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。
写出该过程的化学方程式__________。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:`①pH=4.1时,Ⅰ中为__________溶液(写化学式)。
②工艺中加入Na2CO3固体、并再次充入SO2的目的是__________。
(3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。
阳极的电极反应式为_____________。
电解后,_____________室的NaHSO3浓度增加。
将该室溶液进行结晶脱水,可得到Na2S2O5。
(4)Na2S2O5可用作食品的抗氧化剂。
在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.01000mol·L−1的碘标准液滴定至终点,消耗10.00mL。
滴定反应的离子方程式为_____________,该样品中Na2S2O5的残留量为____________g·L−1(以SO2计)。
【解析】(1)亚硫酸氢钠过饱和溶液脱水生成焦亚硫酸钠,根据原子守恒可知反应的方程式为2NaHSO3===Na2S2O5+H2O;(2)①碳酸钠饱和溶液吸收SO2后的溶液显酸性,说明生成物是酸式盐,即Ⅰ中为NaHSO3;②要制备焦亚硫酸钠,需要制备亚硫酸氢钠过饱和溶液,因此工艺中加入碳酸钠固体、并再次充入二氧化硫的目的是得到NaHSO3过饱和溶液;(3)阳极发生失去电子的氧化反应,阳极区是稀硫酸,氢氧根放电,则电极反应式为2H2O-4e−===4H++O2↑。
阳极区氢离子增大,通过阳离子交换膜进入a室与亚硫酸钠结合生成亚硫酸钠。
阴极是氢离子放电,氢氧根浓度增大,与亚硫酸氢钠反应生成亚硫酸钠,所以电解后a室中亚硫酸氢钠的浓度增大。
(4)单质碘具有氧化性,能把焦亚硫酸钠氧化为硫酸钠,反应的方程式为S2O2−5+2I2+3H2O===2SO2−4+4I−+6H+;消耗碘的物质的量是0.0001mol,所以焦亚硫酸钠的残留量(以SO2计)是0.0001mol×64g/mol=0.128g/L。
0.05L【答案】(1)2NaHSO3===Na2S2O5+H2O(2)NaHSO3得到NaHSO3过饱和溶液(3)2H2O-4e−===4H++O2↑ a(4)S2O2−5+2I2+3H2O===2SO2−4+4I−+6H+0.1281.(2018云南昆明市诊断理综)高锰酸钾是一种重要的氧化剂,在消毒杀菌等方面应用广泛。
实验室以固体碱熔氧化法制备高锰酸钾,其部分流程如下:回答下列问题:(1)为提高第③步的浸出速率,可采取的措施之一是______________________________(2)第④步通入CO 2,将溶液的pH 调至10~11时,2MnO 4完全转化为MnO 4和MnO 2。
第①步碱熔时发生反应的化学方程式为______________________________。
(3)第⑥步母液中主要含有的溶质一定有2CO 3、Cl 和________。
该流程中,除了浓缩结晶的母液之外,还可以循环使用的物质是___________。
(4)工业上可采用如图所示装置电解2MnO 4溶液制备MnO 4。
①b 是直流电的________极②该装置中的离子交换膜是________交换膜(填“阴离子”或“阳离子”)③电解时阳极的电极反应式是________________。
④与“固体碱熔氧化法”相比,“电解法”的优点是________________________。
【解析】在碱性条件下氯酸钾与二氧化锰加热熔融发生氧化还原反应,二氧化锰被氧化成锰酸钾,溶于水得墨绿色2MnO 4溶液,2MnO 4溶液中通入CO 2使MnO 2−4发生歧化反应,生成MnO −4和MnO 2,趁热过滤除去二氧化锰,得高锰酸钾溶液,冷却结晶得高锰酸钾晶体,(1)搅拌、适当升温、将废渣碾细成粉末等均可加快反应速率,所以为提高第③步的浸出速率,可采取的措施有将熔融物粉碎、不断搅拌、适当加热等,故答案为:不断搅拌或适当加热。
(2)由题意可知,OH 、ClO 3、MnO 2共熔制得绿色2MnO 4,发生反应方程式为:ClO 3+ 3MnO 2+6OH=====高温Cl+32MnO 4+3H 2O ,故答案为:3MnO 2+6OH=====高温Cl+32MnO 4+3H 2O 。
(3)第⑥步母液中主要含有的溶质一定有2CO 3、Cl 和MnO 4,除了浓缩结晶的母液之外,还可以循环使用的物质是MnO 2,故答案为:MnO 4;MnO 2。
(4)①由图可知,MnO 2−4应该在阳极失电子生成MnO −4,所以a 是直流电的正极,b 是直流电的负极,故答案为:负。
②由图可知,阴极区的电极反应式为2H ++2e −===H 2↑,阴极区OH −浓度增大,稀OH 变为浓OH ,该装置中的离子交换膜应是阳离子交换膜,允许阳离子+通过,故答案为:阳离子。
③电解时阳极的MnO 2−4的放电能力强于OH −,故阳极的电极反应式为:MnO 2−4-e −===MnO −4,故答案为:MnO 2−4-e −===MnO −4。
④与“固体碱熔氧化法”相比,“电解法”的优点是原料利用率高,产品更纯净,答案为:原料利用率高,产品更纯净。
【答案】(1)不断搅拌或适当加热(2) ClO 3+3MnO 2+6OH=====高温Cl+32MnO 4+3H 2O(3) MnO 4 MnO 2(4) 负阳离子 MnO 2−4-e −===MnO −4原料利用率高,产品更纯净2.(2018四川自贡诊断理综)工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。
钛铁矿主要成分为钛酸亚铁(FeTiO 3),其中一部分Fe 2+在风化过程中会转化为+3价。
已知:TiO(OH)2(即H2TiO3)为两性氢氧化物(1)步骤②中,发生主要反应的离子方程式为__________。
(2)步骤③中,实现混合物的分离是利用物质的__________填字母序号)。
A.熔沸点差异B.溶解性差异C.氧化性、还原性差异(3)步骤②、③、④中,均需用到的操作是__________(填操作名称)。
(4)请结合化学用语,用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理:__________。
(5)上述工艺流程中可以循环利用的物质是__________(6)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
①写出阳极所发生反应的电极反应式__________。
②在制备金属Ti前后,CaO的质量将__________(填“增大”、“不变”或“减小”)。
【解析】(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为2Fe3++Fe===3Fe2+,故答案为:2Fe3+ +Fe===3Fe2+。
(2)步骤③冷却结晶得到硫酸亚铁晶体,利用的是物质溶解度的不同,通过冷却热饱和溶液得到;故答案为B。
(3)②③④步骤的操作过程中都得到沉淀或晶体,所以需要过滤得到固体和溶液,故答案为:过滤。
(4)步骤④中使用热水的目的是促进TiO2+水解生成H2TiO3,分离出固体加热得到TiO2;溶液中存在平衡:TiO2++2H2OH2TiO3+2H+,当加入热水稀释、升温后,平衡正向移动,生成H2TiO3;故答案为:溶液中存在平衡:TiO2++2H2OH2TiO3+2H+,当加入热水稀释、升温后,平衡正向移动,生成H2TiO3。
(5)流程中生成了硫酸,步骤①中使用硫酸,可循环使用,故答案为:H2SO4或硫酸。
(6)①用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,阳极发生氧化反应,阴极析出钙、发生还原反应,由阳极图示产物可知,阳极生成一氧化碳气体,是电解质中的氧离子失电子生成氧气,氧气和阳极石墨反应生成的一氧化碳,所以电极反应为:2O2−-4e−===O2↑或C+O2−-4e−===CO↑,故答案为:2O2−-4e−===O2↑或C+O2−-4e−===CO ↑。
②制备TiO2时,在电解槽发生如下反应:阴极:2Ca2++4e−===2Ca 阳极:2O2−-4e−===O2↑,钙再还原二氧化钛生成钛:2Ca+TiO2===Ti+2CaO,由此可见,CaO的量不变,故答案为:不变。
【答案】(1)2Fe3++Fe===3Fe2+(2)B(3)过滤(4)溶液中存在平衡:TiO2++2H2OH2TiO3+2H+,当加入热水稀释、升温后,平衡正向移动,生成H2TiO3(5)H2SO4或硫酸(6)2O2−-4e−===O2↑或C+O2−-4e−===CO↑不变3.(2018山东济南一模)红帘石矿的主要成分为Fe3O4、Al2O3、MnCO3、MgO少量MnO2等。
工业上将红帘石处理后运用阴离子膜电解法的新技术提取金属锰并制得绿色高效的水处理剂(2FeO4)。
工业流程如下:(1)在稀硫酸浸取矿石的过程中,MnO2可将Fe2+氧化为Fe3+,写出该反应的离子方程式:__________ _______。
(2)浸出液中的阳离子除H+、Fe2+、Fe3+外还有_______(填离子符号)。
(3)已知:不同金属离子生成生成氢氧化物沉淀所需的pH如下表:)滤渣B除掉杂质后可进一步制取2FeO4,除掉滤渣B中杂质最好选用下列哪种试剂:_____。
a.稀盐酸b.OHc.氨水d.MnCO3e.CaCO3(4)滤渣B经反应④生成高效水处理剂的离子方程式_______________。
(5)电解装置如图所示,箭头表示溶液中阴离子移动的方向;则与A电极连接的是直流电的_____极。
阳极电解液是稀硫酸,若阴极上只有锰单质析出,当生成11g锰时,另一个电极上产生的气体在标准状况下的体积为________。
【解析】本题考查化学工艺流程。
(1)在稀硫酸浸取矿石的过程中,MnO2将溶液中Fe2+氧化为Fe3+,MnO2被还原为Mn2+,反应的离子方程式为:MnO2+2Fe2++4H+===2Fe3++Mn2++2H2O;(2)由题意可知,在稀硫酸浸取矿石的过程中,过量的稀硫酸与Fe3O4、Al2O3、MnCO3、MgO反应生成Fe2+、Fe3+、Al3+、Mn2+、Mg2+,部分Fe2+被MnO2氧化为Fe3+,即浸出液中的阳离子除H+、Fe2+、Fe3+外还有Al3+、Mn2+、Mg2+;(3)步骤②中先加双氧水将Fe2+氧化为Fe3+,再调节溶液的pH 等于6,将溶液中Fe3+和Al3+转化为Fe(OH)3沉淀和Al(OH)3沉淀,调节溶液的pH时,最好选用不引入杂质的MnCO3;除去Fe(OH)3沉淀中的Al(OH)3沉淀,应选用强碱OH溶液与Al(OH)3反应生成可溶的AlO2;(4)Fe(OH)3在碱性条件下被ClO氧化为2FeO4,ClO被Fe(OH)3还原为Cl,反应的离子方程式为:2Fe(OH)3+3ClO−+4OH−===2FeO2−4+3Cl−+5H2O;(5)由电子的移动方向可知,与A电极连接的是直流电的负极,则A电极为电解池的阴极,B电极为电解池的阳极,阴极上Mn2+放电生成Mn,阳极上OH−放电生成O2,11g锰的物质的量为0.2mol,由得失电子数目守恒可知,在标准状况下阳极生成0.1molO2,在标准状况下的体积为2.24L。