卤代烃与醇、酚、醚的课程总结
- 格式:ppt
- 大小:329.50 KB
- 文档页数:34

卤代烃、醇和酚(讲义)卤代烃一、典型的卤代烃——溴乙烷:卤代烃化学性质通常比烃活泼,能发生很多化学反应而转化成各种其他类型的化合物,因此,引入卤原子常常是改变分子性能的第一步反应,在有机合成中起着重要的桥梁作用.1、分子组成和结构:(在结构上可以看成是由溴原子取代了乙烷分子中的一个氢原子后所得到的产物)分子式结构式结构简式官能团C2H5Br CH3CH2Br或C2H5Br —Br溴乙烷比例模型及球棍模型:溴乙烷的结构特点溴乙烷与乙烷的结构相似,区别在于C—H键与C—Br的不同。
C—Br键为极性键,由于溴原子吸引电子能力强,C—Br键易断裂,使溴原子易被取代。
由于官能团(-Br)的作用,溴乙烷的化学性质比乙烷活泼,能发生许多化学反应。
2、溴乙烷的物理性质:纯净的溴乙烷是无色液体,沸点低,密度比水大,不溶于水。
说明:相对分子质量大于乙烷,导致C2H5Br分子间作用力增大,其熔点、沸点、密度均大于乙烷。
3、溴乙烷化学性质:在卤代烃分子中,卤素原子是官能团。
由于卤素原子吸电子的能力较强,使共用电子对偏移,C—X 键具有较强的极性,因此卤代烃的反应活性增强。
①水解反应:(H2O中的—OH取代溴乙烷分子中的Br原子)实验步骤:大试管中加入5mL溴乙烷;加入15mL20%NaOH溶液,加热;向大试管中加入稀HNO3酸化;滴加2滴AgNO3溶液。
现象:大试管中有浅黄色沉淀生成——证明上述实验中溴乙烷里的Br原子变成了Br-。
说明:a、该反应属于取代反应,C2H5-Br中的-Br被H2O中的-OH 取代;b、该反应比较缓慢,可采取加热和加入氢氧化钠的方法,加快此反应的速率、提高乙醇的产量。
原因是水解反应吸热,NaOH溶液与HBr反应,减小HBr的浓度,所以平衡向正反应方向移动,CH3CH2OH的浓度增大;c、验证Br变成了Br-时,要用HNO3酸化溶液,目的:中和过量的NaOH溶液,防止生成Ag2O暗褐色沉淀,对Br-的检验产生干扰。


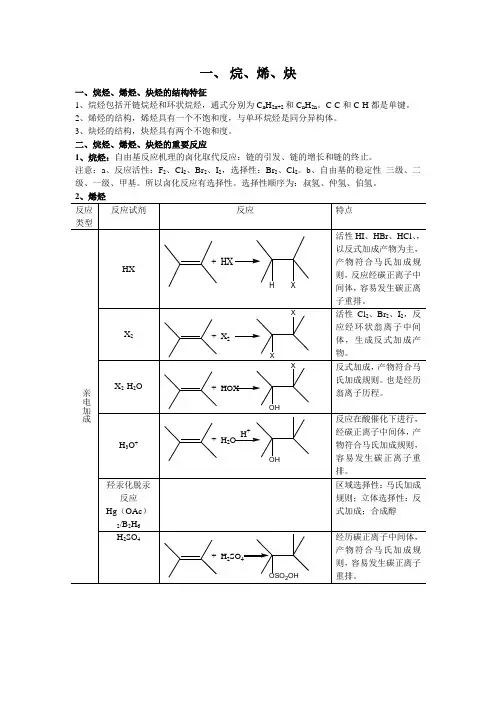
一、烷、烯、炔一、烷烃、烯烃、炔烃的结构特征1、烷烃包括开链烷烃和环状烷烃,通式分别为C n H2n+2和C n H2n。
C-C和C-H都是单键。
2、烯烃的结构,烯烃具有一个不饱和度,与单环烷烃是同分异构体。
3、炔烃的结构,炔烃具有两个不饱和度。
二、烷烃、烯烃、炔烃的重要反应1、烷烃:自由基反应机理的卤化取代反应:链的引发、链的增长和链的终止。
注意:a、反应活性:F2、Cl2、Br2、I2,选择性:Br2、Cl2。
b、自由基的稳定性三级、二级、一级、甲基。
所以卤化反应有选择性。
选择性顺序为:叔氢、仲氢、伯氢。
(1)、与X2和HX可发生1,2-和1,4-加成,后者又称为共轭加成。
1,2-加成是速率控制的反应,1,4-加成是平衡控制的反应。
(2)、D-A反应特点:反应是经环状过渡态进行的协同成环反应,具有立体选择性。
而且是反应是可逆的。
在较高温度下,产物经逆反应生成共轭二烯烃和相应的不饱和亲二烯烃。
富电子的共轭二烯和缺电子的亲二烯体有利于正常的D-A反应的进行。
当烯烃双键上连有吸电子的取代基时是有利于反应的进行。
而且在反应完成时,主要生成内型加成产物。
二、芳烃与芳香杂环化合物一、苯的结构、休克尔规则与芳香性1、苯的结构2、休克尔规则与芳香性(1)芳香性的特点a、具有较大的C/H比b、键长趋于平均化c、具有特殊的稳定性的d、难加成e、易取代f、难氧化(2)非苯系芳香性体系要满足休克尔规则要点:a、单环的化合物具有共轭的离域体系b、共平面或近似于平面c、共轭的π电子数符合4n+2规则,n值必须为整数。
3、具有一个杂原子的五元环、六元环芳香杂环呋喃、吡咯、噻吩和吡啶。
一般说来,杂原子与碳原子的电负性愈接近,其相应的五元芳香的杂环的芳香性愈强。
其共轭能力也愈大。
二、芳环上的取代反应1、苯环上的亲电取代反应芳环上的亲电取代反应主要包括卤化、磺化、消化和付-克反应。
反应通式可表示为:2、苯环上的亲核取代反应由于在芳环中π电子云密度相对较大,亲核试剂难于向芳环进攻,发生相应的亲核取代反应。

卤代烃醇酚的知识整理--------------------------------------------------------------------------------卤代烃醇酚的知识整理________________________________卤代烃、醇和酚是有机化学中的三大类有机物,分别是无机物,有机物和有机混合物的重要成分。
它们的特性和用途都非常复杂,下面我们就来整理一下它们的相关知识。
### 一、卤代烃卤代烃,即卤族烃,是一类以卤素为中心原子的有机物质,也就是指含有卤素原子的烃,如氯代烃、溴代烃、硝代烃、氟代烃和碘代烃。
它们的特性很复杂,具体可以分为以下几点:* 结构强度:卤代烃具有较强的化学稳定性,可以耐受高温和高压。
* 稳定性:卤代烃具有较高的沸点和高沸点油的特性,抗氧化性强,具有良好的耐腐蚀性。
* 抗氧化性:卤代烃具有较强的抗氧化能力,可以防止氧化反应的发生。
### 二、醇醇是一类以氢原子为中心原子的有机物质,也就是指含有氢原子的有机物质,如乙醇、丙醇、甲醇、乙二醇和甘油等。
它们的特性很复杂,具体可以分为以下几点:* 稳定性:醇具有较高的沸点,在常温下能耐受长时间的加热。
* 抗氧化性:醇具有较强的抗氧化能力,可以保护物质不受氧化而损坏。
* 可溶性:醇具有良好的溶解性,能够很好地与水和其他溶剂混合。
### 三、酚酚是一类以氧原子为中心原子的有机物质,也就是指含有氧原子的有机物质,如苯酚、对二苯甲酚、三氯甲酚和对甲基对二苯甲酚等。
它们的特性很复杂,具体可以分为以下几点:* 稳定性:酚具有较低的沸点和抗氧化性,但是受到弱酸、弱基或其他氧化剂的影响时会发生氧化反应。
* 抗氧化性:酚具有一定的抗氧化能力,能够保护物质不受氧化而损坏。
* 可溶性:酚具有较差的溶解性,但在一定条件下可以很好地与水或其他溶剂混合。
### 四、卤代烃、醇和酚的应用卤代烃、醇和酚除了上述特性外,还广泛应用于日常生活中。


第38讲卤代烃醇酚目录考情分析网络构建考点一卤代烃的结构与性质【夯基·必备基础知识梳理】知识点1 卤代烃的结构及性质知识点2 卤代烃的检验【提升·必考题型归纳】考向1 考查卤代烃的结构与性质考向2 考查卤代烃的检验考向3 考查卤代烃在有机合成中的作用考点二醇、酚、醚【夯基·必备基础知识梳理】知识点1 醇、酚、醚的结构知识点2 醇、酚、醚的性质【提升·必考题型归纳】考向1 考查醇的结构与性质考向2 考查酚的结构与性质真题感悟知识点1 卤代烃的结构及性质 1.概念(1)卤代烃是烃分子里的氢原子被卤素原子取代后生成的化合物。
通式可表示为R—X(其中R—表示烃基),饱和一元卤代烃通式:C n H 2n +1X(n ≥1)。
(2)官能团是卤素原子或碳卤键。
【特别提醒】卤代烃不属于烃类,而且有的卤代烃分子中不含氢原子,如CCl 4等。
2.物理性质(1)沸点:比同碳原子数的烃沸点要高,同系物的沸点随碳原子数增加而升高; (2)溶解性:难溶于水,易溶于有机溶剂;(3)密度:一般一氟代烃、一氯代烃比水小,其余比水大。
(4)常温常压下,除CH 3Cl 、CH 3CH 2Cl 等少数为气体外,其余为液体或固体。
3.化学性质 (1)水解反应①反应条件:氢氧化钠的水溶液、加热。
②C 2H 5Br 在碱性条件下水解的化学方程式为C 2H 5Br +NaOH――→H 2O△C 2H 5OH +NaBr 。
③用R—CH 2—X 表示卤代烃,碱性条件下水解的化学方程式为 R—CH 2—X +NaOH――→水△R—CH 2OH +NaX 。
(2)消去反应①概念:有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H 2O 、HBr 等),而生成含不饱和键化合物的反应。
②卤代烃消去反应条件:氢氧化钠的醇溶液、加热。
③溴乙烷发生消去反应的化学方程式为CH 3CH 2Br +NaOH――→醇△CH 2===CH 2↑+NaBr +H 2O 。



3、知识点梳理:卤代烃、醇、酚的知识点卤代烃、醇、酚知识点归纳一、卤代烃1、卤代烃的分类:看《有机化学基础》P602、卤代烃对人类生活的影响:可作溶剂(如四氯化碳、氯仿)、农药(如DDT)、制冷剂(如氟利昂)、灭火剂(如四氯化碳),药剂(氯乙烷,运动场上的急救药剂)。
卤代烃通常较稳定,大量使用容易造成环境污染3、卤代烃的物理性质:看《有机化学基础》P62及笔记。
卤代烃都不溶于水,少数为气体(如一氯甲烷、氯乙烷、氯乙烯),多数为液体或固体;少数密度小于水(如一氟脂肪烃、一氯脂肪烃)多数密度大于水(如溴乙烷、1,2-二溴乙烷,溴苯等)4、卤代烃的化学性质:水解反应(取代反应):所有的卤代烃都能发生水解反应,官能团由-X→-OH。
反应的条件:强碱水溶液,加热消去反应:β-C上有H的卤代烃可以发生消去反应,官能团由-X→碳碳双键或碳碳叁键。
反应的条件:强碱醇溶液,加热(醇通常为乙醇)写出下列化学反应方程式:2-溴丙烷水解与消去反应:1,2-二溴丙烷的水解与消去反应补充:①RX+Mg RMgX(格氏试剂),RMgX + R'-X →R-R'+ MgX2②2RX + 2Na →R-R + 2NaX如:CH3CH2Br + Mg CH3CH2Mg Br,CH3CH2Mg Br + CH3 Br →CH3CH2 CH3+ Mg Br2Br CH2CH2CH2CH2Br + 2Na →+ 2Na Br(看懂上述反应的断键与成键)5、卤代烃中卤素原子的检验取样→加氢氧化钠水溶液→加热→冷却→加足量稀硝酸→加硝酸银溶液→看沉淀颜色判断所含的卤素原子种类(此方法所有卤代烃都适用)取样→加氢氧化钠醇溶液→加热→冷却→加足量稀硝酸→加硝酸银溶液→看沉淀颜色判断所含的卤素原子种类(此方法只适合能发生消去反应的卤代烃)二、醇1、醇的分类:看笔记2、醇的物理性质羟基为亲水基团,羟基数越多越易溶于水,低级醇通常也易溶于水,有些可以与水任意比互溶(如乙醇、乙二醇、甘油)3、醇的化学性质重点:催化氧化、消去反应★RCH2OH RCHO(醛)RCOOH(羧酸),(酮)(酮不能继续被氧化),α-C上无H不能催化氧化★β-C有氢才能发生消去反应,条件:浓硫酸,加热4、乙醇的物理性质:看笔记,俗名酒精,医用酒精(75%)5、乙醇的化学性质:①取代反应★乙醇与钠的反应方程式:现象:比水缓慢,钠沉在乙醇下★乙醇与浓的氢卤酸方程式:实验步骤了解《有机化学基础》P68★乙醇与乙酸的反应(又叫酯化反应)方程式:该反应断键规律:酸脱羟基醇脱氢实验时a.无水乙醇b.冰醋酸c.浓硫酸加入的先后顺序为:acb实验现象:饱和碳酸钠溶液上方生成无水油状物,振荡静置后仍有分层现象,该油状物有特殊的芳香气味浓硫酸的作用:催化剂、吸水剂饱和碳酸钠的作用:有利于乙酸乙酯分层析出,溶解除去乙醇,反应除去乙酸导管不插入到饱和碳酸钠溶液中的目的:防倒吸★生成乙醚的反应:②消去反应(实验室制乙烯的方法)方程式:乙醇与浓硫酸的体积比:1:3浓硫酸的作用:催化剂、脱水剂沸石的作用:防暴沸温度计水银球位置:插入到反应液中,但不触及烧瓶底部温度需控制在170℃左右,不宜过低原因:有副反应,140℃时会生成乙醚不宜过高原因:会引起乙醇脱水碳化,使反应液变黑,碳还能与浓硫酸反应生成二氧化硫与二氧化碳,使乙烯中含有酸性杂质。

醇醚酚知识点总结一、醇的基本性质醇是一类具有羟基(-OH)官能团的化合物,它们的结构中含有碳-氧-氢键。
醇通常具有较强的极性和亲水性,能够与水发生氢键作用,因此常常用作溶剂和中间体。
醇还具有一定的酸碱性,称为醇基。
在酸性条件下,醇可以被质子化,形成醇盐,具有一定的亲核性。
在碱性条件下,醇可以脱质子化,形成醇醚酚负离子,参与亲核取代反应。
醇的醇基对其性质有一定影响,醇基的醇性随着醇基数量的增加而增强,醇基位置对醇的性质也有一定影响。
另外,醇分子中的碳-氢键还可以发生氧化反应,生成醛、酮等产物。
二、醚的基本性质醚是一类具有氧-碳-碳键的有机化合物,具有较高的惰性和较低的沸点,通常用作非极性溶剂。
醚的结构中,氧原子与两个碳原子通过共价键连接,环状醚分子中还存在着环张力,因而环状醚分子具有一定的活性。
醚的惰性使得它对氧化还原反应不敏感,因此可以作为还原剂或氧化剂。
醚分子中的氧原子还能与金属形成络合物,因此醚也被广泛应用于金属有机化学中。
醚还具有较高的内部旋转自由度,使得其分子结构可以存在多种构象。
这种特性使得醚能够形成副产物,并对化学反应产生影响。
三、酚的基本性质酚是一类具有氢氧酚基的有机化合物,通常含有环状结构。
酚的结构中,氢氧酚基对其性质具有重要影响,氢氧酚基能够增加分子的极性和亲水性。
酚分子中的氢原子可以被取代成为相应的酚衍生物。
酚具有较高的亲电性,能够与亲电试剂发生取代反应,并具有较高的活性。
酚还能发生芳香性亲电取代反应,形成取代酚化合物。
由于酚分子中含有羟基,因此具有一定的酸碱性。
在酸性条件下,酚会失去羟基质子化,形成酚盐;在碱性条件下,酚则失去氢离子形成酚负离子。
四、醇醚酚的制备方法通常情况下,制备醇醚酚化合物的方法主要包括以下几种。
1. 醇的制备方法醇可以通过卤代烃与金属卤化物反应制备。
另外,在烯烃水合反应和羧酸加氢反应中也可以得到醇。
2. 醚的制备方法醚可以通过醇的脱水反应制备,其中脱水剂可以是酸或碱。
第九章 有机化学基础 第4讲 卤代烃 醇 酚课标要求核心考点五年考情核心素养对接1.认识卤代烃、醇、酚的组成和结构特点、性质、转化关系及其在生产、生活中的重要应用,知道醚的结构特点及其应用。
2.能够列举各类有机化合物的典型代表物的主要物理性质。
3.能描述和分析卤代烃、醇、酚的典型代表物的重要反应,能书写相应的反应式。
4.能基于官能团、化学键的特点与反应规律分析和推断含有典型官能团的有机化合物的化学性质卤代烃 2023年6月浙江,T10;2021湖南,T13;2021上海,T9;2021年6月浙江,T7;2019全国Ⅰ,T91.宏观辨识与微观探析:认识烃的衍生物的多样性,能从官能团角度认识烃的衍生物的组成、结构、性质和转化关系,形成“结构决定性质”的观念。
2.证据推理与模型认知:能依据官能团、化学键的特点对陌生有机物的性质进行精准预测;能结合已知信息对烃的衍生物的组成、结构、性质和反应进行推断醇 酚2023年1月浙江,T9;2023湖北,T4;2023海南,T12;2023江苏,T9;2022山东,T7;2022湖北,T2;2022年6月浙江,T15;2021全国乙,T10;2021河北,T12;2021福建,T2;2021北京,T1;2021辽宁,T6;2021重庆,T5;2020全国Ⅰ,T8;2020山东,T11;2020海南,T10;2019全国Ⅰ,T36命题分析预测1.选择题中常结合卤代烃、醇、酚典型代表物的结构与性质,考查陌生有机化合物的结构与性质。
非选择题中常结合有机合成和推断,考查烃的衍生物间的相互转化。
2.在考查烃的衍生物结构与性质时,可能会与化学反应原理深度融合。
3.在考查烃的衍生物间的转化与有机合成时,含氮衍生物会有所强化,从以前的“卤代烃和含氧衍生物”的综合深入到“卤代烃、含氧衍生物和含氮衍生物”的综合1.观点与视角(1)“结构决定性质”视角卤代烃中共价键的极性决定了卤代烃的化学活性及活性部位:碳骨架引入卤素原子后,形成极性较强的C —X 键(X 为卤素原子),且通过诱导效应增强了β-C 上C —H 键极性,极性的变化不仅使卤代烃的化学活性比相应的烃增强,还决定了卤代烃发生化学反应的活性部位。