漆酶活性测定方法
- 格式:docx
- 大小:23.43 KB
- 文档页数:7

固态发酵漆酶活性测定:酶液制取:5g 发酵样品以1:20(W/V )比例用蒸馏水悬浮,200 r/min 摇3h ,之后5000 r/min 离心20min 。
(上清用0.45µm 滤纸过滤,于-20℃保存滤液,取能整除的滤液体积用于漆酶活性测定。
)酶活反应体系3.0mL (2.3mL 0.2mol/L 醋酸-醋酸钠缓冲液;pH=4.50.5mL 粗酶液稀释液;0.2mL 1mmol/L 的ABTS )420nm 处测定吸光值的变化。
此实验固态发酵漆酶活性计算公式:5g 0.5mL 100mL L T 36000V 10)g (/U 3420⨯⨯⨯⨯⨯⨯∆⨯⨯=酶总OD V NN :酶液稀释倍数V 总: 漆酶酶活测定反应体体系的终体积(mL )V 酶: 反应添加的酶液体积(mL )△OD 420: t 时间内反应液在420nm 处吸光度的增加值36000: 420nm 处ABTS 氧化态的摩尔吸光系数(L/mol ·cm)T :反应时间(min )L 为比色皿的直径(cm )。
100mL/(0.5mL ×5g):固态变成液态的稀释倍数液态发酵漆酶活性测定:酶活反应体系3.0mL (2.3mL 0.2mol/L 醋酸-醋酸钠缓冲液;pH=4.50.5mL 粗酶液稀释液;0.2mL 1mmol/L 的ABTS )L T 36000V 10)g (/U 酶3420总⨯⨯⨯⨯∆⨯⨯=OD V NN :酶液稀释倍数 V 总: 漆酶酶活测定反应体体系的终体积(mL )V 酶: 反应添加的酶液体积(mL )△OD 420: t 时间内反应液在420nm 处吸光度的增加值36000: 420nm 处ABTS 氧化态的摩尔吸光系数(L/mol ·cm)T :反应时间(min )L 为比色皿的直径(cm )。
固态发酵锰过氧化物酶(MnP )活性测定:酶液制取:粗酶液制备发酵过程中每隔 2 d 取 5 g 发酵物于 250 mL 三角瓶中,加入 100 mL H 2O ,在 200 r / min 的摇床中振荡提取 3 h ,之后5000 r/min 离心20min 。

漆酶简介漆酶是一种含铜的多酚氧化酶(Laccase, P-diphenol oxidase, EC.1.10.3.2) ,广泛分布于高等动植物、昆虫、真菌分泌物和少量细菌中,其中最主要的是担子菌亚门的白腐真菌。
漆酶为含铜的糖蛋白,约由500 个氨基酸组成,多为单一多肽,个别为四聚体。
糖配基占整个分子的10%~45%,糖组成包括氨基己糖、葡萄糖、甘露糖、半乳糖、岩藻糖和阿拉伯糖等。
由于分子中糖基的差异,漆酶的分子量随来源不同会有很大差异,甚至来源一样的漆酶分子量也会不同。
通过对漆酶蛋白质晶体构造的争辩觉察,漆酶具有3 个铜离子结合位点,共结合4 个铜离子,且这4 个铜离子处于漆酶的活性部位,在催化氧化反响中起打算作用,假设除去铜离子,漆酶将失去催化作用。
漆酶具有较强的氧化复原力量,能催化多酚、多氨基苯等物质的氧化,使分子氧直接复原成水,将酚类和芳胺类化合物复原成醌类物质,没有副产物的生成。
由于漆酶具有特别的催化性能和广泛的作用底物,使得漆酶具有广泛的应用价值。
漆酶应用主要集中在制浆造纸,特别是纸浆的生物漂白,环境保护,木质纤维素降解等方面。
造纸工业方面,由于漆酶能高效的降解木质素及与木质素具有相像构造的物质,避开造纸工序中所使用的化学物质影响环境。
环境保护方面,漆酶能有效的除去工业废水、化学农药当中的毒物酚、芳胺、单宁和酚醛化合物,生物消退有毒化合物,使得漆酶在废水处理等环保事业有宽阔的前景。
分光光度法测定漆酶活力最常用的底物是2,2’-连氮一双(3-乙基苯并唆毗咯琳-6-磺酸)(ABTS)。
试验一高产漆酶菌株酶活测定1主要试剂的配制(1)0.2 mmol/L pH 4.5 柠檬酸-柠檬酸钠缓冲溶液A 液:0.2 mmol/L 柠檬酸溶液:称取柠檬酸21.014 g,参加蒸馏水溶解定容至500mL。
B 液:0.2 mmol/L 柠檬酸钠溶液:称取柠檬酸钠29.412 g,参加蒸馏水溶解定容至500mL。

目录摘要................................................................................................................................. I Abstract.......................................................................................................................................... II 前言 . (1)1材料与方法 (2)1.1实验材料与方法 (2)1.2 培养基 (3)1.3 实验方法 (3)1.3.1 产漆酶菌株的筛选 (3)1.3.2 漆酶液态发酵及其制备 (3)2 漆酶酶活性的测定 (4)2.1 ABTS-分光光度计法 (4)2.2 分光光度法具体步骤 (4)2.3酶活性的计算 (4)3 菌株的活化 (4)3.1 培养基及主要试剂的配置 (4)3.2 菌种活化步骤 (5)4 改良CTAB法提取待测菌株全基因组 (5)4.1 基因组提取 (5)5 结果与分析 (6)6 讨论和小结 (9)1. 讨论 (9)2. 小结 (9)参考文献 (10)致谢 (11)摘要本实验从南昌农药厂土壤中分离筛选出一株能够产漆酶活性的细菌菌株,并初步分析和鉴定了该菌株。
此菌株具有生长快速、遗传稳定、菌落规则的特性。
为了从土壤中筛选产漆酶酶活相对较高的菌株,采用以愈创木酚为底物,利用平板筛选法和定性测定酶活力法筛选得到高产漆酶菌株。
以ABTS〔2,2’-连氮基-双(3-乙基苯丙噻唑啉-6-磺酸)〕为底物测定漆酶活得到产漆酶活性的菌株,菌株的产酶高峰期出现在发酵培养基培养后的第6天,最高的产漆酶活为5.33U。
通过测序和序列比对得到此菌株为溶血葡萄球菌JCSC1435(hemolytic Staphylococcus JCSC1435)。

土壤漆酶测定方法土壤漆酶的测定可没那么神秘,就像探索一个小秘密一样呢。
咱先来说说比较常用的比色法。
这就像是给漆酶的活动拍个照,通过颜色变化来知道它的情况。
你得先采集土壤样本哦,把土壤从地里取出来的时候,就像从大地妈妈那里拿个小礼物一样。
采集好后,要对土壤进行预处理,把杂质什么的去掉,让漆酶能“清清白白”地接受检测。
然后准备一些特定的试剂,这些试剂就像是漆酶的小伙伴,它们碰到一起就会发生有趣的反应。
把处理好的土壤样本和试剂混合在一起,就等着看颜色的魔法啦。
如果漆酶在土壤里含量比较高,那颜色变化就会很明显,就像一个活泼的小孩在大声说“我在这儿呢”。
通过专门的仪器测量颜色变化的程度,就能算出漆酶的活性啦。
还有一种方法是酶联免疫吸附测定法,这名字听起来有点复杂,其实也很有趣。
这个方法就像是给漆酶做个标记,让它无处遁形。
同样要先把土壤样本准备好,然后利用漆酶和特定抗体之间的特殊关系。
抗体就像一个超级侦探,专门找漆酶这个小目标。
当它们结合的时候,又会产生一些信号,我们通过检测这些信号的强弱,就可以知道土壤里漆酶的多少啦。
这就像是一场小小的追逐游戏,抗体追着漆酶,然后我们就知道漆酶的情况了。
不过不管用哪种方法,在测定的时候都要特别小心哦。
就像照顾小宝贝一样,环境的温度、湿度都可能影响结果。
如果温度不合适,漆酶可能就会“闹小脾气”,不好好表现,测出来的结果就不准啦。
而且在操作过程中,每一步都要严格按照步骤来,不能马虎。
这就像搭积木,一块搭错了,可能整个城堡就不稳固了。
土壤漆酶的测定虽然有点小复杂,但只要我们认真对待,就像对待自己的小宠物一样细心,就能准确地知道土壤里漆酶的情况啦。
这样我们就能更好地了解土壤的健康状况,就像给土壤做个全面的体检一样呢。


漆酶活力及生物量的测定将取自发酵液中的样品通过滤纸进行固液分离,液体部分用于测定漆酶的活力,固体部分放入烘箱中在70℃下烘干至恒重,称量获得菌体的干重(以g/L 表示)[129]。
以酚类化合物DMP为底物测定漆酶的活力,参考Wang等人[130]的测定方法并稍做调整。
反应体系为3 mL,其中包括2.4 mL 0.1 mol/L的磷酸盐缓冲液(pH 3.5)、0.5 mL的10 mmol/L DMP及0.1 mL的酶液,反应体系在加入酶液前45℃下保温5 min,之后加入酶液在470nm 处测吸光值(ε= 49,600 M-1cm-1)。
1 个酶活力单位定义为每分钟产生 1 μmol 产物所需要的酶量。
cueo蛋白性质研究CueO具有对酚类底物的广泛氧化能力,但大多数酚类的氧化过程都无准确直接并且简单的检测手段与之对应,因此我们选择了一种氧化态能产生显着可见光吸收变化的辅助电子供体ABTS来间接标定CueO的氧化催化过程(图1.2.3.1)"ABTS全称为2,2.一azino一bis(3一ethylbenzthiazoline一6一Sulfonie acid),自身氧化过程如下式,氧化态的ABTS在420nm可产生线性光吸收"为保证每次测量之间数据的可比性和平行性,我们固定测活体系为2ml反应体系中,ABTS终浓度为2mM,所用各种pH 缓冲液终浓度100mM,所加入的各种状态的CueO蛋白终浓度均保持0.InM,并且所有反应使用相同的U一2810型双光束精密分光光度计及原装玻璃比色杯(HitaehiHigh一TechnologieS CorPoration),反应温度恒定25e"双光束检测过程中,均以97e热变性10min的同浓度CueO蛋白加入相同反应体系作为空白对照"漆酶活力测定漆酶酶活测定以I)MP为底物,参考I itthauer等人的测定方法稍做调整。


酶活力检测方法(愈创木酚法)1 酶活力定义于30℃, pH=4.5 条件下,1分钟催化氧化1umol愈创木酚所需酶量即为1个酶活力单位,以 U表示。
2 试剂和溶液2.1 愈创木酚基础反应液:2.1.1 取137.4μL愈创木酚用蒸馏水溶解,2.1.2 再称取4.5g丁二酸,2.1.3 然后用0.1mol/L的NaOH溶液调pH至4.5,最后定容至1000mL3 仪器和设备3.1 分光光度计,1cm比色皿3.2 恒温水浴 30士0.2 ℃3.3 秒表3.4 试管4 分析步骤4.1 将待测酶液稀释到吸光度值在0.2—0.8范围内4.2 取稀释后酶液0.6mL加入到试管中,再加入2.4mL愈创木酚基础反应液;4.3 将加完酶液和反应液的试管放置在30℃水浴锅中,水浴30min;4.4 水浴完毕,用分光光度计在465nm下测其吸光度5 计算酶活(U/L)=n×A×13.89,式中:A——吸光度n——稀释倍数13.89——换算系数酶活力检测方法(ABTS法)1 酶活力定义于30℃, pH=4.0 条件下,1分钟催化氧化1umolABTS所需酶量即为1个酶活力单位,以 U表示。
2 试剂和溶液2.1 ABTS溶液:0.25gABTS溶于30ml超纯水中,装于棕色试剂瓶中待用。
2.2 酒石酸钠缓冲溶液(0.1M,pH=4.0):2.3g酒石酸钠溶用超纯水溶解(用1mol/L 的丁二酸将pH调至4.0)定容至100ml容量瓶,放试剂瓶中待用3 仪器和设备3.1 分光光度计,1cm比色皿3.2 恒温水浴 30士0.2 ℃3.3 秒表3.4 试管4 分析步骤4.1 将待测酶液稀释到吸光度值在0.2—0.8范围内4.2 取酒石酸钠缓冲溶液2.85ml+ABTS溶液0.1ml+稀释后的酶液0.05ml于试管内;4.3 将加完酶液和反应液的试管放置在30℃水浴锅中,水浴30min;4.4 水浴完毕,用分光光度计在420nm下测其吸光度5 计算酶活(U/L)=n×A×55.56,式中:A——吸光度n——稀释倍数55.56——换算系数。

菌糠漆酶活性的测定:
1)新鲜的食用菌子实体,按1∶1(v/v)的比例加入0.9%的生理
盐水,匀浆.25℃振荡15分钟,5000r・min-1 离心15min,过
滤,上清液为漆酶的粗提液,冰箱保存备用。
2)取上清液以1∶1(v/v)的比例加入pH=4的柠檬酸-磷酸氢二
钠缓冲溶液(磷酸-柠檬酸缓冲液ph=4.5),充分震荡五分钟后
过滤,取滤液2mL于玻璃比色皿中,再向其加入1mL
0.5mmol·L-1的ABTS溶液(放置于冰箱中),立即放入紫外分
光光度计中,测定其在420nm波长下吸光度在一分钟内的变化
(以1mL的粗酶液和2mL的缓冲液为空白值,先设定参数,使
吸光度自动归零.)。
漆酶和ABTS作用会使溶液由无色变为蓝
绿色,定义吸光度每分钟变化0.01所需要的漆酶为一个酶活
单位(U),并按照下式计算酶活性:
3)漆酶活性(U·mL-1)=∆A
∆t×2×0.01
式中:△A为吸光度变化值;△t为测量时间,单位为min。
实验结果分析:
实验结果不理想,测定数值偏小,基本没有漆酶活性,一开始
怀疑是测定方法的问题,后用冰箱保存的漆酶溶液进行测定,发生了颜色的变化以及吸光度值的变化,所以考虑到应该为菌
糠放置时间过程,酶活性基本丧失,在测定一次菌糠中真菌的
含量(用涂布平板法),看是否存在真菌,(因为只有真菌才会产漆酶)。
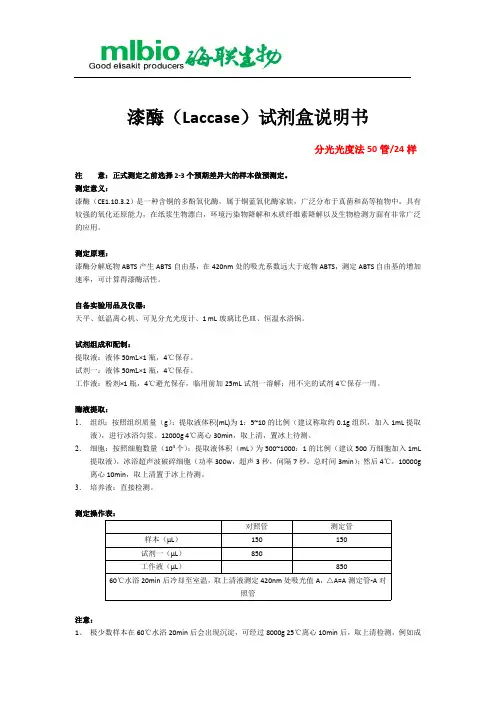
漆酶(Laccase)试剂盒说明书分光光度法50管/24样注意:正式测定之前选择2-3个预期差异大的样本做预测定。
测定意义:漆酶(CE1.10.3.2)是一种含铜的多酚氧化酶,属于铜蓝氧化酶家族,广泛分布于真菌和高等植物中,具有较强的氧化还原能力,在纸浆生物漂白,环境污染物降解和木质纤维素降解以及生物检测方面有非常广泛的应用。
测定原理:漆酶分解底物ABTS产生ABTS自由基,在420nm处的吸光系数远大于底物ABTS,测定ABTS自由基的增加速率,可计算得漆酶活性。
自备实验用品及仪器:天平、低温离心机、可见分光光度计、1 mL玻璃比色皿、恒温水浴锅。
试剂组成和配制:提取液:液体50m L×1瓶,4℃保存。
试剂一:液体50m L×1瓶,4℃保存。
工作液:粉剂×1瓶,4℃避光保存,临用前加25mL试剂一溶解;用不完的试剂4℃保存一周。
酶液提取:1.组织:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL提取液),进行冰浴匀浆。
12000g 4℃离心30min,取上清,置冰上待测。
2.细胞:按照细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细胞加入1mL 提取液),冰浴超声波破碎细胞(功率300w,超声3秒,间隔7秒,总时间3min);然后4℃,10000g 离心10min,取上清置于冰上待测。
3.培养液:直接检测。
测定操作表:对照管测定管样本(μL)150 150试剂一(μL)850工作液(μL)85060℃水浴20min后冷却至室温,取上清液测定420nm处吸光值A,△A=A测定管-A对照管注意:1、极少数样本在60℃水浴20min后会出现沉淀,可经过8000g 25℃离心10min后,取上清检测,例如成熟的水稻叶片样本。
2、 为确保检测准确性,若ΔA 大于2,将样本用提取液稀释2~10倍后重新检测,计算公式乘以相应稀释倍数。

固态发酵漆酶活性测定:酶液制取:5g发酵样品以1:20(W/V)比例用蒸馏水悬浮,200 r/min摇3h,之后5000 r/min离心20min.(上清用0、45µm滤纸过滤,于-20℃保存滤液,取能整除得滤液体积用于漆酶活性测定。
)酶活反应体系3、0mL(2、3mL 0、2mol/L醋酸-醋酸钠缓冲液;pH=4、50、5mL粗酶液稀释液;0、2mL 1mmol/L得ABTS)420nm处测定吸光值得变化。
此实验固态发酵漆酶活性计算公式:N:酶液稀释倍数V总:漆酶酶活测定反应体体系得终体积(mL)V 酶:反应添加得酶液体积(mL): t时间内反应液在420nm处吸光度得增加值△OD42036000: 420nm处ABTS氧化态得摩尔吸光系数(L/mol·cm)T:反应时间(min)L为比色皿得直径(cm)。
100mL/(0、5mL×5g):固态变成液态得稀释倍数液态发酵漆酶活性测定:酶活反应体系3、0mL(2、3mL 0、2mol/L醋酸—醋酸钠缓冲液;pH=4、50、5mL粗酶液稀释液;0、2mL 1mmol/L得ABT S)N:酶液稀释倍数:漆酶酶活测定反应体体系得终体积(mL)V总V 酶:反应添加得酶液体积(mL):t时间内反应液在420nm处吸光度得增加值△OD42036000:420nm处ABTS氧化态得摩尔吸光系数(L/mol·cm)T:反应时间(min)L为比色皿得直径(cm)。
固态发酵锰过氧化物酶(MnP)活性测定:酶液制取:粗酶液制备发酵过程中每隔2 d 取 5 g发酵物于250 mL 三角瓶中,加入100mL H2O,在200r /min 得摇床中振荡提取3 h,之后5000r/min离心20min。
(用滤纸过滤后,取滤液用于测定MnP 酶活性。
)在4mL反应体系中含50mmol/L( pH 4 ~5)得乳酸钠缓冲液3、4mL,1、6mmol/L得硫酸锰溶液0、1mL,酶液0、4 mL,预热至37℃时,加1、6mmol / L得H2O2溶液0、1mL 启动反应。
食用真菌漆酶活性检测及相关基因克隆PDA固体培养基(1L)PDA培养基配制。
将马铃薯去皮,切成1立方厘米左右小块,称取200g,加水1000mL煮沸约20min,纱布过滤去渣。
加入20g葡萄糖和15-20g琼脂,加热使之全部溶解,补充蒸馏水至1000Ml。
液体产酶培养基(1L)液体马铃薯合成培养基(PDA):马铃薯200 g·L-1,葡萄糖2O g·L-1,KH2P043g·L-1,MgSO4·7H20 1.5 g·L-1 ,VB10.1 g·L-1液体发酵培养使用打孔器分别取3片纯化且培养好的直径12mm、厚2mm的菌丝,接种到装有液体产酶培养基的150 mL的三角瓶中(一个菌种接种一个三角瓶),置于恒温培养箱中,28℃条件下静置培养。
每隔3天测定一次培养基中的漆酶活性,并记录实验数据漆酶活性的测定此次实验漆酶活性的测定使用的是愈创木酚法。
10 mL的反应体系为:1 mL 95%乙醇溶液(溶有0.04mmoL的愈创木酚)+1 mL粗酶液+8 mL琥珀酸钠缓冲液(50 mmol,PH为4.5)。
具体的实验操作如下:用1000μL的移液枪于无菌超净操作台内,分别取3 mL(1mL=1000μL)的酶液,经高速离心机(R=4500转/秒,t=10 min)离心后,分别取1 mL的上清液装入10mL的离心管内,用作实验和空白对照中的粗酶液。
第一步,将用作空白对照的装有1 mL粗酶液的离心管,放入沸水浴中2—5 min,进行酶液的灭活操作。
第二步,按照10 mL的反应体系,将乙醇溶液和琥珀酸钠缓冲液依次加入各个装有粗酶液的离心管中。
30℃条件下,恒温水浴30 min后,以灭活后的粗酶液反应混合液做空白对照,在465nm处测量各个酶液的吸光光度值(即OD值),并作好实验数据的记录。
第三步,计算漆酶活性。
漆酶活性的计算公式为:酶活(U/mL)=1.0*106*V 总*△A/(V酶*ε*△t),其中V总、V酶分别代表反应体系的总体积及反应酶液的体积,ε为吸光系数(愈创木酚的ε465=1.21×104 mol-1·L·cm-1)。
速率法测酶活性公式固态发酵漆酶活性测定:酶液制取:5g 发酵样品以1:20 (W/V)比例用蒸馏水悬浮,200 r/min摇3h,之后5000 r/min 离心20min。
(上清用0.45um滤纸过滤,于-20℃保存滤液,取能整除的滤液体积用于漆酶活性测定。
)酶活反应体系3.0mL(2.3mL 0.2mol/L醋酸–醋酸钠缓冲液;pH=4.50.5mL粗酶液稀释液;0.2mL 1mmol/L的ABTS)420nm处测定吸光值的变化。
此实验固态发酵漆酶活性计算公式:NxV ×AOD420×103100mLU(/g)='总~~ea 一×---7.a×36000×T×L0.5mLx5gN:酶液稀释倍数V豆:漆酶酶活测定反应体体系的终体积(mL)V国:反应添加的酶液体积(mL)△OD42o: t时间内反应液在420nm处吸光度的增加值36000: 420nm处ABTS氧化态的摩尔吸光系数(L/mol - cm)T:反应时间(min)L为比色皿的直径((cm)。
100mL/(O.5mL×5g):固态变成液态的稀释倍数液态发酵漆酶活性测定:酶活反应体系3.0mL(2.3mL 0.2mol/L醋酸-醋酸钠缓冲液;pH=4.50.5mL粗酶液稀释液;0.2mL 1mmol/L的ABTS)N ×Ve×AOD420×103U(/ g)= ^'总.V海×36000 ×T×LN:酶液稀释倍数V豆:漆酶酶活测定反应体体系的终体积(mL)V示:反应添加的酶液体积(mL)△OD:go: t时间内反应液在420nm处吸光度的增加值36000: 420nm处ABTS氧化态的摩尔吸光系数(L/mol - cm)T:反应时间(min)L为比色皿的直径(cm)。
漆酶活性测定方法本页仅作为文档页封面,使用时可以删除This document is for reference only-rar21year.March一、测 O法2漆酶是一种多酚氧化酶,它所催化的反应过程中有O z 的介入。
测量反应的耗氧量既可间接地推知漆酶的活性。
较早建立的瓦氏呼吸器检测法便是基于这一原理。
这一方法后来改进为利用氧电极来测量耗氧量,如弗罗纳等以愈创木酚为底物,利用氧电极测定了漆酶催化反应过程中的耗氧量,并将 1个漆酶活性单位定义为PH6 . o 及2 5 ℃条件下以愈刨木酚作为电子供体时所需要的酶量。
亦可取醌醇作底物.利用氧电极测定漆酶消耗1. 0 μmo lO2的活性。
郭明高提出了测定生漆漆酶活性的吸氧法。
即将生漆溶于甲苯,测定酶促吸氧速度和累计酶促吸氧量,同时利用碱促吸氧法测定反应前后漆酚浓度的变化,从而可以求得漆酚浓度衰减的规律及漆酶促吸氧的克分子比。
此法的特点是反应时漆酶处于其天然存l 在的状态而反应底物又恰为漆酶的天然底物漆酚,这在漆酶测活研究中尚属首倒 [ 2 1 。
漆树酶活力检测用0..1m ol·L-1磷酸盐缓冲液与有机溶剂配成一定体积的底物,其浓度为1.35×10 m ol·L-1。
分别移取3mL于1cm测量池和参比池中,恒温水浴中预热10min.注入20μL漆树酶溶液(含酶2~3 μg)于测量池中,立即搅匀,测定350nm处吸光度A随时间的变化值.漆酶比活力定义为一定温度下,单位酶量催(mg·min-1).将漆树酶在不同溶剂体系中的化反应的初速度,单位记为△A350mm比活力与漆树酶在纯水体系中的比活力相比,其比值称活力比()212 漆酶活性的定量测定方法21211 分光光度计法测定漆酶活性对苯二胺(λmax495) 、愈创木酚(λmax 485) 、邻苯二酚(λmax 400)和漆酚(λmax 420)都可用做漆酶活力测定的底物。
一、测 O法2漆酶是一种多酚氧化酶,它所催化的反应过程中有O z 的介入。
测量反应的耗氧量既可间接地推知漆酶的活性。
较早建立的瓦氏呼吸器检测法便是基于这一原理。
这一方法后来改进为利用氧电极来测量耗氧量,如弗罗纳等以愈创木酚为底物,利用氧电极测定了漆酶催化反应过程中的耗氧量,并将 1个漆酶活性单位定义为PH6 . o 及2 5 ℃条件下以愈刨木酚作为电子供体时消耗1. 0 μmo lO2所需要的酶量。
亦可取醌醇作底物.利用氧电极测定漆酶的活性。
郭明高提出了测定生漆漆酶活性的吸氧法。
即将生漆溶于甲苯,测定酶促吸氧速度和累计酶促吸氧量,同时利用碱促吸氧法测定反应前后漆酚浓度的变化,从而可以求得漆酚浓度衰减的规律及漆酶促吸氧的克分子比。
此法的特点是反应时漆酶处于其天然存l 在的状态而反应底物又恰为漆酶的天然底物漆酚,这在漆酶测活研究中尚属首倒 [ 2 1 。
漆树酶活力检测用0..1m ol·L-1磷酸盐缓冲液与有机溶剂配成一定体积的底物,其浓度为1.35×10 m ol·L-1。
分别移取3mL于1cm测量池和参比池中,恒温水浴中预热10min.注入20μL漆树酶溶液(含酶2~3 μg)于测量池中,立即搅匀,测定350nm 处吸光度A随时间的变化值.漆酶比活力定义为一定温度下,单位酶量催化反应的初速度,单位记为△A(mg·min-1).将漆树酶在不同溶剂体系中的比活力350mm与漆树酶在纯水体系中的比活力相比,其比值称活力比()212 漆酶活性的定量测定方法21211 分光光度计法测定漆酶活性对苯二胺(λmax495) 、愈创木酚(λmax 485) 、邻苯二酚(λmax 400)和漆酚(λmax 420)都可用做漆酶活力测定的底物。
不同来源(植物、细菌、昆虫、真菌)的漆酶与底物反应的亲和力不同 ,酶活性测定方法中所用的反应底物、反应条件以及酶活性单位定义对漆酶活性的测定结果有很大的影响。
肖亚中等分别以2 ,2′ 2连氮二(32乙基苯并噻唑262磺酸 ,简称ABTS) 、丁香醛连氮愈创木酚和邻联甲苯胺为底物 ,采用分光光度法测定蜜环菌( Armillaria mellea)胞外漆酶的活力 ,比较了这种底物对漆酶的敏感性 ,结果表明对于同一底物 ,反应时间、温度、缓冲液种类及其 pH值和酶的用量等条件对漆酶催化反应都有不同程度的影响。
邻联甲苯胺水溶性较差;愈创木酚为底物时反应非常稳定 ,但反应时间长、测得的漆酶活性值偏低 ,已较少采用;以丁香醛连氮为底物时 ,漆酶活性值虽然较高 ,但当底物和酶液用量较大时反应不稳定 ,若采取减少底物和酶液用量的方法 ,可较大程度地克服反应不易终止的缺陷。
目前常以 ABTS 为底物 ,测定漆酶活性 ,反应稳定、重现性好。
21212 通过检测酶与底物中间体来测定漆酶活性在酶反应开始时产物生成量很少,而酶2底物中间体生成的速率较快。
若采用初始速率法测定中间体的浓度 ,可间接测定漆酶活性 ,大大提高方法灵敏度。
用微量热法测定漆酶的活性 ,样品用量少 ,并且对酶的悬浮液体也能测定 ,适宜研究酶促反应.黄应平等利用反相胶束介质中漆酶氧化邻苯二胺(OPDA反应中间体动态吸收光谱来测定漆酶活性。
该方法由于在反相胶束介质中采用初始速率法进行测定 ,具有较高的灵敏度和选择性。
已报道的定量测定漆酶活性的方法还有 HPLC法、测氧法等。
测氧法灵敏度低,操作繁琐;HPLC法灵敏度高,但仪器昂贵;酶催化光谱分析法应用较普遍,但一般是在水相中测定产物光谱信号变化,灵敏度较低。
2 漆酶的酶活测定方法测定漆酶活性的方法有HPLC 法、测压法、分光光度法、级谱法等。
目前常以3-乙基苯并噻唑-6-磺酸(ABTS)为底物, 测定酶对其的氧化速度。
具体方法为: 反应在25 ℃下进行, 在总反应体积 3 mL 中, 含有 2 mL 溶有 0.5 mmo lABTS 的 0.1 mmo lL 醋酸缓冲液(pH = 5. 0) , 添加酶液启动反应, 在 420 nm 下测定其吸光值的变化。
酶的活力单位定义为在上述条件下(25 ℃, pH5. 0)/(mL·m in) ).1 mL 酶液每分钟氧化底物(ABTS)引起吸光值的增加量(△OD420Clemm ar J D 等以二茂铁(Fc ·H )作为底物, 在二乙二醇单丁醚(DGBE)磷酸缓冲液中, 用分光光度计在617 nm 处测定漆酶的活性 1 该法无副产物干扰, 重复性好。
望天志等采用微量热法测定了漆酶的活性 1。
对L KB-2107Batch 型微量热系统, 在温度为298.15 K, pH 为 7.4 的条件下, 测定了漆酶的催化活性。
该法的特点是用样品量少, 并且对酶的悬浮液体也能测定, 宜用于研究酶促反应。
1.4 分析方法:测定漆酶酶活方法测定漆酶酶活有以下5种方法,我们选用第一种方法来测定酶活。
1.4.1 ABTS ——分光光度计法以ABTS 为底物测定漆酶酶活是目前国外最为常见的方法之一。
它有如下优点: (1) ABTS 易溶于水,在室温下放置6 个月仍较稳定。
(2)其反应只有一步,即从ABTS 到它的阳离子自由基。
ABTS 的阳离子自由基在水溶液中呈浅蓝绿色,且比较稳定,通常在几个小时或几天之内是稳定的。
(3) 在漆酶的作用下,ABTS 有色溶液的摩尔吸光系数较高,说明以其为底物测定的灵敏度较高。
(4) 到目前为止,还未有报道称ABTS 有致癌作用、诱变作用或是强烈的毒性。
Wolfenden and Wilson 分别对5 mmol/ L ABTS加入20μmol/ L 的抗坏血酸盐的测定溶液,于不同波长进行了光谱扫描,发现纯ABTS 呈浅蓝绿色,且在415 nm 处有吸收峰;而加了抗坏血酸盐的溶液为无色,在415 nm 处无吸收峰。
ABTS 的最大吸收峰在340 nm ,ABTS的阳离子自由基的最大吸收峰在415 nm. 由此推断,在ABTS 的溶液中含有极少的ABTS 阳离子自由基,它们在更强的还原剂作用下被还原为ABTS。
以ABTS 为底物进行漆酶的定量分析,通常在420 nm 下测定3 min 内吸光度的变化。
用这种底物进行定量分析有一个缺点,即ABTS 阳离子自由基溶液的吸光度受溶液中未反应的ABTS 浓度的影响。
这就产生了一个问题:420 nm 下的摩尔吸光系数36 000 L/ (mol•cm)是在纯ABTS 阳离子自由基的条件下求得的,而在实际测定反应中,ABTS 是过量的,这就导致人们低估了酶活。
这种影响不能忽视,因为反应终止时,溶液中至少还要有1 mmol/ L的ABTS。
尽管用ABTS 为底物存在上述问题,但是它仍是漆酶酶活测定的最佳底物之一。
一般以ABTS 为底物,采用Glycine2HCl 缓冲体系、乙酸2乙酸钠缓冲体系或柠檬酸盐2磷酸盐缓冲体系。
如果菌种产生过氧化氢,为了准确测定,需加入一定量的过氧化氢酶,用以破坏过氧化氢。
因为在代谢过程中,菌体自身产生过氧化氢可激发木质素过氧化物酶与锰过氧化物酶对ABTS 的氧化。
1.4.2 丁香醛连氮——分光光度计法丁香醛连氮( Syringaladazine)也是漆酶酶活测定较为常见的底物之一。
以丁香醛连氮为底物是将其氧化为相应的醌,它的摩尔吸光系数为65 000 L/ (mol•cm)。
其摩尔吸光系数较大,可见用它定性测定漆酶的酶活具有较高的灵敏度。
采用McIlvaine 缓冲体系(pH = 5. 0) ,在525 nm 处测定吸光度的增加。
1.4.3 二茂铁——分光光度计法以二茂铁(Fe2H)为底物的反应方程式:Fe2H + e2Cu2 + e2Cu + + [ Fe 2H] +e2Cu + + 4H+ + O2=e2Cu2 + + 2H2O -[ Fe2H] 溶于水,呈蓝色,在617 nm 处出现特征吸收峰,Fe2H 不对其发生干扰。
因此,以二茂铁为底物,用分光光度法测定漆酶活性准确度较高,重复性较好。
由于二茂铁不溶于水,因此季立才等选亲水性和疏水性都较好的DGBE 作溶剂,与0. 1mol/ L 磷酸盐缓冲液以1∶5 体积比混合后,使二茂铁以一定浓度溶解,同时保持漆酶活性。
季立才等从生漆中分离、纯化漆树漆酶,并经CM2Sephadex C50 柱层析,得蓝色酶液Ⅰ、Ⅱ、Ⅲ 3个组分,以二茂铁为底物,用DGBE2磷酸盐缓冲液(pH = 8. 0) ,在617 nm 处测定吸光度的增加。
该方法无副产物干扰,简便、准确、易行。
但目前使用并不广泛,故用这种方法测定的酶活力的可比性不高。
.还有其它一些用于漆酶酶活测定的底物,无论用哪一种底物进行测定,都有其自身的优势和不足。
1.4.4 微量热法望天志采用L KB22107 Batch 型微量热系统,在温度为298. 15K,pH = 7. 4 的条件下,测定了漆酶催化氧化底物3 ,4 ,5-三羟基苯甲酸、邻苯三酚、邻甲氧基酚的活性,用磷酸二氢钠和磷酸氢二钠配制成pH = 7. 4 的缓冲液。
该法操作简单,所用样品量少,不需要光学透明的样品,对酶的悬浮液也能直接测定,对反应体系没有任何限制或干扰。
1.4.5 脉冲激光光声法阎宏涛等首次采用脉冲激光光声法测定了漆酶酶活。
试验了入射激光能量、激光照射时间和温度变化等因素对漆酶活性的影响;建立了测定漆酶的光声分析方法,检测限为3μg ,是一种高灵敏度的生物样品分析方法。
3.3.1 ABTS法测酶活3.3.1.1 主要试剂与仪器主要试剂:⑴ 1 mmol/ L ABTS溶液,ABTS 为美国Sig2ma 公司产品,精确称取0. 0274g AB TS ,用蒸馏水定容至100 mL ,置于棕色瓶备用;⑵Hac-NaAc(pH4.5)缓冲溶液,18gNaAc,9.8mlHAc,用蒸馏水定容至1L,用pH计校准其p H值。
主要仪器:⑴UV - 2100 型紫外- 可见分光光度计,UNICO 尤尼柯(上海)仪器有限公司;⑵DELTA 320型pH计,METTLER TOLEDO 梅特勒-托利多仪器(上海)有限公司。
3.3.1.2 漆酶最适p H 值的测定方法在25 ℃时,以2mLBritton2Robinson 缓冲溶液,外加 1 mL 用蒸馏水稀释104 倍的漆酶液为空白;先设定参数,使吸光度自动归零。
取 1 mL 相应pH 值的Britton2Robinson 缓冲溶液,用蒸馏水 1 mL 稀释104 倍的漆酶液,再加1 mL 的1 mmol/ L AB TS 溶液于比色皿启动反应,同时用UV - 2201 型紫外- 可见分光光度计的TIM E2COURSE 程序记录吸光度在420 nm 波长处4 min 内的时间历程,取该曲线最初部分的斜率为酶反应的速度,酶反应速度最大时对应的pH 值为漆酶的最适pH 值。