第三章催化加氢一氧化碳加氢合成甲醇
- 格式:ppt
- 大小:436.50 KB
- 文档页数:33

10万吨甲醇操作法全套第一篇合成岗位操作规程第一章工艺原理一、合成工艺原理甲醇合成是在5.0MPa压力下,在催化剂的作用下,气体中的一氧化碳、二氧化碳与氢反应生成甲醇,基本反应式为:CO+2H2=CH3OH+QCO2+3H2=CH3OH+H2O+Q在甲醇合成过程中,尚有如下副反应:2CO+4H2=(CH3)2O+H2O2CO+4H2=C2H5OH+H2O4CO+8H2=C4H9OH+3H2O此外,还有甲酸甲酯,乙酸甲酯及其它高级醇、高级烷烃类生成。
以铜为主体的铜基催化剂,对于甲醇合成具有极高的选择性,而且在不太高的压力及温度下,要求合成气的净化要彻底,否则其活性将很快丧失,它的耐热性也较差,要求维持催化剂在最佳的稳定的温度下操作。
铜基催化剂一般可在210-280℃下操作,视催化剂的型号及反应器型式不同,其最佳操作温度范围与略有不同。
管壳式反应器的最佳操作温度在230-260℃之间。
在铜基催化剂上合成甲醇,合适的操作压力是5.0~10.0MPa,对于合成气中二氧化碳较高的情况,压力的提高对提高反应速度有比较明显的效果。
合成气的成份对甲醇合成反应的影响较大,由前述反应式可见,要降低能耗,应采用适量的二氧化碳浓度的合成气,若合成气中二氧化碳含量过高,会加重精馏工序的负担并增加了能耗,但二氧化碳含量太低,会导致催化剂活性和转化率过低。
理论的合成新鲜气成份,应满足以下比值:氢碳比f=(H2-CO2)/(CO+CO2)=2.05实际操作中氢碳比应适当增大,大约在2.05~2.15之间。
空速一般控制在8000~10000h-1左右。
甲醇合成是强烈的放热反应,必须在反应过程中不断的将热量移走,反应才能正常进行,管壳式反应器利用管子与壳体间副产中压蒸汽来移走热量,这样,合成反应适宜的温度条件维持就几乎全依赖于副产品中压蒸汽压力操作的正常与稳定。
第二章工艺流程简述由压缩工序来的循环气经入塔气预热器(C0401)预热至225℃,由顶部进入管壳式等温甲醇合成塔(D0401),在铜基触媒的作用下,CO、CO2与H2反应生成甲醇和水,同时还有少量的其它有机杂质生成。
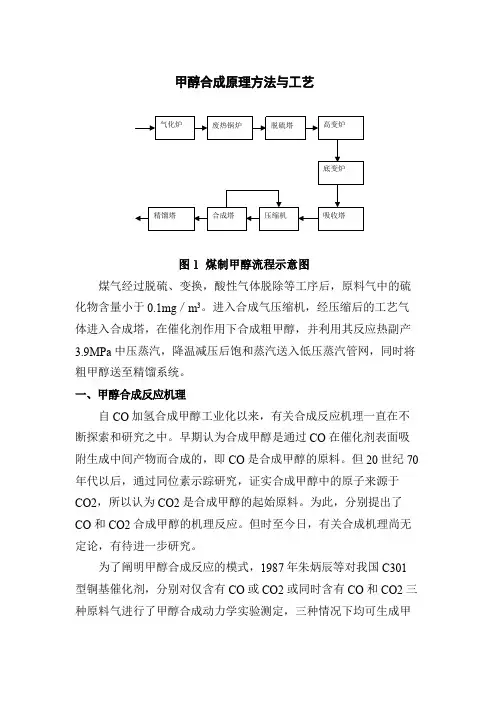
甲醇合成原理方法与工艺图1煤制甲醇流程示意图煤气经过脱硫、变换,酸性气体脱除等工序后,原料气中的硫化物含量小于0.1mg/m3。
进入合成气压缩机,经压缩后的工艺气体进入合成塔,在催化剂作用下合成粗甲醇,并利用其反应热副产3.9MPa中压蒸汽,降温减压后饱和蒸汽送入低压蒸汽管网,同时将粗甲醇送至精馏系统。
一、甲醇合成反应机理自CO加氢合成甲醇工业化以来,有关合成反应机理一直在不断探索和研究之中。
早期认为合成甲醇是通过CO在催化剂表面吸附生成中间产物而合成的,即CO是合成甲醇的原料。
但20世纪70年代以后,通过同位素示踪研究,证实合成甲醇中的原子来源于CO2,所以认为CO2是合成甲醇的起始原料。
为此,分别提出了CO和CO2合成甲醇的机理反应。
但时至今日,有关合成机理尚无定论,有待进一步研究。
为了阐明甲醇合成反应的模式,1987年朱炳辰等对我国C301型铜基催化剂,分别对仅含有CO或CO2或同时含有CO和CO2三种原料气进行了甲醇合成动力学实验测定,三种情况下均可生成甲醇,试验说明:在一定条件下,CO和CO2均可在铜基催化剂表面加氢生成甲醇。
因此基于化学吸附的CO连续加氢而生成甲醇的反应机理被人们普遍接受。
对甲醇合成而言,无论是锌铬催化剂还是铜基催化剂,其多相(非匀相)催化过程均按下列过程进行:①扩散——气体自气相扩散到气体一催化剂界面;②吸附——各种气体组分在催化剂活性表面上进行化学吸附;③表面吸附——化学吸附的气体,按照不同的动力学假说进行反应形成产物;④解析——反应产物的脱附;⑤扩散——反应产物自气体一催化剂界面扩散到气相中去。
甲醇合成反应的速率,是上述五个过程中的每一个过程进行速率的总和,但全过程的速率取决于最慢步骤的完成速率。
研究证实,过程①与⑤进行得非常迅速,过程②与④的进行速率较快,而过程③分子在催化剂活性界面的反应速率最慢,因此,整个反应过程的速率取决于表面反应的进行速率。
提高压力、升高温度均可使甲醇合成反应速率加快,但从热力学角度分析,由于CO、C02和H2合成甲醇的反应是强放热的体积缩小反应,提高压力、降低温度有利于化学平衡向生成甲醇的方向移动,同时也有利于抑制副反应的进行。

在化学反应中,一氧化碳与氢反应生成甲醇的方程式是一个重要的话题。
这个反应不仅在工业生产中有广泛应用,也在环境保护以及能源利用方面具有重要意义。
本文将从深度和广度上来探讨这个话题,以便读者深入理解这一化学反应的机理和应用。
一氧化碳与氢的反应生成甲醇的方程式是一个关于有机合成的重要反应,它的化学方程式可以用如下方式表示:CO + 2H2 → CH3OH在这个化学方程式中,一氧化碳(CO)和氢气(H2)反应生成甲醇(CH3OH)。
这个反应是通过催化剂的作用进行的,通常使用的催化剂有氧化锌和铜。
这个反应在工业上被广泛应用,因为甲醇是一种重要的有机合成原料,可以用于合成化学品、燃料和药物等。
让我们来深入了解一氧化碳与氢反应生成甲醇的化学机理。
在这个反应中,一氧化碳和氢气首先通过吸附到催化剂表面上,形成一种中间态。
这些中间态之间发生一系列的化学反应,最终生成甲醇分子。
这个反应过程涉及到许多反应中间态和过渡态,需要深入的理论和实验研究来揭示其中的化学机理。
我们来探讨一氧化碳与氢反应生成甲醇的应用。
除了工业生产中的重要应用外,这个反应也在环境保护和能源利用中具有潜在的应用。
通过控制甲醇的合成过程,可以实现一氧化碳和氢气的高效利用,减少一氧化碳的排放。
甲醇作为一种清洁燃料,在替代传统石油燃料方面具有潜在的应用价值。
在总结回顾这个话题时,我们可以看到一氧化碳与氢反应生成甲醇的方程式不仅在化学合成领域具有重要的应用,也在环境保护和能源利用方面具有潜在的应用。
通过深入理解这个化学反应的机理和应用,我们可以更好地利用这个反应来解决现实生活中的重要问题。
在个人观点和理解方面,我认为一氧化碳与氢反应生成甲醇的方程式所涉及的化学机理和应用是一个非常有趣和具有挑战性的研究领域。
通过不断深入研究和探索,我们可以更好地利用这个反应来推动化学工业的发展,并解决环境和能源方面的重要问题。
在本文中,我通过深入探讨一氧化碳与氢反应生成甲醇的方程式的化学机理和应用,希望读者能够更全面、深刻和灵活地理解这一重要的化学反应。

甲醇合成工艺过程及优化分析甲醇在化工产业中运用领域较广泛,其重要性可想而知。
要使甲醇的合成品质以及其最终的合成产量满足当代化工产业的要求,优化甲醛合成相关工艺流程操作控制已经成为一种必要性任务。
在具体的优化过程中,做到全面考虑,才能真正做到提高甲醇合成的生产效率,降低生产成本,进而促进我国在化工产业的发展。
标签:甲醇合成;工艺过程;优化分析1甲醇合成工艺过程分析要做到整体上提升化工产业中甲醇合成的效率,仅仅提高技术上的水平还是不够的,还需要整体分析甲醇合成流程并对其进行操作控制进行优化。
1.1 甲醇合成的反应机理甲醇合成反应是在催化剂作用下进行的复杂的可逆反应,由一氧化碳加氢合成甲醇CO+2H2=CH3OH(气),该反应为放热反应,从化学平衡原理分析在同一温度下,压力越大KN值越大,即甲醇平衡产率越高。
在同一压力下,温度越高KN值越小。
所以,低温高压对甲醇合成有利。
参与的催化剂一般是锌铬催化剂或者铜基催化剂,但无论是哪一个催化剂,其多相催化过程的机理都是包括扩散、吸附、表面反应、解析、扩散五个过程,即气体自气相扩散到催化剂的界面,各种气体在催化剂的活性表面进行化学吸附,吸附的反应物在活性表面上进行反应,反应产物脱附,反应产物气体自催化剂界面扩散到气相中去。
1.2 甲醇合成的流程合成气制备甲醇是我国比较常见的一种制备方式,但是合成气制备甲醇的整套工艺是非常复杂的,一整套流程下来耗时较长,实际生产过程中,选用的净化方式、以及原料的不同,相应的甲醇合成的流程也是不一样的,主要包括合成原料气、净化处理、压缩处理、合成处理、精馏粗甲醇等几个部分。
(1)合成原料气。
合成甲醇,首先是制备原料氢和碳的氧化物。
其主要由石油、煤炭、天然气等,用蒸汽转化或部分氧化加以转化,使其生成主要含氢、一氧化碳、二氧化碳的混合气体。
甲醇合成气要求(H2-CO2)/(CO+CO2)=2.1左右。
(2)甲醇的合成。
根据不同的催化剂,在不同的压力下,温度为240~270℃或360~400℃,通过催化剂进行合成反应,生成甲醇。


甲醇反应方程式全文共四篇示例,供读者参考第一篇示例:甲醇,又称甲基醇,是一种简单的有机化合物,化学式为CH3OH。
它是一种无色、易燃、具有刺鼻气味的液体,在工业生产中被广泛应用。
甲醇的反应方程式是研究这种化合物性质和制备其他有机化合物的重要基础。
在本文中,我们将探讨甲醇的常见反应方程式以及反应过程中的化学变化。
让我们来看一下甲醇的制备过程。
甲醇可由一氧化碳和氢气在催化剂的作用下反应制得。
该反应的化学方程式如下:CO + 2H2 → CH3OH这是一个重要的合成反应,被用于大规模生产甲醇。
以氧化铜和锌为催化剂,经过适当的温度和压力条件,可以高效地将一氧化碳和氢气转化为甲醇。
接下来,我们来探讨一下甲醇的一些常见反应方程式。
首先是甲醇的氧化反应,其方程式如下:这是一种燃烧反应,当甲醇与氧气反应时,会释放大量的热量,生成二氧化碳和水。
这使得甲醇成为一种重要的燃料和燃料添加剂。
甲醇还可以与一些酸反应,生成相应的甲酸。
甲醇和硫酸反应的方程式如下:这是一种酸醇反应,将甲醇与硫酸加热后会生成甲酸和水。
甲酸在工业上也有广泛的应用,用于染料、医药和合成化工等领域。
甲醇还可以通过加热分解、氧化反应以及与其他化合物的反应形成多种有机产物。
在化工生产和实验室研究中,甲醇的性质和反应方程式被广泛用于制备其他有机化合物,推动有机合成化学的发展。
第二篇示例:甲醇的生产一般通过甲烷(CH4)和水蒸气的催化裂解反应来实现。
这个反应过程基本上是气相反应,通过在催化剂的作用下,将甲烷和水蒸气转化为一系列有机和无机产物,其中最重要的产物之一就是甲醇。
甲烷与水蒸气在一定条件下经过催化剂的催化作用,发生一系列反应,得到甲醇的产物。
甲醇的反应方程式如下所示:CH4 + H2O → CO + 3H2CO + 2H2 → CH3OH在这两个反应中,第一个反应是甲烷和水蒸气之间的催化裂解反应,生成一氧化碳(CO)和氢气(H2)。
而在第二个反应中,一氧化碳和氢气再经过一系列反应,最终生成甲醇(CH3OH)。

第一章第一节1.什么叫烃类热裂解过程的一次反应和二次反应?答:一次反应:由原料烃类经热裂解生成乙烯和丙烯的反应。
二次反应:主要是指一次反应生成的乙烯,丙烯等低级烯烃进一步发生反应生成多种产物,甚至最后生成焦或碳2.简述一次裂解反应的规律性。
答:1) 同碳原子数的烷烃,C-H键能大于C-C键能,故断链比脱氢容易。
2) 碳链越长的烃分子越容易断链。
3) 烷烃的脱氢能力与分子结构有关。
叔氢最易脱去,仲氢次之,伯氢又次之。
4) 有支链的烃容易断链或脱氢。
3.烃类热裂解的一次反应主要有哪几个?烃类热裂解的二次反应主要有哪几个?答:一次反应有:1) 烃热裂解:脱氢反应、断链反应2) 环烷烃热裂解:开环反应3) 芳香烃热裂解:脱氢缩合反应、断侧链反应4) 烯烃热裂解:断链反应、脱氢反应二次反应主要有:1) 烯烃的裂解(即二次反应—断链)2) 烯烃的聚合、环化、缩合与生焦反应3) 烯烃的脱氢和加氢反应4) 烃分解生碳4. 什么叫焦,什么叫碳?结焦与生碳的区别有哪些?答:有机物在惰性介质中经高温裂解,释放出氢或其它小分子化合物生成碳,并非独个碳原子,而是以若干碳原子稠合形式的碳,称为生碳。
若产物中尚含有少量氢,碳含量约为95%以上,称为结焦。
结焦是在较低温度下﹙<1200K﹚通过芳烃缩合而成,生碳是在较高温度下﹙>1200K﹚通过生成乙炔的中间阶段,脱氢为稠和的碳原子。
5. 试述烃类热裂解的反应机理。
答:热裂解的自由基反应机理:C2H6→C2H4+H26. 什么叫一级反应?写出一级反应动力学方程式和以转化率表示的动力学方程式。
答:一级反应:反应速度与浓度的一次方成正比一级反应动力学方程式:r=-dc/dt=kc以转化率表示的动力学方程式:㏑[β/(1-α)]=ktβ—体积增大率,它随转化深度而β=裂解气体积(标准态)/原料气体积(标准态)第一章第二节1. 烃类裂解有什么特点?答:1) 高温(反应温度高,一般为800℃以上,最高快可达900℃以上)2) 强吸热反应3) 短停留时间4) 低烃分压2. 裂解供热方式有哪两种?答:直接供热和间接供热。

合成气制甲醇原理合成气制甲醇是一种重要的化工过程,其原理基于将一种叫做合成气的混合气体转化为甲醇。
合成气主要由一氧化碳和氢气组成,它们可以通过多种方法制备,如煤气化、天然气重整等。
合成气制甲醇的原理涉及两个主要反应:水气变换反应和甲醇合成反应。
首先,合成气进入水气变换反应器,反应器中通常使用铁基或铜基催化剂。
在水气变换反应中,一氧化碳和水蒸气发生反应生成一氧化碳和二氧化碳的平衡反应。
这个反应的目的是将一氧化碳和水蒸气转化为二氧化碳和氢气,以提供后续反应所需的氢源。
水气变换反应后,氢气和一氧化碳的比例被调整为适合甲醇合成反应的比例。
接下来,合成气进入甲醇合成反应器,反应器中使用铜基催化剂。
在甲醇合成反应中,一氧化碳和二氧化碳与氢气发生反应生成甲醇。
这个反应是一个复杂的过程,涉及多个中间产物和反应路径。
然而,在合适的温度和压力条件下,合成气中的一氧化碳和二氧化碳会与氢气通过甲醇合成催化剂的作用生成甲醇。
合成气制甲醇的反应条件对于反应的选择性和产率非常重要。
一般来说,较高的温度和压力有利于提高甲醇的选择性和产率。
然而,温度和压力也会影响催化剂的稳定性和寿命。
因此,需要在选择反应条件时找到一个平衡点。
催化剂的选择也对合成气制甲醇的效果有很大影响。
铜基催化剂是目前最常用的催化剂,但也有其他催化剂的研究,如铁基催化剂、锌基催化剂等。
这些不同的催化剂具有不同的反应活性和选择性,可以在一定程度上调控反应的产率和选择性。
在合成气制甲醇过程中,还需要考虑反应器的设计和操作。
反应器的设计应该满足高转化率、高选择性和高产率的要求。
反应器的操作条件也需要精确控制,以确保反应的稳定性和安全性。
总的来说,合成气制甲醇是一种基于合成气的重要化工过程。
其原理基于将合成气转化为甲醇的反应,经过水气变换反应和甲醇合成反应,最终得到甲醇产品。
反应条件、催化剂的选择以及反应器的设计和操作都对反应的效果有重要影响。
随着技术的不断进步,合成气制甲醇过程将会得到进一步的优化和改进,以满足社会对清洁能源和可持续发展的需求。

化学工艺学课后答案【篇一:化学工艺学复习题及答案】、氧化还原、加氢-醇、酸、脂和芳烃等:①经转化先制成合成气,或含氢很高的合成氨原料气,然后进分氧化制乙炔;③直接制造化工产品,如制造炭黑、氢氰酸、各。
c3、c4和中等大小的分子居多②异构化、芳构化、环烷化,使裂解产物中异,使催化汽油中容易聚合的二烯烃类大为减少④聚合、缩合反应.-气化-液化;热解-气化-发电;气化-合成-燃料;液化-燃料-气化;液化-加氢气化、丁二烯和r-ch2-ch3←→r-ch=ch2+h2;断链反应:r-ch2-ch2-r’→ r-ch2=ch2+r’hc-h键能大于c-c键能,固断链比脱氢容易②烷烃的相对稳定性随碳c-h键或c-c键,较直链的键能小⑤低分子烷烃的c-c键在c4以上烯烃、单环芳烃h缩合反应。
芳烃的一次反应中,芳烃经脱氢缩合转化为稠环芳成单烯烃的反应;芳烃:无烷基的芳烃基本上不易裂解为烯烃,有烷基的芳烃,主要是烷基发生断和脱氢反应,芳环不开裂,可脱氢缩合为多环芳烃,芳烃直至转化为焦。
烯烃加氢转化为烷烃,脱氢变为二烯烃或炔烃;芳烃经脱氢缩合转化为稠环芳烃进一步转化为焦;烷烃会进一步裂解成低级烷烃,——pona值;适于表征石脑油、轻柴油等轻质馏分油;烷烃(paraffin)烯烃(olefin)环烷烃(naphthene);芳烃(aromatics) ;72.3、16.3、11,大庆石脑油则为53、43、425左右,:750-900℃,原料分子量越小,所需裂解温度越高,乙烷生成,所得裂解汽油的收率相对较低,使炔烃收率明显增加.③压力对裂解反应的影响,从化学平衡角度分析(压力只对脱氢反应有影响)对一次反应:,结论:低压有利于乙烯的生产.18题。
-101℃(高压法),使乙炔以上烷烃和烯烃冷凝为液体,与甲烷和氢气分开,c4馏分分开,从而得到聚合级高纯乙烯和聚合级高纯丙烯。
(lummus)按c1、c3加氢→丙烯塔→脱丁烷。
②前脱乙烷流程(linde法);压缩→脱乙烷→加氢→脱甲烷→乙烯塔→脱丙烷→丙烯塔→脱丁烷③前脱丙烷流程(三菱油化法),压缩→脱丙烷→脱丁烷→压缩→加氢→脱甲c4烃较多的裂解:急冷锅炉废热锅炉,用换热器h2s、co2)、少量水分、炔烃、酸性气体:不仅会腐蚀设备和管路,而且还会是脱炔催化剂中毒;水分和co2在低温下结冰,堵塞管路;乙炔和丙乙炔的存在不仅使高纯乙醇和丙烯聚合时采用的催化剂中毒,而且还会在系统里自聚,生成液体产物绿油。

一氧化碳加氢制甲醇的催化剂研究1. 引言1.1 背景介绍传统的一氧化碳加氢制甲醇的催化剂主要是铜基催化剂,但铜基催化剂在高温下易发生结晶变化,导致活性降低。
寻找新型高效稳定的催化剂对提高一氧化碳加氢制甲醇的效率和产率至关重要。
本研究旨在探究不同类型催化剂在一氧化碳加氢制甲醇反应中的作用机制,并通过优化催化剂的设计和活性组分以及表面结构的特征分析,提高催化剂的稳定性和活性,从而为提高一氧化碳加氢制甲醇的产率和效率提供理论基础和技术支撑。
1.2 研究意义一氧化碳加氢制甲醇是一种重要的工业化学反应,能够实现二氧化碳的高效利用和可持续发展。
随着社会经济的快速发展,能源需求不断增加,化石燃料的消耗导致了二氧化碳排放的持续增加,加剧了全球变暖和环境污染。
寻找一种绿色、高效的方法将二氧化碳转化为有价值的化学品是至关重要的。
研究一氧化碳加氢制甲醇的催化剂不仅可以实现对二氧化碳的转化利用,还可以降低对传统石油资源的依赖。
通过研究催化剂的设计和优化,可以提高反应的选择性和产率,降低反应条件下的能耗和成本。
深入研究一氧化碳加氢制甲醇的催化剂具有重要的科学意义和工程应用前景。
通过对一氧化碳加氢制甲醇的催化剂研究,不仅可以解决能源和环境问题,还可以促进化学工业的可持续发展,对社会和经济具有重要的意义。
1.3 研究目的研究目的是为了寻找高效的催化剂,提高一氧化碳加氢制甲醇的反应活性和选择性。
通过系统研究不同催化剂对反应的影响,探索合适的催化剂设计和优化方法,以达到在较低温度和压力下制备高纯度甲醇的目的。
研究还旨在了解催化剂表面结构对反应性能的影响,从而为进一步优化催化剂设计提供理论依据和实验方向。
通过本研究,希望能为甲醇制备工艺的发展和催化剂设计提供新的思路和方法,促进相关领域的科学研究和工业应用。
2. 正文2.1 一氧化碳加氢制甲醇的反应机理分析一氧化碳加氢制甲醇是一种重要的工业化学反应,其反应机理的研究对于催化剂的设计和优化至关重要。

化⼯⼯艺学习题《化⼯⼯艺学》习题有机部分:第⼀章1 什么叫做烃类热裂解?2.烃类热裂解过程中可能发⽣哪些化学反应?⼤致可得到哪些产物?3.利⽤标准⾃由焓计算裂解反应C2H6C2H4+H2在2980K、1000K下进⾏反应的平衡常数Kp和平衡转化率X(裂解反应按常压处理)。
(1000K 时,标准⾃由焓:H2:0.00 kj/mol,C2H6:109.22 kj/molC2H4:118.09 kj/mol)4.试述⼄烷裂解反应的机理及其主要步骤?5 ⽤热⼒学和动⼒学综合分析说明裂解反应在⾼温、短停留时间、低烃分压下进⾏的必要性?6.试述裂解深度的含义、表⽰⽅法。
7.烃类裂解的原料主要有哪些?选择原料应考虑哪些⽅⾯?8.裂解过程中⼀次反应和⼆次反应的含义是什么?为什么要尽⼒促进⼀次反应⽽抑制⼆次反应?9.裂解⽣产中为什么不采⽤抽真空办法降低系统总压?10.裂解过程中为什么要加⼊⽔蒸汽?它还起到了哪些作⽤?11.裂解⽓为什么要急冷?急冷有哪些⽅法?各⾃的优缺点是什么?12.在管式裂解炉中为什么会结焦?结焦对⽣产操作有什么影响?13.鲁姆斯裂解⼯艺流程主要包括哪些部分?各部分的主要作⽤是什么?第⼆章1.芳烃的来源有哪些?2.简述芳烃的转化反应有哪些?芳烃的转化反应的催化剂主要有哪些?3.⽤热⼒学和动⼒学分析说明苯和⼄烯烷基化反应的温度为什么控制在95℃左右?4.苯和⼄烯烷基化的⽓液相反应器有哪些要求?为什么选⽤⿎泡床反应器?5.了解芳烃的转化反应的机理。
6.⼄苯⽣产对原料有何要求?为什么?7.简述⼄苯⽣产的⼯艺流程。
第三章1.催化加氢反应有哪⼏种类型?⼯业上有哪些重要应⽤?2.反应温度和压⼒对加氢反应有什么影响?3.⼯业上应⽤的加氢催化剂有哪些类型?4.通过合成甲醇的热⼒学分析说明了什么问题?第四章1.氧化反应有何特点?2.了解催化⾃氧化的机理及催化剂?3.影响催化⾃氧化过程的影响因素有哪些?4.⿎泡床反应器有何特点?5.均相催化氧化有何特点?6.论述⼄烯液相氧化⽣产⼄醛的反应原理及⼯艺。
甲醇的生产方法和毒性信息生产方法.工业上合成甲醇几乎全部采用一氧化碳加压催化加氢的方法,工艺过程包括造气、合成净化、甲醇合成和粗甲醇精馏等工序;(粗甲醇的净化过程包括精馏和化学处理。
化学处理主要用碱破坏在精馏过程中难以分离的杂质,并调节pH;精馏主要是脱除易挥发组分如二甲醚,以及难挥发组分职乙醇、高碳醇和水。
粗馏后的纯度一般都可达到98%以上。
).将工业甲醇用精馏的方法将含水量降到0.01%以下。
再用次碘酸钠处理,可除去其中的丙酮。
经精馏得纯品甲醇;.一般均以工业甲醇为原料,经常压蒸馏除去水分,控制塔顶64~65℃,过滤除去不溶物即可;.还可从木材干馏时得到的焦木酸分出;.甲醇的制备主要采用精馏工艺。
以工业甲醇为原料,经精馏、超净过滤、超净分装,得高纯甲醇产品。
毒性信息医用甲醇甲醇对人体有强烈毒性,因为甲醇在人体新陈代谢中会氧化成比甲醇毒性更强的甲醛和甲酸(蚁酸),因此饮用含有甲醇的酒可引致失明、肝病、甚至死亡。
误饮4毫升以上就会出现中毒症状,超过10毫升即可因对视神经的永久破坏而导致失明,30毫升已能导致死亡。
初期中毒症状包括心跳加速、腹痛、上吐(呕)、下泻、无胃口、头痛、晕、全身无力。
严重者会神智不清、呼吸急速至衰竭。
失明是它最典型的症状,甲醇进入血液后,会使组织酸性变强产生酸中毒,导致肾衰竭。
最严重者是死亡。
然而,仍然有不少不法商人不顾人命安全,用含有甲醇的工业酒精勾兑假酒并出售。
但是,正品酒中也有极微量的甲醇,是宿醉的原因之一。
甲醇中毒可以用乙醇解毒。
因为甲醇在肝脏中被酒精脱氢酶氧化成甲醛,然后是甲酸。
乙醇可以和甲醇竞争醇脱氢酶,使人体有时间排除甲醇。
第一章概述甲醇的用途及在化学工业中的地位甲醇俗称“木精”,是重要的有机化工产品,也是重要的有机化工原料,其分子式为CHOH,是碳化工的基础;甲醇产品除少量直接用于溶剂,抗凝剂和燃料外,绝大多数被用于3生产甲醛,农药,纤维,医药,涂料等;长期以来,人们一直把甲醇作为农药、染料、医药等工业的原料;随着科学技术的不断发展与进步,突破了甲醇只作传统原料的范围,甲醇的应用领域不断地被开发出来,广度与深度正在发生深刻变化;随着甲醛等下游产品的不断开发,甲醇在化学工业中的作用必将越来越重要1;甲醇市场的状况及建厂的可行性近几十年来,由于传统加工工业的发展和世界能源结构的变化,以甲醇为原料的新产品的不断开发,世界对甲醇的生产和需求量都大幅增加,表是世界甲醇市场状况,表是国内甲醇市场状况;表世界甲醇生产能力及消耗量及开工率Table World methyl alcohol productivity and consumption, utilization of capacity 年度1987 1991 1993 1995 2000 2020 生产能力万T/年1999 2300 2470 2600 5000 20000总消耗量万T/年1718 2010 2141 2390开工率 % 86 87 92表国内甲醇生产能力及消耗量Table Domestic methyl alcohol productivity and consumption年度1985 1987 1990 1994 1995 2000 生产能力万T/年69生产量万T/年100消耗量120 200 根据预测,世界范围内的生产与需求将持续发展,主要原因是:甲醇下游产品市场的扩大、甲醇作为燃料的使用将大大增加2;甲醇的性质1.3.1一般性状甲醇蒸汽在空气中的浓度随温度的升高而迅速增大;空气中甲醇蒸汽的最高允许浓度为L;甲醇具有明显的麻醉性,甲醇对呼吸道和粘膜有强烈的刺激作用,流经皮肤也能使人发生中毒迹象3;常温常压下,甲醇是易挥发,易燃的无色液体,具有类似酒精的气味;甲醇能与水任意比混溶,但不能形成共沸物,故可用分馏的方法分离甲醇和水;甲醇是良好的有机溶剂,能溶解多种树脂,但不能溶解脂肪;甲醇蒸汽能与空气形成爆炸性混合物,爆炸极限为~%V,燃烧时为蓝色火焰;甲醇比水轻,有很强的毒性,误饮能导致眼睛失明,甚至死亡;1.3.2甲醇的物理性质①甲醇的物理常数如下表所示表甲醇的物理常数Table Thephysicsdateofmethanol项目数值项目数值沸点64.5℃~64.7℃膨胀系数1/℃凝固点-97℃~-97.8℃表面张力0.00221kg/m20 ℃自燃点473℃~461℃蒸汽压力-44℃相对密度20℃-20℃闪点12℃~16℃0℃粘度液体:20℃气体:65℃10℃ 64.5℃折光系数20 ℃100℃ ②甲醇的热力学常数如下表所示表甲醇的热力学常数Table Thethermo-dynamice date of methanol1.3.3甲醇的化学性质甲醇不具酸性,也不具碱性,对酚酞和石蕊试液均呈中性;分子式CH3OH,分子量;项目数值项目数值临界压力蒸发潜热kg 临界温度240℃液体热容-25℃燃烧热mol25℃气体热容kg77℃①氧化反应完全氧化:CH3OH+23O2→CO2+2H2O+mol不完全氧化:CH3OH+21O2→HCHO+H2O+159kJ/mol②脱氢反应CH3OH→HCHO+mol ③与有机酸反应CH3OH+CH3COOH→CH3COOCH3+H2O④与无机酸反应CH3OH+HCl→CH3Cl+H2OCH3OH+H2SO4→CH3SO2OH+H2O⑤与氨反应生成甲胺CH3OH+NH3→CH3NH2+H2O+mol2CH3OH+NH3→CH32NH+2H2O+mol3CH3OH+NH3→CH33N+3H2O+mol⑥与苯作用生成甲苯CH3OH+C6H6→C6H5CH3+H2O⑦与CO 作用生成醋酸CH3OH+CO→CH3COOH⑧与乙炔作用CH3OH+C2H2→CH3OCHCH2⑨与金属Na作用2CH3OH+2Na→2CH3ONa+H2⑩与苯胺作用,生成二甲基苯胺2CH3OH+C6H5NH2→C6H5NCH32+2H2O甲醇发展历史1661年英国玻义耳BoyIe首次从木材干馏的液体产品中发现了甲醇,木材干馏成了制取甲醇最古老的方法,至今甲醇仍称木醇或木精;1834年,杜马Dumas和彼利哥Peligot 制得甲醇纯品;1857年法国贝特洛Berthelot用一氯甲烷为原料水解制得甲醇;化学合成法生产甲醇开始于1923年;德国巴登苯胺纯碱BASF公司首先建成了一套以为原料、年产300吨的高压法甲醇合成装置,在全世界开拓乐意合成气作为一种CO和H2工业合成原料的生产史;从20世纪20年代到60年代中期,世界各国甲醇合成装置都用高压法,采用锌铬催化剂;合成甲醇的原料路线在几十年中经历了很大变化;20世纪50年代前,甲醇生产多以煤和焦炭为原料,采用固定床气化的方法生产水煤气作为甲醇原料气;50年代以来,天然气和石油资源大量开采,由于天然气便于输送,适合于加压操作,可降低甲醇装置的投资与成本,在蒸汽转化技术发展的基础上,以煤为原料的甲醇生产流程被广泛采用,至今仍为甲醇生产的最主要原料;估计今后在相当长一段时间中,国外的甲醇仍以烃类原料为主;从发展趋势来看,今后以煤炭为原料生产甲醇的比例会上升,这是因为从世界能源结构分析,固体燃料的贮藏量远多于液体与气体,而煤又不能直接用作汽车、柴油机的燃料,必须通过加工为甲醇才能成为汽车、柴油机燃料;煤制甲醇作为液体燃料颇具吸引力,将成为其主要用途之一;由煤生成甲醇被称为煤的间接液化,是煤炭利用的重要方向;生产中的醇/氮比;90年代,上海焦化厂三联供工程中年产20万吨低压甲醇装置的建设和一些省市年产3~10万吨低压甲醇装置的建设,以及许多中、小氮肥厂联醇装且的投产,使我国甲醇生产跃上新的台阶;目前我国有甲醇生产企业200多家,主要集中在几个较大的生产企业,其产能均在10万吨/年左右;2005年1~11月,我国甲醇产量已达到万吨,同比增长%;进口量为万吨,同比增长%,出口量万吨,同比增长%;1~11月国内甲醇表观消费量已达到万吨,同比增长%;照此增长速度,预计全年甲醇产量有望达到570万吨,表观消费量将达到620万吨左右,产量和表观消费量仍呈稳步增加的趋势1;甲醇的生产方法合成甲醇1.5.1由CO和H2在加热压力下,在催化剂作用下合成甲醇;其中包括高压法340~用CO和H2420℃,30~50MPa,用Zn-Cr催化剂;中压法235~275℃,5MPa左右,用Cu-Zn-Al催化剂;低压法220~280℃,5MPa左右,用Cu-Zn-Cr催化剂及联醇220~270℃,10~13MPa;1.5.2其他合成方法①甲烷直接氧化法:在催化剂作用下发生,2CH4+O2→2CH3OH②液化石油气氧化法③煤气氧化法甲醇生产技术的发展趋势近年来,国外甲醇生产技术发展有以下几个趋向:原料路线多样化、生产规模大型化、合成压力从高压转为低压、多采用铜基催化剂、节能降耗,充分利用余热,降低能耗、过程控制自动、联合生产普遍化1第二章低压鲁奇法制甲醇的原理方法及流程反应方程式合成工段,5MPa下铜基催化剂作用下发生一系列反应主反应: CO+2H2→CH3OH+kmol副反应: 2CO+4H2→CH32O+H2O+kmolCO+3H2→CH4+ H2O+kmol4CO+8H2→C4H9OH+3H2O+kmolCO+H2→CO+kmol除副反应中第三个外,副反应的发生,都增大了CO的消耗量,降低了产率,故应尽量减少副反应;合成法反应机理本反应采用铜基催化剂,5MPa,250℃左右反应,清华大学高森泉,朱起明等认为其机理为吸附理论,反应模式为:H2+2e˙→2H˙CO+H→HCO˙HCO˙+H˙→H2CO˙˙H 2CO˙˙+2H˙→CH3OH+3e˙CH3OH˙→ CH3OH+ e˙前两个反应为控制,即吸附控制;由一氧化碳加氢合成甲醇,是一个可逆反应CO+2H2=CH3OH气反应物中有二氧化碳存在时,亦可发生下列反应CO2+3H2= CH3OH+H2O反应热效应:一氧化碳加氢合成甲醇是放热反应,在25℃时反应热△HT=h 常压下不同温度的反应热可按下式进行计算:△HT =+××10-6T3其中△HT—常压下合成甲醇的反应热,J/molT—开氏温度,K由上式计算得到不同温度下的反应表温度与焓值表Table and enthalpy value tables温度 K 298 573 473 573 673 773△H T97平衡常数由一氧化碳加氢合成甲醇的平衡常数Kf 与标准自由焓△θG T关系如下表示:K f =fCH3OH/ fco×fH22 =exp-△θG T/RT其中:△θG T-----标准自由焓T-----反应温度f----- 逸度由上式可以看出平衡常数Kf 只是温度的函数,当反应温度一定时,可以由△θG T值直接求出Kf 值;不同温度的△θG T与K f 值如下表:表温度的△θG T与K f 值表Table Temperatures △θG T and K f value table温度K △θG T J/mol K f温度K △θG T J/mol K f273 -29917 527450 623 51906 ×10-5373 -7367 673 63958 ×10-5473 16166 ×10-3 723 75967 ×10-6523 27925 ×10-2 773 88002 ×10-6573 39892 ×10-4结论:由上表中可以看出,随着温度的升高,自由焓△θG T增大,平衡常数变小,就说明在低温下反应对甲醇合成有用;由一氧化碳加氢合成甲醇,是一个可逆反应CO+2H2=CH3OH气对反应有KP =PCH3OH/PCO×PH22式中PCH3OH、PCO、PH2分别是CH3OH、CO及H2的分压 KN=NCH3OH/NCO×N H22,式中N CH3OH 、N CO 及N H 分别是CH 3OH 、CO 及H 2的摩尔分率 K Y =Y CH3OH /Y CO ×Y H2 ,式中Y CH3OH 、Y CO 及Y H2分别为CH 3OH 、CO 及H 2的逸度;表甲醇合成反应的平衡常数表Table Methyl alcohol building-up reactions balanced chart从表中可以看出不同温度下的平衡常数值,以及不同压力下的K P 和 K N 值,由表中K N 数据可以看出在同一温度下,压力越大K N 值越大,即甲醇平衡产率越高;在同一压力下,温度越高K N 值越小;所以从热力学观点来看,低温高压对甲醇合成有利;若反应温度高,则必须采用高压,才能有足够大的K N 值;降低反应温度,则所需的压力就可相应的降低;但是实际上还要考虑催化剂的活性温度及耐受程度6;铜基催化剂CuO 、ZnO 、Al 2O 3的组合铜基催化剂大多数采用共沉淀法制备,使用需进行还原,使用温度在280℃左右;温度过高会造成其失活;因此使用中应防止温度过大的波动;目前,国内有C-207系,C-301系和CNJ-202系;国外有英国的51-1型,前苏联的CHM-1型和BASF 等;资料显示,每吨催化剂约能生产500~600吨粗甲醇,催化剂成本中,催化剂占5~7%8;温度℃MPaY CH3OH Y CO Y H2 K f K Y K P K N 200×10-2×10-2×10-2×10-2×10-226 97 234 300×10-4×10-4×10-4×10-4×10-4 400×10-5×10-5 ×10-5×10-5×10-52.3.1造气工段 ①对甲醇原料气的要求 合理的氢碳比例要求f=H 2—CO 2/CO+CO 2=~用半水煤气为原料,氢过量,需要补加CO 2以适应以上要求;经脱硫、变换后,尚含有相当量的二氧化碳,CO CO 2之比太高,气体组成不符合=+-222CO CO CO H ~;甲醇合成的要求,而且经变换后,COS 、CS 2等有机硫转化为H 2S,也需在送往甲醇合成工序前预以清除;因此在甲醇生产总流程中必须设置脱除二氧化碳同时也可脱除残余硫化氢的工序,简称脱碳工序;合理的CO 和CO 2比例合成甲醇原料气中应保持一定量的CO 2,能促进铜基催化剂上甲醇合成的反应速率,使用铜基催化剂时原料气中CO 2应大于5%;CO/CO 2>2摩尔比,使放热减少,从而保持铜基催化剂,延长其寿命;原料气对毒物与杂质的要求原料气需净化,除去油,水,尘粒,羰基铁,氯化物,硫化物;其中主要是硫化物的危害较大,其危害大致有造成催化剂中毒、造成管道设备的羰基腐蚀、造成粗甲醇质量下降等,Lurgi 法要求原料气中硫的含量小于10;②造气的工艺流程普遍采用加压操作,同时水蒸气过量,以提高甲烷的转化率,反应温度为 800℃,压力2~3MPa,水/碳摩尔比为 ~;③原料气的净化以煤为原料制甲醇,原料气的净化实际就是一个脱硫的问题,脱硫的方法很多,本设计采用钴钼催化加氢和ZnO 吸收串联脱硫;钴钼催化加氢就是使有机硫化物转变为可被吸收的H 2S ;ZnO 吸收脱硫的实质为: H 2S+ZnO →ZnS+H 2O2.3.2甲醇合成工段 ①甲醇的合成合成工序配置:经过净化的原料气,经预热加压,于5Mpa 、220℃下,从上到下进入Lurgi 反应器,在铜基催化剂的作用下发生反应,出口温度为250℃左右,甲醇7%左右,因此,原料气必须循环,则合成工序配置原则为图;粗甲醇驰放气图合成合序配置原则The Figure Syntheses gathers the foreword disposition principle②甲醇的分离甲醇在高压下容易冷凝,基于这个原理,甲醇的分离采用冷凝分离法,高压下与液相甲醇呈平衡的气相甲醇含量随温度降低,压力增加而下降,表为不同温度下气相甲醇的饱和含量11;表 5MPa下不同温度气相甲醇的饱和含量%Table 5MPa different temperature gas phase methyl alcohol saturated content%T ℃0 10 20 30Y %由表可见,通过水冷水冷后气体温度为30℃左右,可以使气相甲醇含量下降到%5MPa,补充新鲜气后可使这一值下降到%以下,故分离甲醇只要水冷已足够,不需要氨冷,水冷后设分离器,并定期将冷凝下来的甲醇排入粗甲醇贮槽;③气体的循环气体在合成系统内的循环是依靠联合压缩机提供动力以克服流动阻力;④新鲜气的补充和惰性气的排放新鲜气在粗甲醇分离后补充,一般在联合压缩机出口处加入;在合成过程中,未反应的惰性气体累集在系统中,需要进行排放,该气体一般在压缩机前,甲醇分离器后排放6;图甲醇合成的工艺流程Figure Methyl alcohol synthesis technical process1.透平压缩机2.热交换器3.锅炉水预热器4.水冷却器5.甲醇合成塔6.汽包7.甲醇分离器8.粗甲醇贮槽这个流程是德国Lurgi公司开发的甲醇合成工艺,流程采用管壳式反应器,催化剂装在管内,反应热由管间沸腾水放走,并副产高压蒸汽,甲醇合成原料在离心式透平压缩机内加压到以1:5的比例混合循环,混合气体在进反应器前先与反应后气体换热,升温到220℃左右,然后进入管壳式反应器反应,反应热传给壳程中的水,产生的蒸汽进入汽包,出塔气温度约为250℃,含甲醇7%左右,经过换热冷却到40℃,冷凝的粗甲醇经分离器分离;分离粗甲醇后的气体适当放空,控制系统中的惰性气体含量;这部分空气作为燃料,大部分气体进入透平压缩机加压返回合成塔,合成塔副产的蒸汽及外部补充的高压蒸汽一起进入过热器加热到50℃,带动透平压缩机,透平后的低压蒸汽作为甲醇精馏工段所需热源13;第三章 甲醇合成生产工艺计算工艺计算作为化工工艺设计,工艺管道,设备的选择及生产管理,工艺条件选择的主要依据,对平衡原料,产品质量,选择最佳工艺条件,确定操作控制指标,合理利用生产的废料,废气,废热都有重要作用;3.1甲醇合成工艺流程概要合成系统是甲醇厂的核心车间,因为上游的很多工序一长串流程制取的新鲜合成气都是为合成反应要求而配备的,合成技术的变化必然影响全局;若在合成不能充分利用制取甲醇,不论是在物料和能量上都是巨大的损失;合成系统的设备和管路都是在高压下操作,为了安全,防漏,防爆, 对设备的设计和制造,以及生产操作都有很高的要求12;3.1.1甲醇合成流程主线因CO 、H 2 、CO 2在合成塔内反应不能达到平衡且单程转化率很低,出塔气体有大量为未反应的CO 、H 2 、CO 2,甲醇必须分离出系统才可以继续参与循环反应;甲醇合成流程主线方框图如下所示:图甲醇合成流程主线方框图合成分离循环机粗甲醇循环气新鲜气弛放气Figure Methyl alcohol synthesis flow master line block diagram 从图中可以看出主要合成工艺主要是合成,分离,及循环气压缩,三大核心过程组成,更进一步的过程都是在此基础上附加的反应辅助及维持系统的稳定而配备的,例如出塔气换热分离弛放气排放等过程组成;再进一步精细的过程即在此系统附加的仪表监控管道配制等;甲醇合成流程有很多种,但是最基本的步骤单元过程是共同具备的;3.1.2 原则流程简介新鲜气进入新鲜气压缩机,循环气进入循环气压缩机,生至所需压力,两股气体混合后进入塔外换热器与出合成塔的气体进行换热,换热至所需的压力进入甲醇合成塔进行反应,出塔的气体经换热后进入水冷却器,降至醇分所需的温度,并在醇分器中分离出粗甲醇,未反应的气体再次经过排放部分弛放气后,再次进入循环气压缩机增压后再次进行循环操作;由此可见:①甲醇合成流程采用的是循环流程,即分离出产品,未反应的气体再次参与反应,这一点与其他流程不同;②合成系统主要由两部分组成,即甲醇的合成与甲醇分离,前者在合成塔中完成,后者在一系列的传热与汽液分离设备中完成;③合成气流经过设备时,必有阻力,存在压降,使其压力逐渐降低,要其循环必须设循环压缩机升压;3.1.3流程探讨分析①采用循环流程的原因由于平衡和速率的限制,甲醇合成单程转化率很低,约4﹪ ~ 7﹪导致未反应的原料气较多;对甲醇合成而言较好的办法是,分离出甲醇后把未反应的气体返回合成塔重新利用;循环流程之所以必要是有“合成率低”与要求“原料气利用高”二者之间的矛盾是共同决定的;②关于新鲜气补入的位置最有利的位置是在合成塔的进口处,而不宜在合成塔出口或甲醇分离之前,以免甲醇分压降低,减少甲醇收率;循环机放在合成塔之前是最有利的因为在整个循环中,循环机出口压力最大,压力高对合成反应有利;③关于弛放气排放的位置采用循环流程的一个必然结果是惰性气体在系统中的积累;为了维持系统稳定必须排放部分弛放气,因为惰性气体不参与反应 但积累在系统中会降低有效合成气的分压,降低了甲醇合成速率,为此应该设放空管线,防空时应避免尽可能减少有效成分的损失,因此放空位置应选择循环中惰性气体浓度最大的地方,即醇分后应该是合适的9;甲醇生产的物料平衡计算已知 新鲜气中惰性气体含量8%出塔气中惰性气体含量%不含粗甲醇入塔气组分:CO CO 2 H 2 惰性气体% 3% % %粗醇组分摩尔百分比: 甲醇 二甲醚 丁醇 水分 93% % % % 设入塔气2n =100kmol合成塔中:副反应 4CO+8H 2→CH 32CHCH 2OH +3H 2O 2CO+4H 2→CH 32O+H 2O 主反应 CO+2H 2→CH 3OH CO 2+3H 2→CH 3OH+H 2O 以惰性成分为基准:解得 3n =设生成的甲醇为p n kmol,则粗甲醇中其他组分为: 异丁醇CH 32CHCH 2OH二甲醚CH 32O 水份H 2OCO 2生成的水份=p n p n p n p n 生成的甲醇=p n CO 生成的甲醇=p n对进出合成塔的各气体组分列物料平衡方程:则有100×%=3CO x +p n +4×p n +2×p n ①100×3%=23co x +p n ②23H 10061.7%=92.27x 80.003440.008620.9630.044np np np np ⨯+⨯+⨯+⨯+⨯③2233co 3123.3%H CO x xx ++=-④联立①、②、③、④解得p n =,3CO x =%,23co x =%,23H x =%甲醇产量3万吨/年,以8000小时计,则甲醇时产量为h 则入塔气量 V 2=100×3750/32×/=1033463/Nm h 出塔气量 V 3=×V 2=953573/Nm h 令V 1为新鲜气,V 4为循环气以惰性成分为基准:103346×﹪=﹪×V 4 + V 1 ×8﹪ ⑤ 以总物料为基准:103346= V 4 + V 1 ⑥ 联立⑤、⑥,解得 V 1=120823/Nm h V 4=912643/Nm h 驰放气、循环气组分与出塔气的相同,则有: 驰放气V 5=V 3-V 4=95357-91264=40933/Nm h103346×﹪= 91264×﹪+120823CO x ⑦103346×3﹪= 91264×﹪+1208221CO x ⑧103346×﹪= 91264×﹪+ 1208221H x ⑨联立解得:21H x =64%,21CO x =%,3CO x =%水煤气净化过程中,惰性组分流量不变,即V 0惰=V 1惰=V 1×8﹪=9673/Nm h 水煤气 V 0=967/﹪=125303/Nm h V 0 H2S =12530×﹪=3/Nm h 变换反应方程式:CO+H 2O →CO 2+H 2脱碳反应方程式:K 2CO 3+CO 2+H 2O →2KHCO 3 脱碳反应掉的CO2 V co 2脱==3/Nm h0CO V 3129=773220H V ①20CO V +7732-20H V = ② 2210.2%7.72%co co H x x x ++=-- ③12530×20H x = 20H V ④ 12530×0co x =0CO V ⑤ 12530×20co x =20CO V ⑥联立①、②、③、④、⑤、⑥,解得20H V =133103/Nm h 0CO V =47823/Nm h 20CO V =10993/Nm h 20H x =% 0co x =% 20co x =%年产3万吨甲醇物料平衡结果如下表年产3万吨甲醇物料平衡表Table Yearly produces 30,000 ton methyl alcohol balance sheet of materials物料单位组分合计COCO 2 H 2 惰性成分H 2S 水煤气V%100 Nm 3/h96712530 新鲜气V%64 8 100 Nm 3/h12082入塔气V% 3 100Nm3/h 103346 出塔气V% 100Nm3/h 95357 循环气V% 100Nm3/h 91264 驰放气V% 100Nm3/h 4093甲醇h甲醇的能量平衡计算已知:合成塔入塔气为220℃,出塔气为250℃,热损失以5%计,壳层走4MPa的沸水;查化工工艺设计手册得13,4MPa下水的气化潜热为kg,即kg,密度799.0kg/m3,水蒸气密度为19.18kg/m3,温度为250℃;入塔气热容见;表 5MPa,220℃下入塔气除CH3OH热容Table 5MPa,220℃ under enters the tower gas to eliminate CH3OH heat capacity组分流量:Nm3比热:kJ/kmol℃热量:kJ/℃COCO2H2N2ArCH4合计查得220℃时甲醇的焓值为kmol,流量为;所以:Q入=⨯4.2257.1537+⨯==kJ出塔气热容除CH3OH见表表 5MPa,220℃下出塔气除CH3OH热容Table 5MPa,220℃ under tower gas eliminate CH3OH heat capacity 组分流量:Nm3比热:kJ/kmol℃热量:kJ/℃COCO2H2N2ArCH4CH32O合计查得250℃时甲醇的焓值为kmol,流量为 Nm3所以:Q出=⨯4.229.19766+⨯= kJ由反应式得:Q反应=4.2233.18229⨯+4.2262.25⨯+4.22568.211⨯+4.2220204⨯+4.221.2116⨯⨯1000=+++⨯ kJQ热损失=Q入+Q出⨯5%= ⨯5%= kJ所以:壳程热水带走热量Q传= Q入+Q反应-Q出-Q热损失=+= kJ又:Q传=G热水r热水所以:G热水=99.171408.37462156=21843.8 kg/h即时产蒸气:18.198.21843=1138.88 m3第四章主要设备的选型设备是化工工艺运作的载体,选择合适的设备,对于提高生产率,降低原料,能量的消耗有着重要的作用;甲醇合成塔甲醇合成塔是合成甲醇最重要的核心设备,合成工序的“心脏”设备,它的设计好坏直接决定了合成的工艺水平;甲醇合成塔的内件的形式有很多种,在很长一段时间内甲醇合成塔和氨合成塔是共用的;因为二者在反应放热形式是一样的,只是甲醇合成放热量比合成氨大,温度的控制较为不易;下图是典型的三套管甲醇合成塔基本的构成:由简体、催化剂支承装置、换热构件和气体分布器等组成;甲醇合成反应是强放热过程,反应温度较高,可用高压、中压和低压不同的工艺;由于工艺及反应热的移出方法不同,有不同形式的合成塔1;图甲醇合成塔10Figure methyl alcohol synthetic tower1-催化剂 2-筒体 3-冷却管 4-换热器 5-分布器 6-环隙按冷却方法分为直接冷却的冷激式和间接冷却的冷管式及列管式合成塔;冷激式合成塔内部无换热构件,其反应床层分为若干绝热段,两段之间加入冷的原料气使反应气体直接冷却;冷管式合成塔的内部有换热构件,并把双套管置于催化剂层内,由原料气通过管壁间接带走反应热;列管式合成塔的结构类似管壳式换热器,反应热由管外的锅炉给水带走,同时产生高压蒸汽;不管何种类形式的合成塔内件,它的核心是催化剂框,它的设计好坏直接影响了合成塔的产量和消耗定额1;一个好的合成塔内件催化床的设计应有如下的要求:①能有效的移走反应热,合理的控制催化剂床层的温度分布,使其逼近最佳操作温度线,提高醇净值和催化剂的使用寿命②能保证气体均匀地通过催化剂层,阻力小,气体的处理量较大;③充分的利用高压空间,尽可能多装催化剂,提高容积利用系数;④操作稳定灵活,调节方便,能使用各种操作条件的变化;⑤能保证催化剂在升温,还原过程中操作正常,还原充分,尽可能提高催化反应的活性,达到最大的生产强度;⑥结构简单,运转可靠,装卸催化剂方便;甲醇合成塔的形式有很多种,有ICI四段冷激式,Lurgi 型管壳副产蒸汽式,托普索全径向合成塔,国内亦有多种合成塔,GC型轴径冷激式,Lindar均温型合成塔等1;出塔气冷凝器出塔气中含甲醇%加其它未反应气体,通过冷凝器可使出塔气中大部分甲醇和其它产物冷凝下来,以利分离,一般有喷淋式和壳管式,由设计采用管壳式冷凝器15;甲醇分离器甲醇分离器的作用是将经过冷凝器冷凝下来的液体甲醇和未反应气体进行气液分离,分离出的甲醇在液面控制下在分离器底部减压送粗甲醇贮槽;粗甲醇贮槽贮槽的工作压力为,液体以5MPa减压后,溶于粗甲醇中的气体释放出来,以贮罐气的形式在压力控制下经气体排出口排出,贮槽液体出口管上装有液体控制装置;压缩机压缩机的任务是把合成塔来反应的气体送回甲醇合成塔,其动力由高压蒸汽透平提供.结论甲醇合成工艺,流程采用管壳式反应器,催化剂装在管内,反应热由管间沸腾水放走,并副产高压蒸汽,甲醇合成原料在离心式透平压缩机内加压到以1:5的比例混合循环,混合气体在进反应器前先与反应后气体换热,升温到220℃左右,然后进入管壳式反应器反应,反应热传给壳程中的水,产生的蒸汽进入汽包,出塔气温度约为 250 ℃,含甲醇7%左右,经过换热冷却到40℃,冷凝的粗甲醇经分离器分离;分离粗甲醇后的气体适当放空,控制系统中的惰性气体含量;整个设计所采用的低压法Lurgi甲醇合成技术不仅先进而且成熟,投资和操作费用低,操作简便;通过对年产三万吨甲醇整个合成工段的物料衡算、能量衡算;依据所得的计算结果可以对整个合成工段的主要设备进行选型,以确定最后的设备型号,为更好的完成生产任务创造了条件;。