端粒和端粒酶的发现历程
- 格式:docx
- 大小:300.53 KB
- 文档页数:11

端粒和端粒酶的发现及其生物学意义端粒和端粒酶是细胞生物学中一个重要的发现,它们的存在对于细胞的生命活动和分裂有着至关重要的作用。
本文将介绍端粒和端粒酶的发现过程,以及它们在细胞生物学中的重要作用。
一、端粒的发现1940年代初期,生物学家Hermann Muller发现了X射线可以导致果蝇基因突变,从而引发了对DNA的研究。
在此之后,科学家们开始研究DNA的结构和功能,他们发现DNA是由四种碱基组成的,即腺嘌呤(A)、胸腺嘧啶(T)、鸟嘌呤(G)和胞嘧啶(C)。
然而,随着研究的深入,科学家们发现,在DNA的两端存在着一种特殊的序列,这种序列被称为端粒。
端粒是由一种叫做“重复序列”的DNA组成的,这种DNA序列在不同物种之间有所不同,但它们都具有重复的结构。
在人类中,端粒由TTAGGG序列组成,这个序列在人类基因组中重复了数千次。
二、端粒酶的发现在研究端粒的过程中,科学家们发现,端粒在细胞分裂过程中会逐渐缩短,当端粒缩短到一定程度时,细胞就会停止分裂。
这个现象被称为“Hayflick极限”,它是由于DNA的缩短导致的。
然而,当科学家们研究端粒的缩短机制时,他们发现,端粒缩短的速度并不是恒定的,而是与一种叫做“端粒酶”的酶密切相关。
端粒酶是一种由蛋白质和RNA组成的复合物,它能够将端粒的缩短速度减缓,从而延长细胞的寿命。
端粒酶能够在细胞分裂过程中向DNA的末端添加一些新的端粒序列,从而防止端粒的缩短。
三、端粒和端粒酶的生物学意义端粒和端粒酶的发现对于细胞生物学的研究有着重要的意义。
首先,它们的存在解释了为什么细胞会随着时间的推移而老化。
由于端粒的缩短和端粒酶的缺失,细胞分裂的次数受到了限制,从而导致细胞的寿命变短。
其次,端粒和端粒酶的研究还有助于理解癌症的发生。
癌症细胞具有无限制的增殖能力,这是由于它们能够通过某些机制维持端粒的长度,从而避免了端粒缩短所导致的细胞停止分裂的现象。
此外,端粒和端粒酶的研究还有助于开发抗衰老和抗癌的药物。

端粒、端粒酶与细胞寿命早在1938年,Muller便发现了端粒(T elomere),然而对端粒的深入研究却开始于20世纪70年代后期。
端粒酶(T elomerase)是1985年由Blackbun实验室在四膜虫细胞核提取物中首先发现并纯化,随后在尖毛虫(Oxytricah)、游仆虫(Euplotes)及人的Hela细胞等细胞中被证实。
有关研究表明,端粒、端粒酶与细胞寿命直接相关,端粒酶的激活和表达程度与肿瘤的发生和转移也有十分密切的关系。
一、端粒端粒是存在于真核生物线性染色体末端,由串联重复的短的dsDNA序列及其相关的蛋白所组成的DNA蛋白复合体。
dsDNA中的一条为富G链,以5′→3′指向染色体末端,比另一条互补链长8个~12个碱基,这是端粒DNA分子的结构特征,是端粒酶识别工作的基础。
端粒既有高度的保守性;如原生动物、真菌、植物、动物序列都很相似;又有种属特异性,如四膜虫重复序列为GGGGTT,草履虫为TTGGGG,人和哺乳动物为TTAGGG,等等。
端粒的功能除保证DNA完整复制外,还在维持染色体结构稳定(保护染色体不分解和染色体重排及末端不相互融合等),染色体在细胞中的定位(使之不随机分布)和引起细胞衰老等方面起着重要作用。
众所周知,真核DNA是线性DNA,复制时由于模板DNA起始端为RNA引物先占据,新生链随之延伸;引物RNA脱落后,其空缺处的模板DNA无法再度复制成双链。
因此,每复制一次,末端DNA 就缩短若干个端粒重复序列,即出现真核细胞分裂中的“末端复制问题”。
当端粒缩短到一定程度时即引起细胞衰老,故端粒又称“细胞分裂计时器”。
二、端粒酶端粒酶是一种逆转录酶,是一种由蛋白质和RNA构成的核糖核蛋白体。
其RNA成分中含有与端粒DNA富G链互补的部分,起着合成模板的作用。
端粒酶具有对端粒的延伸作用,在没有端粒酶的细胞中,端粒会逐渐缩短直至损害基因;有端粒酶存在的细胞,则该酶会不断补充新的端粒,使之处于一种不断伸缩的动态平衡中。


端粒和端粒酶的发现历程廖新化引言2009年诺贝尔生理学或医学奖授予了UCSF(加州大学旧金山分校)的Elizabeth Blackburn (简称Liz),Johns Hopkins University(约翰霍普金斯大学)的Carol Greider(简称Carol),以及Howard Medical School(哈佛医学院)的Jack Szostak。
诺贝尔奖主页上介绍她/他们获奖的原因是揭示了“how chromosomes are protected by telomeres and the enzyme telomerase”(染色体是如何被端粒和端粒酶保护的)。
端粒和端粒酶的研究进程中贯穿着“发现现象/问题”-“提出概念/模型”-“实验验证”的思路,整个过程就像相继解开一个个puzzle(智力谜团)一样有趣,充满了思想的光辉。
重现这个思路对科学工作者是有启发意义的。
本文也提供了一个很好的科学问题推演的教学案例。
染色体末端的两个难题以及端粒的概念20世纪70年代初,对DNA聚合酶特性的深入了解引申出了一个染色体的复制问题。
DNA 聚合酶在复制DNA的时候必须要有引物来起始,而且它的酶活性具有方向性,只能沿着DNA5’到3’的方向合成。
染色体复制之初可以由小RNA作为引物起始合成,之后细胞的修复机器启动,DNA聚合酶能够以反链DNA为模板,以之前合成的DNA为引物,合成新的DNA取代染色体中间的RNA引物。
但是线性染色体最末端的RNA引物因为没有另外的引物起始,没有办法被DNA取代。
所以线性染色体DNA每复制一轮,RNA引物降解后末端都将缩短一个RNA引物的长度(图1,简化的示意图,实际上染色体的DNA双链末端不会是平的)。
尽管这个引物不长,但是细胞千千万万代地不断复制,如果不进行补偿,染色体不断缩短,最终就会消失。
James Watson(因为发现DNA双螺旋结构获得诺奖)最早就明确指出了这个“末端隐缩问题”,并猜想染色体也许可以通过在复制前联体(染色体末端跟末端连起来)的方式来解决末端复制的问题[1]。

资料1解读诺贝尔医学奖:什么是端粒和端粒酶近日,诺贝尔基金会宣布,将2009年诺贝尔生理学或医学奖授予因发现端粒和端粒酶如何保护染色体的三位学者。
什么是端粒和端粒酶呢?端粒是真核生物染色体线性DNA分子末端的结构。
形态学上,染色体DNA末端膨大成粒状,像两顶帽子那样盖在染色体两端,因而得名。
在某些情况下,染色体可以断裂,这时,染色体断端之间会发生融合,或者断端被酶降解。
但正常染色体不会整体地互相融合,也不会在末端出现遗传信息的丢失(被降解之类)。
可见端粒在维持染色体和DNA复制的完整性有重要作用。
真核生物双螺旋DNA双链复制时,会有一小段DNA引物连接在复制的起始部位,在合成酶的作用下,在引物后依次连接上A、T、C、G(脱氧核苷),形成新的DNA链。
复制完成后,最早出现的起始端引物会被降解,留下的空隙没法填补,这样细胞染色体DNA将面临复制一次就缩短一些的问题。
这种缩短的情况在某些低等生物的特殊生活条件下可以观察到,但却是特例。
事实上,染色体虽经多次复制,却不会越来越短。
早期的研究者们曾假定有一种过渡性的环状结构来帮助染色体末端复制的完成,但后来却一直未能证实这种环状结构的存在。
20世纪80年代中期,科学家们发现了端粒酶。
当DNA复制终止时,端粒酶的作用下,通过端粒的依赖模版的复制,可以补偿由去除引物引起的末端缩短,因此在端粒的保持过程中,端粒酶至关重要。
随着细胞分裂次数的增加,端粒的长度是在逐渐缩短的,当端粒变得不能再短时,细胞不再分裂,而会死亡。
并且发现,体细胞端粒长度大大短于生殖细胞,胚胎细胞的端粒也长于成年细胞。
科学家发现,至少可以认为在细胞水平的老化,和端粒酶的活性下降有关。
因此,有人希望能把端粒酶注入衰老细胞中,延长端粒长度,使细胞年轻化,或者是给老人注射类似端粒酶的制剂,延长老者的端粒长度,达到返老还童的目的。
但生物整体的老化,是一个非常复杂的问题,端粒的长度只是决定衰老的一个因素,因此端粒酶抗衰老,目前只具理论价值,连动物实验都很少,更别说应用于人了。

端粒酶的发现引言1990年代初,科学家们发现了一个被称为端粒酶的重要酶类。
端粒酶在染色体末端的保护中扮演着至关重要的角色。
本文将介绍端粒酶的发现过程以及对生命科学领域的重要意义。
端粒酶的发现历程1.端粒酶的初步研究端粒酶的存在最早可以追溯到上世纪60年代,当时研究人员注意到在细菌中有一种酶能够将DNA的末端连接起来。
这项研究启发了科学家们对细胞中类似功能酶的寻找。
2.端粒酶在真核生物中的发现在20世纪80年代,研究人员开始研究类似的酶是否存在于真核生物中。
通过一系列实验,他们成功地从酵母中分离出一种能够在DNA末端合成端粒的酶,这就是后来被称为端粒酶的酶。
这项重要发现为进一步研究端粒酶的功能奠定了基础。
3.端粒酶的结构研究在端粒酶的发现后不久,科学家们开始对其结构进行研究。
通过X射线结晶学等手段,研究人员解析了端粒酶的结构,发现它由多个亚基组成,并具有复杂的空间构型。
4.端粒酶的功能研究随着对端粒酶的结构认识的加深,科学家们开始研究端粒酶的功能。
他们发现,端粒酶能够在每一次细胞分裂中保护染色体的末端,并防止其在重复分裂中逐渐缩短。
这使得细胞能够维持较长的染色体长度,从而延长了细胞的寿命。
端粒酶的意义和应用1.端粒酶在衰老和癌症中的作用人体细胞在不断分裂和复制的过程中,染色体的末端会逐渐缩短。
当染色体末端变得过短时,会出现衰老和疾病的现象。
而端粒酶的发现为研究和治疗衰老和癌症提供了新的方向。
2.端粒酶在药物开发中的应用研究端粒酶的功能和作用机制,有助于科学家们寻找新的药物开发靶点。
一些药物已经在实验中被发现能够调节端粒酶的活性,对于癌症等疾病的治疗具有潜在的疗效。
3.端粒酶在基因编辑中的应用近年来兴起的基因编辑技术如CRISPR-Cas9,也借鉴了端粒酶的原理。
科学家们通过引入端粒酶的功能模块,使得基因编辑技术能够更精确地定位到染色体的末端,增加编辑效率和准确性。
结论端粒酶的发现为我们对细胞和遗传学的理解提供了重要的突破。

研究论文H A I X I A K E X U E年第3期(总第3期)3海峡科学染色体的保护者—端粒与端粒酶福建教育学院理科研修部郑俊敏[摘要]端粒是位于染色体末端、能保护染色体不被降解的特殊结构。
端粒酶则是能合成端粒D N A 的酶,使得端粒的长度和结构得以稳定。
端粒和端粒酶的发现推动了科学家对人类衰老和肿瘤发生机制的研究,有助于相关疾病的预防和治疗。
文章对端粒和端粒酶的发现过程、其主要结构和功能、以及与相关疾病的预防和治疗作了简要介绍。
[关键词]端粒端粒酶结构功能2009年10月5日,瑞典皇家科学院将诺贝尔生理学或医学奖授予了3位美国科学家:伊丽莎白布莱克本(Elizabeth H.Blackburn ),卡萝尔格雷德(Carol W.Greider )和杰克绍斯塔克(Jack W.Sz ostak )。
诺贝尔奖主页上介绍他们获奖的原因是揭示了“染色体是如何被端粒和端粒酶保护的”。
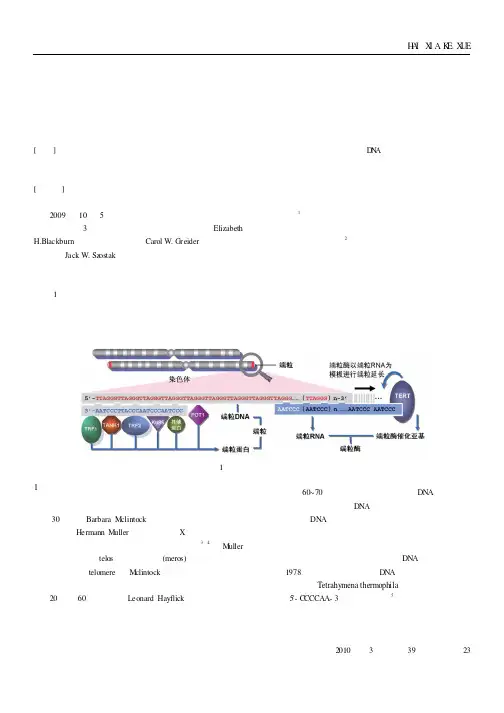
端粒是一种在染色体末端部分的一个帽子样的特殊结构(图1),其主要作用是使染色体不被降解。
端粒酶则是帮助端粒合成的分子,它维持着端粒的长度和结构的稳定,从而保护染色体。
绝大多数成体细胞缺乏端粒酶,导致端粒保护染色体的功能逐渐丧失,这被认为是决定细胞寿命的一个重要因素〔1〕。
而在一些细胞中,如胚胎干细胞和癌细胞,端粒酶的活性高度表达,使得这些细胞不断分裂却不会遭受染色体损伤,延迟了衰老〔2〕。
同时,一些遗传病也是由于端粒酶活性的缺失而导致的。
正是由于这三位科学家开创性的工作,向人们揭开了端粒和端粒的神秘面纱,并了解了它们与人体衰老和许多疾病的关系。
而整个端粒和端粒酶的研究进程就像相继解开一个个智力谜团一样有趣,充满了思想的光辉。
重现这个思路对广大教师和学生都是有启发意义的。
本文也提供了一个很好的科学问题推演的教学案例。
图1端粒及其基本结构1端粒和端粒酶的发现染色体末端对于染色体稳定性的重要作用,最早是在上世纪30年代,Barbara M clintock (因为发现玉米的转座子获得诺奖)和Hermann M uller (因为发明用X 射线突变基因而获得诺奖)在对玉米和果蝇的研究中提出来的〔3,4〕。


端粒与端粒酶及作用机理的应用周梓耘(生物技术 10102117)内容摘要:端粒是线状染色体末端的DNA重复序列,是真核染色体两臂末端有特定的DNA重复序列构成的结构,使正常染色体端部间不发生融合,在不同物种细胞中对于保持染色体稳定性和细胞活性有重要作用。
端粒酶是负责端粒延长的一种酶,可将端粒DNA加至真核细胞染色体末端。
对端粒和端粒酶的研究还加深了人们对衰老和癌症等重大生物医学问题的理解,也为人们寻找和设计药物或手段来延缓衰老和治疗疾病提供了契机。
激活其活性,增加细胞分裂次数,从而延缓衰老;抑制其活性,减少至抑制细胞分裂,从而治疗癌症。
关键词:端粒;端粒酶;衰老;癌症一、端粒1、什么是端粒:端粒是真核细胞染色体末端由特定的DNA重复序列构成的特殊结构,位于线性染色体末端。
端粒DNA包括非特异性DNA和由高度重复序列组成的特异DNA序列。
通常是由富含鸟嘌呤核苷酸的短的串联重复序列组成,伸展到染色体的3'端。
由于复制机制的不完整性,正常细胞线性DNA复制时5'末端消失,故细胞每分裂一次约丢失一个冈崎片断长度的DNA,即25-100对碱基,因此端粒会以一定的速度丢失。
随着体细胞不断增殖,端粒逐渐缩短,当端粒缩至一定程度时,细胞停止分裂,处于静止状态。
因此,严重缩短的端粒是细胞老化的信号。
故有人称端粒为正常细胞的“分裂钟”,端粒长短和稳定性决定了细胞寿命,并与细胞衰老和癌变密切相关。
2、端粒的发现:二十世纪三十年代,Barbava McClintock和Hermann J.Muller发现,染色体的末端有一种能稳定染色体结构和功能的特殊成分。
如果缺少了这种成分,染色体之间就会互相粘连、出现结构的变化或其它错误的行为,以致影响到染色体的生存和正确复制,并进一步威胁到细胞的存亡。
于是从希腊文的"末端"(telos)和"部分"(meros)二词为这种特殊的成分创造了一个全新的术语"端粒"(telomere)。

端粒和端粒酶09级食品科学与工程郭晓敏学号:170112009012一、端粒(一)端粒的发现1938年两位卓越的遗传学家Mc.Clintock和Muller分别以玉米、果蝇为材料发现经过各种途径损伤后所断裂的染色体很不稳定,容易降解,断口具有“粘性”,彼此之间很容易相互粘连而造成染色体易位、倒位、缺失、双着丝点等类型的染色体畸变。
而染色体的天然末段似乎从不与其它断口连接,也不彼此连接,这是因为染色体天然末端有类似“帽子”的结构,虽不含功能基因,但具有维持染色体稳定性的功能。
据此,Muller提出了“端粒”(telomere)这个术语。
(二)端粒的结构端粒( telomere) 是保护真核细胞染色体末端并维持其完整的特殊的DNA/蛋白质复合物,它像“帽子”一样扣在染色体的两端。
1.端粒DM的结构端粒DNA由两条长短不同的DNA链构成,一条富含G,另一条富含C。
富含G的那条链5’一3’指向染色体末端,此链比富含c的链在其3’末端尾处可多出12~16个核苷酸的长度,即3’悬挂链,一定条件下能形成一个大的具有规律性很高的鸟嘌呤四联体结构,此结构是通过单链之间或单链内对应的G残基之间形成H00gsteen碱基配对,从而使4段富含G的链旋聚成一段的四链体DNA。
也有人认为,端粒G链序列可以形成稳定的发卡结构,它和四联体结构都被认为与端粒DNA的保护功能有关.2. 端粒结合蛋白的结构端粒结合蛋白包括端粒酶、保卫蛋白复合体( sheherin) 和非保卫蛋白。
保卫蛋白复合体由端粒重复序列结合因子l(TRFl),端粒重复序列结合因子(TRF2)。
端粒保卫蛋白1( P0rrl),TRFl相互作用核蛋白(TIN2),TIN2相互作用蛋白l(TINTl )及阻抑和活化蛋白1趣印1)组成,各分布在染色体端粒上,能保持端粒结构的相对稳定。
非保卫蛋白有DNA修复蛋白RADSO,NBSl ,胍E11,Ku86和DNAPKcs等,各分布不局限在端粒上。
端粒和端粒酶的发现历程端粒和端粒酶的发现历程廖新化引言2009年诺贝尔生理学或医学奖授予了UCSF(加州大学旧金山分校)的Elizabeth Blackburn (简称Liz),Johns Hopkins University(约翰霍普金斯大学)的Carol Greider(简称Carol),以及Howard Medical School(哈佛医学院)的Jack Szostak。
诺贝尔奖主页上介绍她/他们获奖的原因是揭示了“how chromosomes are protected by telomeres and the enzyme telomerase”(染色体是如何被端粒和端粒酶保护的)。
端粒和端粒酶的研究进程中贯穿着“发现现象/问题”-“提出概念/模型”-“实验验证”的思路,整个过程就像相继解开一个个puzzle(智力谜团)一样有趣,充满了思想的光辉。
重现这个思路对科学工作者是有启发意义的。
本文也提供了一个很好的科学问题推演的教学案例。
染色体末端的两个难题以及端粒的概念20世纪70年代初,对DNA聚合酶特性的深入了解引申出了一个染色体的复制问题。
DNA聚合酶在复制DNA的时候必须要有引物来起始,而且它的酶活性具有方向性,只能沿着DNA5’到3’的方向合成。
染色体复制之初可以由小RNA作为引物起始合成,之后细胞的修复机器启动,DNA聚合酶能够以反链DNA为模板,以之前合成的DNA为引物,合成新的DNA取代染色体中间的RNA引物。
但是线性染色体最末端的RNA引物因为没有另外的引物起始,没有办法被DNA 取代。
所以线性染色体DNA每复制一轮,RNA引物降解后末端都将缩短一个RNA引物的长度(图1,简化的示意图,实际上染色体的DNA双链末端不会是平的)。
尽管这个引物不长,但是细胞千千万万代地不断复制,如果不进行补偿,染色体不断缩短,最终就会消失。
James Watson(因为发现DNA双螺旋结构获得诺奖)最早就明确指出了这个“末端隐缩问题”,并猜想染色体也许可以通过在复制前联体(染色体末端跟末端连起来)的方式来解决末端复制的问题[1]。
端粒酶组成端粒酶,也称为端粒末端转移酶,是一种能够维持染色体稳定性的酶类物质。
它在细胞分裂过程中起着重要的作用,可以防止染色体末端的损耗和退化。
本文将从端粒酶的发现历程、结构和功能、与衰老和癌症的关系等方面进行介绍。
一、端粒酶的发现历程端粒酶的发现可以追溯到20世纪60年代,当时科学家在研究原核细胞的DNA复制机制时,发现线虫中染色体末端有一种特殊的序列重复出现,这些重复序列被称为端粒。
随后的研究揭示了端粒与染色体的稳定性之间的关系,并发现了一种能够在端粒上添加DNA序列的酶,即端粒酶。
二、端粒酶的结构和功能端粒酶主要由两部分组成:一个蛋白质亚基和一个RNA亚基。
蛋白质亚基负责酶的催化活性,而RNA亚基则是酶的模板,用于合成端粒DNA序列。
端粒酶的主要功能是在每次细胞分裂时,通过添加端粒DNA序列来延长染色体的末端,从而保护染色体不受损伤和退化。
三、端粒酶与衰老的关系随着细胞的分裂,端粒的长度会逐渐缩短,当端粒长度达到一定程度时,细胞进入衰老状态。
这是因为端粒长度的缩短会导致染色体末端的损耗,从而触发细胞凋亡或进入细胞周期停滞。
研究表明,端粒酶可以延长端粒长度,从而延缓细胞衰老的过程。
四、端粒酶与癌症的关系与正常细胞不同,癌细胞中的端粒酶活性往往较高,这使得癌细胞能够不受限制地进行无限制的分裂。
因此,端粒酶被认为是癌细胞的一个重要靶点。
近年来的研究表明,通过抑制端粒酶的活性,可以抑制癌细胞的生长和增殖,为癌症的治疗提供了新的思路和方法。
端粒酶作为一个重要的酶类物质,在维持染色体稳定性、延缓细胞衰老和抑制癌细胞生长方面发挥着重要的作用。
对端粒酶的研究不仅有助于深入理解细胞生物学的基本原理,还为相关疾病的治疗提供了新的思路和方法。
随着对端粒酶的研究深入和技术的不断进步,相信端粒酶在医学和生命科学领域的应用将会得到进一步拓展,为人类健康的发展做出更大的贡献。
端粒和端粒酶是细胞生物学领域的两大热点话题。
本文将从发现历史、结构特点、功能和生物学意义等方面介绍端粒和端粒酶。
第一段:发现历史端粒是位于染色体末端的DNA序列,其命名源于希腊语的“telos”意为“末端”。
20世纪初,科学家观察到细胞的染色体在每次分裂后末端会缩短,这种细胞自我凋亡的现象被称为“Hayflick极限”。
1980年代,美国科学家Elizabeth Blackburn和Carol Greider运用基因重组技术,发现端粒中有一种叫做“端粒酶”的酶类物质,才揭示了端粒缩短的原因。
第二段:结构特点端粒由DNA序列和蛋白质组成。
DNA序列为TTAGGG的六碱基序列,长度在3000-15000碱基对之间,不同物种的端粒长度也有差异。
端粒蛋白质主要有三类,即端粒结合蛋白(TRF1、TRF2等)、TIN2和POT1等。
如此复杂的结构的作用是为了维护染色体的完整性和稳定性,同时也起到保护基因免遭外在威胁的作用。
第三段:功能端粒和端粒酶的主要作用是维持染色体末端的长度,保护基因避免缩短和脱落。
端粒酶可以在染色体末端补充缺失的序列,避免端粒的缩短和染色体末端的无序化。
当端粒长度缩短到一定程度时,细胞就不能进行正常的分裂,这种现象叫做克隆老化。
而端粒酶也被认为可能是癌症治疗的靶点之一。
第四段:生物学意义端粒和端粒酶的发现对于生物学研究有重要意义。
首先,它揭示了染色体末端的保护机制,对于防止某些疾病的发生具有重要意义。
其次,端粒和端粒酶可作为癌症的诊断和治疗靶点。
最后,它对于解释克隆老化现象的发生机制和危害等方面的探究也有很大的科学价值。
第五段:结论综上所述,端粒和端粒酶是细胞生物学研究的热点话题,具有很高的科学价值和应用前景。
希望在未来的研究中,能够深入探究其生物学意义,并为癌症的治疗、生物老化等方面的研究提供有力支持。
端粒结合蛋白端粒结合蛋白可能通过调节端粒酶的活性来调节端粒长度,进而控制细胞的衰老、永生化和癌变.:本文提到的端粒和端粒酶发现大事记1938年,Hermann Muller注意到染色体末端的特殊性并提出端粒的概念1939年,Barbara McClintock发现玉米细胞的染色体断裂末端容易融合1972年,James Watson提出染色体复制的末端隐缩问题1978年,报道四膜虫的端粒序列1982年,端粒的发现导致人工染色体的发明1984年,报道酵母的端粒序列1985年,报道四膜虫的端粒酶活性1989年,报道四膜虫端粒酶的RNA亚基1994年,报道酵母端粒酶的RNA亚基1995年,报道酵母端粒酶活性1996年,纯化了四膜虫端粒酶的催化亚基遗传筛选到酵母端粒酶的催化亚基1997年,证明了四膜虫和酵母端粒酶的催化亚基,端粒DNA的延伸是通过“酶”来完成的,否定了同源重组的假说。
这种酶后来被命名为“端粒酶”(telomerase)。
1989年,Jack W.Szostak实验室利用一系歹『J遗传学筛选方法,在酵母中找到了邱r 1基因。
这个基因突变会导致细胞分裂过程中端粒序列不断缩短。
染色体缺失频率增加,最终出现细胞衰老和死亡的表型㈣。
同时.Elizabeth H.Blackburn实验室在四膜虫上发现一个突变会引起相似的表型,这说明端粒可能在维持基因组稳定性和细胞增殖方面发挥着重要作用旧。
此后,多个实验室参与到端粒酶蛋白亚基的寻找丁。
1989年,CamlW.Greider通过跟踪端粒酶活性.用柱子纯化并成功克隆了四膜虫端粒酶RNA.发现其中一段RNA序列为C从CCC.CAA.正好与四膜虫的端粒DNA序列互补,端粒酶可能是利用这段序列作为模板复制端粒DNN切。
之后,Elizabeth H.Blackburn研究小组发现,将这一RNA序列进行突变后会直接导致端粒序列的相应改变118I。
这证明端粒酶RNA组分作为模板存在于端粒酶复合体中。
端粒与端粒酶
2009年度诺贝尔生理学或医学奖授予伊丽莎白·布莱克本、卡萝尔·格雷德和杰克·绍斯塔克三位美国科学家,以表彰他们“发现端粒和端粒酶是如何保护染色体的”。
在染色体的末端部分有一个像帽子一样的特殊结构,这就是端粒,布莱克本和绍斯塔克发现端粒的一段特殊DNA序列能使染色体不被降解,而格雷德和布莱克本则找到了帮助端粒合成的分子——端粒酶。
1984年,布莱克本实验室发现了一个有趣的现象:带着四膜虫端粒DNA的人工染色体导入到酵母后,被加上了酵母的端粒而不是四膜虫的端粒序列。
为什么在四膜虫端粒上加的是酵母的端粒序列而不是四膜虫端粒本身的序列呢?难道酵母中存在专门的“酶”来复制端粒DNA?随后,布莱克本实验室用四膜虫的核抽提液与体外的端粒DNA进行温育,证明确实存在一种“酶”能延伸端粒DNA,这种酶后来被命名为“端粒酶”。
端粒酶通过引物特异识别位点,以自身RNA为模板,在染色体末端合成端粒DNA,使端粒得以延长。
他们的发现阐明了端粒酶的作用——使端粒的长度和结构得以稳定,从而保护染色体。
细胞随着端粒的变短而衰老,而当端粒酶的活性足以维护端粒的长度时,细胞将会延迟衰老。
在癌细胞得到永生性这一过程中,端粒酶的激活起了非常重要的作用。
相反,一些遗传病正是由于端粒酶的活性缺陷最终导致细胞的损伤。
正是由于三位科学家的开创性工作让人们知道端粒和端粒酶不仅与染色体的特质和稳定性密切相关,而且还涉及细胞的衰老与损伤、癌症的发生等方面。
端粒和端粒酶的发现历程廖新化引言2009年诺贝尔生理学或医学奖授予了UCSF(加州大学旧金山分校)的Elizabeth Blackburn (简称Liz),Johns Hopkins University(约翰霍普金斯大学)的Carol Greider(简称Carol),以及Howard Medical School(哈佛医学院)的Jack Szostak。
诺贝尔奖主页上介绍她/他们获奖的原因是揭示了“how chromosomes are protected by telomeres and the enzyme telomerase”(染色体是如何被端粒和端粒酶保护的)。
端粒和端粒酶的研究进程中贯穿着“发现现象/问题”-“提出概念/模型”-“实验验证”的思路,整个过程就像相继解开一个个puzzle(智力谜团)一样有趣,充满了思想的光辉。
重现这个思路对科学工作者是有启发意义的。
本文也提供了一个很好的科学问题推演的教学案例。
染色体末端的两个难题以及端粒的概念20世纪70年代初,对DNA聚合酶特性的深入了解引申出了一个染色体的复制问题。
DNA 聚合酶在复制DNA的时候必须要有引物来起始,而且它的酶活性具有方向性,只能沿着DNA5’到3’的方向合成。
染色体复制之初可以由小RNA作为引物起始合成,之后细胞的修复机器启动,DNA聚合酶能够以反链DNA为模板,以之前合成的DNA为引物,合成新的DNA取代染色体中间的RNA引物。
但是线性染色体最末端的RNA引物因为没有另外的引物起始,没有办法被DNA取代。
所以线性染色体DNA每复制一轮,RNA引物降解后末端都将缩短一个RNA引物的长度(图1,简化的示意图,实际上染色体的DNA双链末端不会是平的)。
尽管这个引物不长,但是细胞千千万万代地不断复制,如果不进行补偿,染色体不断缩短,最终就会消失。
James Watson(因为发现DNA双螺旋结构获得诺奖)最早就明确指出了这个“末端隐缩问题”,并猜想染色体也许可以通过在复制前联体(染色体末端跟末端连起来)的方式来解决末端复制的问题[1]。
早在1939年,潜心玉米遗传性状研究的Barbara McClintock女士(因为发现玉米的转座子获得诺奖)注意到,在减数分裂后期偶然产生的染色体断裂很容易重新融合起来形成“桥”。
在紧接着的有丝分裂中,这种染色体“断裂-融合-桥-断裂”的循环不断继续[2]。
既然染色体的断裂末端这么容易相互融合,那么染色体的自然末端,为什么不容易相互融合呢?合理的推测是,染色体的自然末端不同于非正常的DNA断裂末端,它应该有一个特殊的结构来避免染色体之间的相互融合。
更早的1938年,Hermann Muller(因为发明用X射线突变基因而获得诺奖)利用X射线照射果蝇产生突变体,注意到染色体的末端跟其它区域的染色体不同,它非常稳定,从未观测到断裂缺失或者倒位(inversion)。
他因此先见性地认为染色体的末端比较特殊,它需要被封闭(sealed)起来,并给它一个专有的名称-端粒(telomere,来自希腊词根telos,末端,和meros,部分)[3]。
端粒DNA序列的发现以及人工染色体的发明那么端粒为什么与众不同呢?简单地,首先是,它的DNA序列有没有特殊性?提到端粒不能不提到一种特殊的模式生物四膜虫(Tetrahymena thermophila)。
它对于发现端粒和端粒酶的贡献就像线虫之于发现细胞凋亡一样(2002年细胞凋亡的研究被授予诺奖)。
四膜虫有两个细胞核。
小核很稳定,含5对染色体,用于生殖传代。
而大核在接合细胞的发育过程中,染色体断裂成200-300个小染色体,rDNA(含有编码核糖体RNA的基因)从染色体上断裂后通过复制更是形成高达~10000个小染色体。
四膜虫的小染色体众多,也就说端粒可能非常丰富。
这就为端粒研究提供了得天独厚的材料。
1978年,Liz女士利用这种特殊的模式生物纯化了rDNA,以rDNA为模板通过体外合成参入dNTP的实验,推断四膜虫的端粒是由许多重复的5’-CCCCAA-3’六个碱基序列组成的[4]。
第一个谜底揭开了,哦,重复序列,端粒DNA果然特殊。
序列本身隐隐暗示着解决染色体末端的隐缩问题和保护问题的机制。
1980年,当Liz女士在会议上报告她的这一发现的时候,引起了Jack Szostak的极大兴趣。
他那时候试图在酿酒酵母(Saccharomyces cerevisiae)中建构人工线性染色体,让它能够在细胞中像自然染色体一样复制。
但是当环状质粒线性化转入酵母细胞后,它很快地被降解掉。
它的降解是不是因为它的末端没有端粒保护呢?端粒序列的发现让Jack Szostak有机会把线性质粒末端连接上四膜虫的端粒DNA,然后再导入酵母细胞。
奇迹发生了,线性质粒不再降解,它可以在细胞内复制,人工染色体的想法实现了![5]值得一提的是,人工染色体的实现当初也许仅仅是满足人们的异想天开,但它实际上使DNA的大片段克隆成为可能,后来为人类基因组测序的工作立下了汗马功劳。
这也是Jack Szostak共同获得诺贝尔奖的重要原因。
1984年,Liz实验室通过将酵母端粒克隆到线性人工染色体的方法,发现酵母的端粒序列是由不太规则的TG1-3/C1-3A重复序列组成的[5, 6]。
端粒复制的两个假说以及端粒酶活性的发现在1984年报道酵母端粒序列的同一篇文章中,Liz实验室发现了一个有趣的现象:带着四膜虫端粒DNA的人工染色体导入到酵母后,被加上了酵母的端粒而不是四膜虫的端粒序列[6]。
由于端粒是由重复序列组成的,当时人们普遍猜想同源重组是延伸端粒补偿染色体末端隐缩的机制。
但是同源重组只能复制出更多本身的序列,为什么在四膜虫端粒上加的是酵母的端粒序列而不是四膜虫端粒本身的序列呢?这个现象同源重组是无力解释的。
也许,酵母中存在专门的“酶”来复制端粒DNA。
究竟是重组还是全新的酶?为了厘清这两个假说,Liz意识到最重要的是找到这个“酶”。
如前所述,在四膜虫接合细胞的大核发育过程中,大核产生了非常丰富的小染色体,每一个小染色体都被从头加上了端粒。
可以推测,如果“酶”的假说成立,此时细胞内的“酶”活性应该是非常高的。
1984年,Carol女士作为博士生加盟了Liz实验室。
她们俩精心讨论设计实验,用四膜虫的核抽提液与体外的端粒DNA进行温育,试图在体外检测到这个“酶”活性,看到端粒的延伸。
经过不断优化条件,尤其是把底物换成体外合成的高浓度的端粒DNA后,同年的圣诞节,勤奋的Carol同学打开暗盒曝光x光片,终于清楚地看到了“酶“活性。
在测序胶的同位素曝光片上,端粒底物明显被从新加上了DNA碱基,而且每六个碱基形成一条很深的带,与四膜虫端粒重复基本单位为六个碱基正好吻合[7]。
这种酶活性不依赖于DNA模板,只对四膜虫和酵母的端粒DNA进行延伸,而对随机序列的DNA底物不延伸;并且该活性不依赖于DNA聚合酶[7]。
由于同源重组对序列没有特异性的要求并且依赖于DNA聚合酶的活性,至此,她们澄清了这两种假说,证明了有一种“酶”来延伸端粒DNA。
这种酶后来被命名为“端粒酶”(telomerase)。
端粒酶RNA亚基的发现紧接着她们开始对端粒酶活性进一步定性。
此时Tom Cech(因为发现RNA可以有催化酶活性获得诺奖)正好访问Liz的实验室,她/他们一起做了个简单的实验,就是用RNA酶处理样品,降解样品的RNA,看看端粒酶活性是否受到影响。
结果是酶活性竟然消失了,端粒酶活性依赖于RNA[8, 9] 。
端粒酶会不会是另外一种特殊的RNA催化酶?想必从这个时候,Tom Cech 开始被端粒酶深深吸引,并介入了这个领域。
当然那时候也知道端粒酶是依赖于蛋白的:用蛋白酶消化后的样品也不具备端粒酶活性[7]。
1989年,Carol通过跟踪端粒酶活性,用柱子纯化并克隆了四膜虫的端粒酶RNA亚基。
另一个谜底揭开了:RNA亚基有一段RNA序列正好和四膜虫的端粒DNA序列互补,端粒酶正是利用RNA亚基的这段序列作为模板重复复制出端粒DNA[10]。
端粒和端粒酶领域的领军人物多数是女士。
公平起见,不妨多介绍几位。
Virginia Zakian 女士实验室的Daniel Gottschling发现端粒区域具有TPE效应(Telomere Position Effect,端粒位置效应),也就是置入端粒区域的基因会被沉默,不表达[11]。
我们来看看Daniel Gottschling自己成立实验室后是如何利用TPE现象来设计实验,筛选出酵母的RNA 亚基基因的,同时也见识一下酵母这个非常强大的遗传学模式生物。
首先把URA和ADE两个基因通过遗传重组的方法置入端粒区域。
URA基因使酵母能够自己合成uracil(尿嘧啶);缺少ADE基因则会让酵母累积红色素,使酵母克隆变成红色。
由于端粒的TPE效应,URA和ADE不表达,酵母只能在含有uracil的培养基中生长,且克隆是红色的。
在这个遗传改造过的酵母中转入酵母的cDNA表达库,可以预计,某些调控端粒长度的基因通过过表达可以改变端粒的长度。
如果端粒长度变得足够短的话,TPE效应就会消失,URA和ADE两个基因就会启动表达。
那么这种短端粒的酵母就能够在不含有uracil的培养基中生长,并且酵母克隆显示出白色(图2)。
用这两个指标进行筛选,可以筛选到一系列让端粒变短的基因。
其中一个基因比较特殊,任何阅读框都只能阅读一小段蛋白序列,看起来更象个RNA基因。
深入研究发现这个基因含有酵母端粒序列的互补序列,而且对这一序列进行突变,酵母的端粒序列也发生相应的改变-这个基因正是编码酵母端粒酶RNA亚基的基因[12]。
这个发现有运气的成分,因为一般情况下,端粒正调控基因过表达,端粒应该变长才对。
但是恰恰相反,端粒酶RNA亚基的过表达,端粒反而变得很短。
此后的1995年,同样是Liz实验室报道了酵母端粒酶的活性[13]。
端粒酶催化亚基的发现到RNA亚基被揭示为止,谜团就只剩下端粒酶的蛋白质亚基了。
端粒酶既然能够利用RNA 模板亚基来复制DNA,那么很容易推测这个蛋白亚基可能具有RNA dependent DNA polymerase活性(依赖于RNA的DNA聚合酶活性),也就是逆转录酶的活性。
更进一步地说,它的蛋白序列里应该包含逆转录酶特有的结构域。
尽管没有实验证据,这个谜底通过逻辑推理实际上已经猜到了一半,很多人都想彻底地揭开它,不同实验室的竞争也变得激烈起来。
1989年,端粒和端粒酶领域的另外一位女杰,Jack Szostak实验室的Vicki Lundblad利用设计精巧的遗传学筛选方法,从酵母中筛选到了EST1基因(这个遗传学方法描述起来比Daniel Gottschling的更为复杂,这里就不介绍了,有兴趣的去读原始文献)。