第12讲 碳、硅及其化合物
- 格式:ppt
- 大小:5.32 MB
- 文档页数:54



12碳和硅及其化合物一、课标导航知识内容课标要求目标层次常见非金属元素和应用根据研究物质的思想和方法,掌握常见非金属单质及其重要化合物的主要性质Ⅱ了解常见非金属单质及其重要化合物对环境质量的影响I二、核心纲要1. 硅单质1.物理性质2.化学性质:和碳相似,在常温下化学性质不活泼.(1)常温下,不与强酸反应,但能与氢氟酸、氟气和烧碱等物质反应.(硅的特性)(2)加热条件下,能跟一些非金属单质反应.存在和形态颜色状态导电性自然界中无游离态的硅,主要以二氧晶化硅和硝酸盐的存在形式晶体是灰黑色、有金属光泽、脆而介于导的固体介于导体和绝缘体之间(硅和锗是重要的半导体材料)高温加热3.工业制法(焦炭在电炉中还原二氧化硅得到粗硅,粗硅提纯后可以得到半导体材料的高纯硅)粗硅提纯:4.用途①做半导体材料的晶体管、集成电路、硅整流器和太阳能电池等②制合金:含硅 的钢具有良好的磁性------变压器铁芯;含硅左右的钢具有良好的耐酸性,可做耐酸性设备等.高温()()加热()2. 二氧化硅1.存在2.物理性质3.化学性质颜色状态硬度,熔沸点水溶性无色透明固体硬度大,熔沸点高难溶于水4.用途光导纤维的主要材料;石英表中压电材料;石英坩埚类别酸性氧化物熔沸点较高化学性质与水不与水反应,也不溶于水与碱及碱性氧化物反应(装溶液的试剂瓶用橡皮塞,而不用玻璃塞)与特殊酸(雕刻玻璃)与碳酸盐反应(制玻璃原理)弱氧化性高温高温高温高温高温3. 硅酸1.物理性质白色固体,难溶于水.2.化学性质(1)弱酸性①的酸性比弱,因此可由比强的酸与可溶性硅酸盐反应得到硅酸: (胶体) (胶体)(胶体)生成的硅酸逐渐聚合形成胶体溶液—硅酸溶胶,浓度较大时形成硅酸凝胶,经干燥脱水,形成硅胶,硅胶多孔,吸附水分能力强,常用作实验室和袋装食品、瓶装药品等的干燥剂,也可用作催化剂的载体.②硅酸不能使指示剂变色,但可以与强碱反应.(2)不稳定性受热分解:4. 硅酸盐1.硅酸盐的组成及物理性质硅酸盐是由硅、氧和金属元素组成的化合物的总称,在自然界中分布极广,大多数不溶于水,化学性质很稳定.2.硅酸钠化学式为 ,可溶于水,其水溶液俗称水玻璃,又称泡花碱.是一种无色粘稠的液体.3.化学性质(1)与酸反应(胶体)(胶体)(2)热稳定性好,不能燃烧,不易被腐蚀.具有阻燃性.可用作肥皂填料、木材防火剂及黏胶剂等.4.三大传统硅酸盐产品水泥玻璃陶瓷主要原料黏土,石灰石;辅料:石膏黏土,石灰石;辅料:石膏黏土主要用途用作建筑材料,制水泥砂浆,混凝土,钢筋混凝土制有色玻璃,钢化玻璃,光学玻制,玻璃纤维等制作绝缘餐具,砖瓦,瓷坩埚,蒸发皿精华点拨1.与的比较2.硅酸盐的表示方法硅酸盐种类繁多,结构复杂,组成各异,通常用二氧化硅和金属氧化物的组成形式表示其组成. 例如:硅酸钠:硅酸钙::高岭石:名称二氧化碳二氧化硅存在空气岩石中,硅石、石英、水晶、硅藻土都含结构由分子构成的晶体由 两种原子构成的立体网状结构的晶体物理性质熔、沸点低,常温时是气体,能溶于水()熔、沸点高,无色透明晶体或白色粉末,不溶 于水化学性质与水反应与酸反应除 外不反应与 反应与反应相互转换(不能说明硅酸酸性比碳酸强)(胶体)高温高温三、全能突破1. 基础演练A.B.1.关于二氧化硅,下列叙述不正确的是( )水晶的主要成分是二氧化硅二氧化硅和二氧化碳在物理性质上有很大差别C. D.二氧化硅不溶于水,也不能跟水起反应生成酸二氧化硅是一种酸性氧化物,它不跟任何酸起反应A.两者均为弱酸B.两者均可使紫色石蕊试液变红色C.气体通入 溶液中可以制得硅酸D.两者受热时均可以分解2.下列关于碳酸()和硅酸()的说法中不正确的是( )A.B.C.D.3.四氯化硅还原法是当前制备较高纯度硅的一种方法,有关反应的化学方程式为:下列说法不合理的是( )反应制得的硅可用于制造半导体材料反应制得的硅可用于制造光导纤维粗硅可以用反应来制取,该反应属于置换反应混入少量空气对上述反应有影响高温高温A.①②⑤B.①③C.②④D.③④⑤4.在一定条件下,既能与 反应,又能跟 反应的物质是( )① 溶液;②浓硫酸;③溶液;④碳;⑤碳酸钠2. 能力提升A.B.C.D.1.下列各实验操作中,能证明生石灰中可能既混有石英,又混有石灰石的是( )加入过量盐酸,观察是否有气泡冒出加入过量烧碱溶液,观察是否有固体溶解加热至高温、观察是否有气泡冒出、有硅酸钙生成先加过量盐酸搅拌,观察是否有不溶物剩余及气泡出现;若有不溶物则滤出,投入到 溶液中看其是否溶解A.①②③④B.②C.①③④ D.②③④2.将过量的 分别通入:① 溶液;② 溶液;③ 溶液;④ 溶液,最终有沉淀析出的是( )A. B. C. D.3.下列变化中不能一步实现的是( )4.A.B.C.D.由 、、、 组成的混合粉末。

碳、硅及其化合物无机非金属材料一、碳及其化合物1、单质(1)同素异形体金刚石:构型、空间网状结构的晶体。
无色透明,熔沸点高,硬度大,难溶于溶剂,不导电。
用途:钻具、装饰品。
石墨:平面层状正六边形结构,层间以范德华力结合。
熔点很高,质软,有滑腻感,电的良导体。
用途:润滑剂、电极、铅笔芯、耐火材料。
C60:形似足球,俗称“足球烯”,是分子晶体。
无定形碳:木炭、活性炭(有吸附性)等,实际是石墨的微小晶体和少量杂质组成。
(2)化学性质还原性:(与O2、浓H2SO4、CuO、H2O)、、2、气态氢化物—CH43、一氧化碳CO(1)物理性质:色味的气体,溶于水,有剧毒(与血红蛋白作用)(2)化学性质:高温下表现出强还原性(与O2、Fe2O3、CuO)、4、二氧化碳CO2(1)结构:电子式为,结构式为,空间构型为型。
属于由键构成的分子,固态时为晶体。
(2)物理性质:色味的气体,溶于水,干冰能升华。
(3)化学性质:①弱氧化性(Mg、C)、② 具有酸性氧化物的性质(NaOH 、Ca(OH)2、CaCO 3、Ca(ClO)2)、 、(4)制法① 工业制法:② 实验室制法:5、碳酸H 2CO 3结构 ,二元弱酸,不稳定,易分解,具有酸的通性。
在化学方程式中写成CO 2和H 2O 的形式,只有作为水解产物时写成H 2CO 3的分子式。
6、碳酸盐(正盐、酸式盐)(1)溶解性 正盐 溶解度比较 酸式盐K +、Na +、NH 4+ 可溶 >可溶 其它难溶< 可溶 (2)热稳定性 类别稳定性分解产物 稳定性变化 正盐K +、Na + 高温不分解 稳 定 性 减 弱其它难溶性 常温稳定,高温分解 金属氧化物+CO 2 酸式盐K +、Na + 加热可分解,<200℃ 正盐+CO 2+H 2O其它Ca 2+、Mg 2+等 加热可分解,<100℃ 正盐+CO 2+H 2O 铵盐 (NH 4)2CO 3、NH 4HCO 3 不稳定,常温已分解 NH 3+CO 2+H 2O (3)相互转化7、碳化物(1)SiC ,金刚砂,原子晶体。
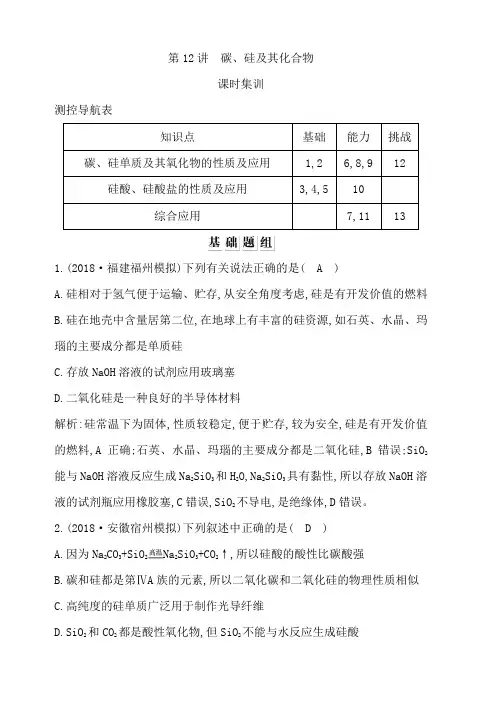
第12讲碳、硅及其化合物课时集训测控导航表1.(2018·福建福州模拟)下列有关说法正确的是( A )A.硅相对于氢气便于运输、贮存,从安全角度考虑,硅是有开发价值的燃料B.硅在地壳中含量居第二位,在地球上有丰富的硅资源,如石英、水晶、玛瑙的主要成分都是单质硅C.存放NaOH溶液的试剂应用玻璃塞D.二氧化硅是一种良好的半导体材料解析:硅常温下为固体,性质较稳定,便于贮存,较为安全,硅是有开发价值的燃料,A正确;石英、水晶、玛瑙的主要成分都是二氧化硅,B错误;SiO2能与NaOH溶液反应生成Na2SiO3和H2O,Na2SiO3具有黏性,所以存放NaOH溶液的试剂瓶应用橡胶塞,C错误,SiO2不导电,是绝缘体,D错误。
2.(2018·安徽宿州模拟)下列叙述中正确的是( D )A.因为Na 2CO3+SiO2Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强B.碳和硅都是第ⅣA族的元素,所以二氧化碳和二氧化硅的物理性质相似C.高纯度的硅单质广泛用于制作光导纤维D.SiO2和CO2都是酸性氧化物,但SiO2不能与水反应生成硅酸解析:A项,该反应在高温下进行,且反应生成的产物中有气体,反应正向移动,促使反应能够顺利进行,故不能通过此反应判断H2CO3与H2SiO3的酸性强弱,错误;CO2和SiO2的物理性质差异较大,B错误;光导纤维的主要成分是SiO2,C错误;SiO2和CO2都是酸性氧化物,SiO2不溶于水,所以不能与水反应生成硅酸,D正确。
3.(2018·福建高三毕业班质检)下列各组物质中,均属于硅酸盐工业产品的是( A )A.陶瓷、水泥B.水玻璃、玻璃钢C.单晶硅、光导纤维D.石膏、石英玻璃解析:陶瓷、水泥是传统的硅酸盐材料,A正确;水玻璃是硅酸钠的水溶液,玻璃钢是一种以玻璃纤维作增强体、合成树脂作基体的复合材料,B错误;单晶硅是硅单质的一种晶体,光导纤维的主要成分是SiO2,C错误;石膏是硫酸盐,石英玻璃的主要成分是二氧化硅,D错误。





证对市爱幕阳光实验学校第12讲碳、硅及其化合物一、单项选择题1. (2021·模拟)如何解决好碳排放问题是关系到人类可持续开展的重大课题之一。
目前,采用较多的方法对二氧化碳进行捕集封存和富集再利用。
以下与二氧化碳有关的表达正确的选项是()A. CO2是形成酸雨的主要物质B. CO2导致温室效,是一种大气污染物C. CO2(g)+C(s)2CO(g) ΔH>0,高温有利于该反自发进行D. 室常用大理石与稀盐酸或稀硫酸反制取二氧化碳2. (2021·模拟)80年代,研制得一种分子,它具有空心的类似足球状的结构,分子式为C60。
以下说法正确的选项是( )A. C60是一种型的化合物B. C60含有离子键C. C60和石互为同位素D. C60中的化学键只有共价键3. (2021·兴庆)以下说法正确的选项是( )A. 水晶项链和餐桌上的瓷盘都是硅酸盐制品B. 工艺师利用盐酸刻蚀石英制作艺术品C. 二氧化硅广泛用于光纤通信D. 水泥的主要成分是二氧化硅4. (2021·模拟)在生产和生活中用的化学知识正确的选项是( )A. 玻璃、水泥、水晶项链都是硅酸盐制品B. 晶体硅是在通信工程中制作光导纤维的主要原料C. 萤石与浓硫酸反生成的酸可以与二氧化硅反D. 工业上利用二氧化硅热分解法冶炼硅5. (2021·模拟)硅及其化合物的用范围很广。
以下说法正确的选项是( )A. 硅是人类将太阳能转换为电能的常用材料B. 粗硅制备单晶硅不涉及氧化复原反C. 反Si+2NaOH+H2O Na2SiO3+2H2↑中,Si为氧化剂D. 硅能与氢氟酸反,那么硅可以与盐酸反6. 以下各项表达的解释相同的是( )①NaOH溶液不能用带玻璃塞的试剂瓶保存②Na2SiO3溶液要密封保存③酸式滴管不能装NaOH溶液④氢氟酸不能盛放在玻璃瓶中A. ①②B. ①③C. ①④D. ②③7. (2021·质检)关于硅酸体的制备,课本上有“在试管中参加35 mL Na2SiO3溶液(饱和Na2SiO3溶液按1∶2或1∶3的体积比用水稀释),滴入1~2滴酚酞溶液,再用头滴管逐滴参加稀盐酸,边加边振荡,至溶液变浅并接近消失时停止〞的描述。