铝土矿制备铝的工艺流程
- 格式:ppt
- 大小:1.23 MB
- 文档页数:18


铝的生产流程1、矿石提取氧化铝工艺从矿石提取氧化铝有多种方法,例如:拜耳法、碱石灰烧结法、拜耳-烧结联合法等。
拜耳法一直是生产氧化铝的主要方法,其产量约占全世界氧化铝总产量的95%左右。
70年代以来,对酸法的研究已有较大进展,但尚未在工业上应用。
1.1、拜耳法系奥地利拜耳(K.J.Bayer)于1888年发明。
其原理是用苛性钠(NaOH)溶液加温溶出铝土矿中的氧化铝,得到铝酸钠溶液。
溶液与残渣(赤泥)分离后,降低温度,加入氢氧化铝作晶种,经长时间搅拌,铝酸钠分解析出氢氧化铝,洗净,并在950~1200℃温度下煅烧,便得氧化铝成品。
析出氢氧化铝后的溶液称为母液,蒸发浓缩后循环使用。
拜耳法的简要化学反应如下:由于三水铝石、一水软铝石和一水硬铝石的结晶构造不同,它们在苛性钠溶液中的溶解性能有很大差异,所以要提供不同的溶出条件,主要是不同的溶出温度。
三水铝石型铝土矿可在125~140℃下溶出,一水硬铝石型铝土矿则要在240~260℃并添加石灰(3~7%)的条件下溶出。
现代拜耳法的主要进展在于:①设备的大型化和连续操作;②生产过程的自动化;③节省能量,例如高压强化溶出和流态化焙烧;④生产砂状氧化铝以满足铝电解和烟气干式净化的需要。
拜耳法的工艺流程见图1。
拜耳法的优点主要是流程简单、投资省和能耗较低,最低者每吨氧化铝的能耗仅3×106千卡左右,碱耗一般为100公斤左右(以Na2CO3计)。
拜耳法生产的经济效果决定于铝土矿的质量,主要是矿石中的SiO2含量,通常以矿石的铝硅比,即矿石中的Al2O3与SiO2含量的重量比来表示。
因为在拜耳法的溶出过程中,SiO2转变成方钠石型的水合铝硅酸钠(Na2O·Al2O3·1.7SiO2·nH2O),随同赤泥排出。
矿石中每公斤SiO2大约要造成1公斤Al2O3和0.8公斤NaOH的损失。
铝土矿的铝硅比越低,拜耳法的经济效果越差。
直到70年代后期,拜耳法所处理的铝土矿的铝硅比均大于7~8。


铝土矿提取氧化铝铝土矿提取氧化铝是工业领域一项极为重要的工艺技术,据调查,全球氧化铝的产量占据了铝产量的约90%。
本文将从铝土矿的定义、提取氧化铝的工艺流程、以及目前常用的提取方法三个方面对铝土矿提取氧化铝进行分析,具体内容如下:一、铝土矿的定义铝土矿是指以铝石和高岭土为主要原料的矿物,是一种含铝的非金属矿产。
铝土矿主要分布在地球的热带和亚热带地区,其中中国拥有世界上最大的铝土矿资源储量。
铝土矿在工业生产中是重要的原材料之一,主要用于提取氧化铝。
二、提取氧化铝的工艺流程铝土矿提取氧化铝的工艺流程一般包括以下几个步骤:1、粉碎:将原料的大块铝土矿经过破碎后,获得的矿石颗粒尺寸需要达到1-5mm。
2、酸浸:采用硫酸或氢氧化钠等酸性溶液进行酸浸,将铝土矿中的铝氧化物化为可溶性的铝离子。
3、净化:将浸出液进行清洗和沉淀,去除其中的杂质,以保证萃取后的纯度。
4、输送:将清洁的提取液输送至萃取车间。
5、萃取:采用具有选择性的药剂进行萃取,将铝离子从提取液中萃取出来,并获得成品。
6、精制:将萃取出的氧化铝进行进一步的精制,提高氧化铝的纯度,以便制造乙烯、电线电缆、航空器、建筑及交通工具等产品。
三、常用的提取方法目前,铝土矿提取氧化铝常用的方法有卡尔门处理法和贝尔法两种。
1、卡尔门处理法卡尔门处理法也称氢氟酸法,由挪威尔尔柏格卡尔门发明,故得名。
这种方法的原理是将铝土矿与氢氟酸相反应,制成萃取液,并将萃取液用分离、蒸发等工艺处理,获得纯度较高的氧化铝。
2、贝尔法贝尔法是利用碱金属氰化物在碱性介质中萃取氧化铝的工艺方法。
与卡尔门处理法不同,这种方法可以同时提取铝、锂和钠等多种金属。
其优点是能产生低成本的氢氧化铝,并且可以降低铝土矿浸出和提取的成本。
总之,铝土矿提取氧化铝是一项极为重要的工业技术,其发展进程不断加快。
在未来,随着铝土矿资源的逐渐匮乏,对于铝土矿的可持续性开发和利用,以及提取氧化铝的新技术的开发和研究,在实现高质量、高效率、低成本的生产目标方面将会面临更大的挑战。
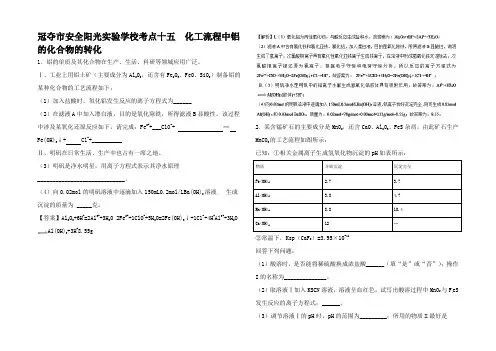
冠夺市安全阳光实验学校考点十五化工流程中铝的化合物的转化1.铝的单质及其化合物在生产、生活、科研等领城应用广泛。
Ⅰ、工业上用铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)制备铝的某种化合物的工艺流程如下:(1)加入盐酸时,氧化铝发生反应的离子方程式为______(2)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
该过程中涉及某氧化还原反应如下,请完成:Fe2++___ClO-+ ═Fe(OH)3↓+ Cl-+__________Ⅱ、明矾在日常生活、生产中也占有一席之地。
(3)明矾是净水明星,用离子方程式表示其净水原理_____________________________。
(4)向0.02mol的明矾溶液中逐滴加入150mL0.2mol/LBa(OH)2溶液,生成沉淀的质量为 _____克。
【答案】Al2O3+6H+=2Al3++3H2O 2Fe2++1ClO-+5H2O=2Fe(OH)3↓+1C1-+4H+Al3++3H2O Al(OH)3+3H+8.55g 2.某含锰矿石的主要成分是MnO2,还含CaO、Al2O3、FeS杂质,由此矿石生产MnCO3的工艺流程如图所示:已知:①相关金属离子生成氢氧化物沉淀的pH如表所示:物质开始沉淀沉淀完全Fe(OH)3 2.7 3.7Al(OH)3 3.8 4.7Mn(OH)28.8 10.4Ca(OH)212 ─②常温下,Ksp(CaF2)=3.95×10-11回答下列问题:(1)酸溶时,是否能将稀硫酸换成浓盐酸______(填“是”或“否”);操作I的名称为______________。
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中MnO2与FeS 发生反应的离子方程式:______。
(3)调节溶液Ⅰ的pH时,pH的范围为_________;所用的物质X最好是________(填字母)。
A.盐酸 B.NaOH溶液 C.氨水 D.MnCO3固体(4)滤渣Ⅰ为___________________,滤渣Ⅱ为_____________。


高铝球生产工艺流程高铝球生产工艺流程高铝球是一种常用的磨料,广泛用于金属矿石研磨、水泥厂磨矿等行业。
下面介绍高铝球的生产工艺流程。
首先,高铝球的原材料是优质铝土矿和高铝粉。
铝土矿是铝的重要矿石,具有高铝含量和较低的杂质含量,是生产高铝球的重要原料。
第一步是原料的制备。
将优质铝土矿进行破碎,经过磨矿机处理,使其粒度达到所需要求。
同时,将高铝粉进行干燥处理,以去除水分。
第二步是混合。
将经过破碎和干燥处理的铝土矿和高铝粉按照一定比例进行混合。
混合的目的是使不同粒径的颗粒均匀分布,提高烧结效果。
第三步是成型。
将混合好的原料放入高压球机进行成型。
高压球机采用一定的压力将原料压制成固定形状的高铝球,常见的形状有圆球和圆柱。
第四步是烧结。
将成型好的高铝球放入烧结炉进行烧结。
烧结炉内提供高温环境,使高铝球内部发生化学反应,颗粒之间发生结合,形成坚固的球体。
第五步是冷却。
烧结好的高铝球会非常热,需要进行冷却处理。
可以使用冷却塔或者冷水进行快速冷却,降低高铝球的温度。
第六步是筛选和分类。
将冷却好的高铝球进行筛选,去除过大或者过小的颗粒,只保留合格的高铝球。
然后根据客户的要求进行分类,不同粒径的高铝球用于不同的应用。
最后一步是包装和出货。
将筛选好的高铝球进行包装,一般采用编织袋进行包装。
然后将包装好的高铝球装入货车或者集装箱,出货给客户。
以上是高铝球的生产工艺流程。
每个环节都需要严格控制操作,以确保高铝球的质量和性能符合要求。
工艺流程的合理性和稳定性对于产品质量的稳定性和提高生产效率非常重要。

铝粉提炼铝锭的工艺流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!1. 原料准备:首先,需要准备高质量的铝粉作为原料。
铝粉通常通过氧化铝还原法或者电解法得到。

一、引言铝合金作为一种重要的轻金属材料,具有优良的物理性能、良好的耐腐蚀性和易于加工成型等特点,广泛应用于航空航天、交通运输、建筑、电子等行业。
随着我国经济的快速发展,铝合金的需求量逐年增加。
本文将详细介绍铝合金的生产工艺流程,以期为我国铝合金产业的发展提供参考。
二、原材料准备1. 铝土矿开采与加工铝土矿是生产铝合金的主要原料,主要分布在我国南方地区。
铝土矿开采后,需进行洗矿、磨矿、拜耳法等工艺处理,提取氧化铝。
2. 氧化铝加工氧化铝是生产铝合金的核心原料,经过脱硅、脱铁、脱钙等工艺处理,提高氧化铝的纯度。
加工后的氧化铝可作为生产铝合金的原材料。
3. 铝锭生产铝锭是铝合金生产的基础,通过熔融氧化铝、铝锭等原料,在电解槽中电解,生成纯铝锭。
铝锭生产主要采用霍尔-埃鲁法、拜耳法等工艺。
三、铝合金熔炼1. 熔融设备铝合金熔炼主要采用熔融炉,如电阻炉、电弧炉等。
熔融炉具有熔融速度快、温度可控、熔炼质量高等优点。
2. 熔炼工艺(1)配料:根据铝合金的成分要求,将铝锭、氧化铝、添加剂等原料按比例称量。
(2)熔融:将配料放入熔融炉中,通电加热至熔融状态。
(3)精炼:在熔融过程中,加入精炼剂,去除熔体中的杂质,提高铝合金的纯度。
(4)均化:将熔融的铝合金在炉内搅拌,使成分均匀。
四、铸造与轧制铝合金铸造是将熔融的铝合金倒入模具中,冷却凝固成铸锭。
铸造方法主要有金属型铸造、砂型铸造、连续铸造等。
2. 轧制铝合金轧制是将铸锭加热至适当温度,通过轧机进行轧制,得到不同规格的板材、带材、型材等。
轧制工艺主要有冷轧、热轧、冷拔、冷轧等。
五、表面处理1. 清洁处理铝合金表面处理前,需进行清洁处理,去除表面的油污、氧化皮等杂质。
2. 表面处理方法(1)阳极氧化:在铝合金表面形成一层氧化膜,提高其耐腐蚀性和耐磨性。
(2)电镀:在铝合金表面镀上一层金属或合金,如镀锌、镀镍、镀铬等,提高其耐腐蚀性和装饰性。
(3)涂装:在铝合金表面涂覆一层涂料,如粉末涂料、油性涂料等,提高其耐腐蚀性和装饰性。


铝粉提炼铝锭的工艺流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!铝粉提炼铝锭的工艺流程主要包括以下几个步骤:1. 原料准备首先,需要准备含有铝的原料,如铝土矿、氧化铝、铝矾土等。
三氧化二铝制备铝工业流程英文回答:The Bayer Process for Aluminum Production.The Bayer process is the primary industrial process for refining bauxite into aluminum oxide (alumina), which is the precursor to aluminum metal. The process was developed by Karl Josef Bayer in 1887 and remains the most widely used method for alumina production today.Steps of the Bayer Process:1. Grinding and Digestion: The bauxite ore is crushed and ground into a fine powder, then mixed with a sodium hydroxide (NaOH) solution to form a slurry. The mixture is then heated to dissolve the aluminum-containing minerals in the bauxite, forming sodium aluminate.2. Clarification: The slurry is cooled and filtered toremove impurities, such as silica and iron oxides. The resulting solution is known as clarified liquor.3. Precipitation: Carbon dioxide (CO2) is passed through the clarified liquor, causing the sodium aluminate to precipitate out of solution as aluminum hydroxide. The precipitate is then filtered and washed.4. Calcination: The aluminum hydroxide is heated to high temperatures in a kiln to remove the water molecules, forming aluminum oxide (alumina).Chemical Reactions:The main chemical reactions involved in the Bayer process are:Dissolution: Al2O3 + 2NaOH → 2NaAlO2 + H2O.Precipitation: 2NaAlO2 + CO2 + 3H2O → Al(OH)3 +Na2CO3。
1 铝的工业制法
铝以化合态的形式存在于各种岩石或矿石里,如长石、云母、高岭市、铝土矿、明矾石,等等。
铝锭的生产是由铝土矿开采、氧化铝生产、铝的电解等生产环节所构成。
1、铝土矿→氧化铝生产
氧化铝生产主要有拜耳法、碱石灰烧结法和拜尔—烧结联合法三种。
通常高品位铝土矿采用拜耳法生产,中低品位铝土矿采用联合法或烧结法生产。
其中拜尔法由于其流程简单,能耗低,已成为当前氧化铝生产中应用最为主要的一种方法,产量约占全球氧化铝生产总量的90% 左右。
由于我国铝土矿资源的80%以上为高铝、高硅,水硬铝石,对这种资源,不能沿用国外普遍采用的常规拜耳法生产氧化铝。
我国氧化铝的生产工艺主要有如下几种:烧结法、混联法 和选矿—拜耳法。
铝及其化合物化学实验及化工流程题1.铝是应用广泛的金属。
以铝土矿(主要成分为Al 2O 3,含SiO 2和Fe2O 3等杂质)为原料制备铝的一种工艺流程如下:注:SiO 2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_________________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO 3溶液,溶液的pH________(填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融 Al 2O 3,电解过程中作阳极的石墨易消耗,原因是____________________________。
阴极的电极反应式为_____________________。
(4)“电解Ⅱ”是电解Na 2CO 3溶液,原理如图所示。
阴极的电极反应式为________________,阴极处溶液的pH 变化________。
(填变大、不变、变小)(5)铝粉在1000℃时可与N 2反应制备AlN 。
在铝粉中添加少量NH 4Cl 固体并充分混合,有利于AlN 的制备,其主要原因是________________________________________________。
(6)铝也可用于生产铝氢化钠,该物质遇水发生剧烈反应,且反应产生大量气泡,其反应的化学方程式为________________________。
2.无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾。
实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al + 6HCl(g) → 2AlCl 3 + 3H 2。
完成下列填空: (1)写出B 处烧瓶中发生反应的化学方程式:___________________________________。
(2)C 中盛有的试剂为__________。
进行实验时应先点燃_____(选填“B”或“D”)处酒精灯。
(3) 用粗短导管连接D 、E 的目的是_________(选填序号)。