检测系统正确度性能评价
- 格式:pdf
- 大小:910.43 KB
- 文档页数:9


Axceed260检测系统精密度和正确度性能验证刘海;张伟;王红艳;刘榕峰;张影;刘萍;赵方【摘要】目的:评价Axceed 260磁微粒全自动化学发光免疫分析系统测定前列腺特异抗原(PSA )、游离前列腺特异性抗原(fPSA)、甲胎蛋白(AFP)、癌胚抗原(CEA)的精密度和正确度,以验证其厂家声明的检测系统性能。
方法利用CLSI EP15‐A3《用户对精密度的验证和偏倚的评估‐批准指南第3版》对Axceed 260磁微粒全自动化学发光免疫分析仪进行一系列肿瘤标志物检测,分析其系统精密度和偏倚。
以高、中、低3个水平浓度伯乐质控371、372、373作为精密度和正确度验证标本,采用Axceed 260对4项肿瘤标志物检测项目进行测定,每份标本重复测定5次,持续5 d ,收集有效数据排除离群值,计算4项肿瘤标志物检测试剂盒的重复性、实验室内不精密度、正确度验证区间,并与厂家提供的指标比较,如果实验室数值低于厂商数值或精密度验证上限,则精密度验证通过,如果测量结果平均值在正确度验证区间内则正确度验证通过。
结果在该实验条件下,Axceed 260磁微粒全自动化学发光免疫分析仪的精密度和偏倚与厂商声明的性能一致。
测定PSA、fPSA、AFP、CEA 4个项目的371重复性分别为3.15%、4.21%、4.26%、2.20%,实验室内不精密度分别为3.15%、4.45%、4.26%、5.01%;测定372的重复性分别为4.95%、4.62%、5.64%、0.96%,实验室内不精密度分别为4.95%、5.07%、8.68%、1.70%;测定373的重复性分别为2.03%、2.10%、2.85%、0.89%,实验室内不精密度分别为2.29%、3.14%、4.05%、1.77%。
与同厂家的对应指标(重复性<6.25%,实验室内不精密度<12.5%)相比精密度验证通过。
正确度验证中,测定371时,PSA、fPSA、AFP、CEA的均值分别为0.83 ng/mL、0.41 ng/mL、2.48 ng/mL、21.40 ng/mL ,偏倚验证区间分别是0.01~1.59 ng/mL、0~0.95 ng/mL、0.92~3.66 ng/mL、14.42~23.38 ng/mL ;测定372时,PSA、fPSA、AFP、CEA的均值分别为3.19ng/mL、2.24 ng/mL、15.8 ng/mL、115.47 ng/mL ,偏倚验证区间分别是1.62~4.84 ng/mL、0.72~3.12 ng/mL、11.45~18.35 ng/mL、104.51~125.49 ng/mL ;测定373时,PSA、fPSA、AFP、CEA的均值分别为18.0 ng/mL、10.6 ng/mL、34.7 ng/mL、230.6 ng/mL ,偏倚验证区间分别是14.8~22.4 ng/mL、8.74~14.46 ng/mL、25.87~34.93 ng/mL、229.61~260.39 ng/mL ;全部项目的测定结果均值均在验证区间内,通过正确度验证。


临床检验定量测定项目精密度与正确度性能验证在临床检验中,精密度与正确度是评价定量测定项目质量的重要指标。
精密度指的是在一定条件下,测定同一样本的重复性;而正确度则是测定结果与参考值之间的接近程度。
为了保证临床检验结果的准确性和可靠性,对于定量测定项目的精密度与正确度性能需要进行验证。
一、精密度验证精密度验证是评估定量测定结果的重复性和一致性,通常使用同一浓度的样本进行重复测定,以评价测定结果的离散程度。
精密度验证需要满足以下要求:1. 选择适当的样本:样本的选择应考虑到临床意义和测试目的。
通常选择近似于临床样本的类型和浓度,以便更准确地评估实际分析中的结果。
2. 确定测定条件:包括仪器、试剂、操作步骤等。
这些条件应与实际检验过程中的条件一致,以保证验证结果的可靠性。
3. 重复测定:至少重复测定3次,并记录每次测定结果。
重复测定的间隔时间应符合实际临床检验的情况,以考察长期测试的一致性。
4. 分析结果:计算测定值的平均值、标准差、变异系数等指标,评估重复测定的精密度。
指标的计算可以使用统计学方法进行。
二、正确度验证正确度验证是评估定量测定结果与参考值之间的一致性和准确性。
正确度验证需要满足以下要求:1. 参考物质的选择:参考物质是用于确定测定方法的准确性和可靠性的标准。
可以选择纯品、国际标准品或已验证的对照品作为参考物质。
2. 确定测定条件:与精密度验证相同,需要确保测定条件与实际检验过程一致,以保证验证结果的可靠性。
3. 测定参考物质:使用所选的参考物质进行测定,并记录测定值。
4. 分析结果:通过比较测定结果与参考值之间的接近程度,评估定量测定方法的正确度。
常用的评价指标包括相对偏差、共同认可误差等。
三、数据分析与结果判定在完成精密度与正确度验证后,需要进行数据分析和结果判定。
一般采用统计学方法对数据进行处理和分析,包括计算平均值、标准差、变异系数、相对偏差等指标。
通过与预设的指标或设定的可接受范围进行比较,判断验证结果是否符合要求。

精密度和正确度性能验证08:50:161卫生部临床检验中心张传宝主要内容•前言•术语和定义•精密度验证•正确度验证•小结08:50:162前言Why When Who Where What08:50:163前言--Why《医疗机构临床实验室管理办法》(2006)¾第三章医疗机构临床实验室质量管理¾第二十四条医疗机构临床实验室应当保证检测系统的完整性和有效性,对需要校准的检验仪器、检验项目和对临床检验结果有影响的辅助设备定期进行校准。
《医疗机构临床实验室管理办法》三级甲等医院考核检查表¾3章24条:¾20.1 是否对检测系统(仪器设备、试剂、校准品)进行了有效性的评价?包括对准确度、精密度、分析测量范围、参考范围、分析干扰等的评估。
¾20.2 每个项目是否具备详尽的校准程序?是否记录了校准结果?¾20.3 是否能提供校准品的溯源证明?¾20.4 是否建立了分析测量范围的验证程序?¾20.5 是否验证了分析测量范围?08:50:164相关法规或标准要求•ISO 15189 医学实验室——质量和能力要求(2012):•5.5 检测程序•5.5.1 检测程序的选择、验证和确认•5.5.1.1 总则•实验室应选择针对预期用途进行过确认的检测程序,...•5.5.1.2 检验程序验证•未做修改的经确认的检测程序,在常规使用之前,实验室应进行独立验证•实验室应从制造商或方法开发者获得用以核实检测程序性能特征的信息•实验室进行的独立验证应通过获取客观证据(以性能指标形式)证实检测程序的性能要求得以满足5相关法规或标准要求•ISO 15189 医学实验室——质量和能力要求(2012):•5.5.1.3 检测程序的确认•实验室应对以下检测程序进行确认:•a) 非标方法;•b) 实验室自行设计或建立的方法;•c) 超预期范围使用的标准方法;•d) 修改过的确认方法•确认应尽量全面,通过客观证据(以性能指标形式)证实针对预期用途的特定要求得以满足•注:检测程序的性能指标包括:正确性、准确性、精密度、测量不确定度、分析特异性、分析灵敏度、检测限、定量限、测量区间、诊断特异度和诊断敏感度6实验室列出方法的性能指标要求(法规实验室选择合适的方法/系统,其性能指实验室验证分析系统在实验室能否达到术语和定义准确度 正确度 精密度 批 测量方法 测量程序 溯源性 互通性08:50:1613术语和定义准确度(accuracy): 一次测量的结果与被测量真值的接近程度。


分子诊断项目定量检测系统分析性能评价程序1 目的规范定量检测系统的分析性能评价程序,对新购置的检测系统在正式用于检测标本前对检测系统的分析性能评价,确认检测系统的分析性能符合临床要求,以保证检验结果的可靠性。
2 适用范围本程序适用于临床分子诊断中心的定量检测系统。
3 职责技术负责人和临床分子诊断中心组长共同负责检测系统分析性能评价实验方法的设计,临床分子诊断中心组长负责组织检测系统的分析性能评价实验的实施。
临床分子诊断中心员工负责执行各项性能评价实验。
4 定义和术语4.1 检测系统完成一个项目检测所涉及的仪器、试剂、校准品、检验方法、操作程序、质量控制程序、保养计划等组合为检测系统,若手工操作还包括具体操作人员。
4.2 检测系统的分析性能检测系统的分析性能不限于包括精密度、正确度、分析灵敏度等。
4.3 检测系统分析性能评价的方式4.3.1 检测系统分析性能的评价:对个检测组自行开发或研究的新检测系统或检验方法的分析性能进行确定,包括精密度、正确度、分析测量范围、临床可报告范围、分析灵敏度、生物参考区间等基本性能的实验评价,使其检验结果符合临床要求,以说明检测系统检测结果的可靠性。
4.3.2 检测系统分析性能的确认:对实验室新购置的已被政府有关部门认可了其分析性能的检验系统,实验室在投入进行患者标本检测前,需对厂家提供的性能资料中的几个分析性能进行实验以确认该检测系统是否具有预期的水平。
对检测系统分析性能的确认包括精密度、正确度、分析测量范围三种性能的评估,对生物参考区间需进行验证。
对于低值在临床上特别有意义的项目需要增加分析灵敏度性能的评估。
5 程序检测系统分析性能评价实验对操作方法如下:5.1 精密度性能评价5.1.1 选择现用的室内质控品作为实验所用样品,按照质控品的说明书进行溶解、分装和冻存。
保证实验样品的稳定性,不要反复冻融。
也可以根据需要选用患者血清作为实验样品。
5.1.2 实验前保证分析仪器状态良好,无故障。

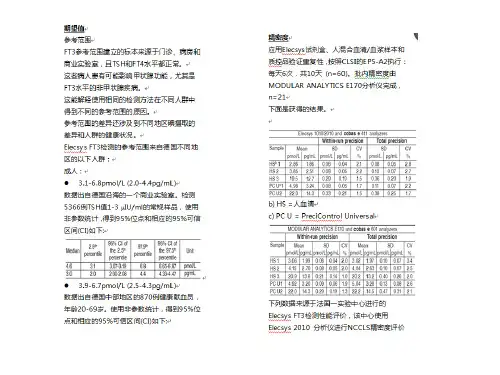
甲胎蛋白(AFP) 检测系统/方法的分析性能验证评价报告验证内容:正确度、精密度、线性范围、临床可报告范围及参考区间的确认验证人员:王爱林李琳马丽张卫一、检测系统信息项目:AFP仪器名称全自动电化学发光免疫分析仪仪器型号Cobas e601试剂及厂商:罗氏诊断有限公司检测方法:双抗体夹心法二、厂商提供的相关参数三、验证过程1、正确度目的:评价仪器测量结果与真值的一致程度。
通过实验室检测数据的偏倚从而评价和验证实验室检测结果的准确性评价方法:参加卫生部临检中心的室间质评,本组参加室间质评的项目一律用回报结果作为评价标准,最近一次参加卫生部室间质评卫生部质控值正确度验证试验数据记录表2精密度(Precision) 重复性精密度目的:考察仪器检测方法的随机误差原理:在检测系统处于优良的条件下,连续测定20个结果,判断这20个独立结果间的一致程度方法:选择新鲜混合血清标本(病人高值、低值)各20份,测量前先定标,再做质控,质控结果在控制范围内,连续重复测定20次,计算SD,CV,得到重复性精密度。
标本来源:高、低值标本均为混合血清结果:本室AFP重复性精密度低值CV为:1.88% 高值CV为:2% 结果判断方式:<1/4CV总误差:6.25%重复性精密度验证试验数据记录表日间精密度:目的:考察目前实验室检测方法日间精密度原理:在检测系统处于优良的条件下,连续测定20天,取得20个结果,判断这20个独立结果间的一致程度。
方法:新鲜混合血清(高值、低值)分装20份冷冻,每天取两份随标本连续测定10天,测定前定标做质控,测定结束做质控,且结果在控制范围内,计算CV,SD,得到批间精密度。
结果:本室AFP日间精密度平均低值CV:1.7% 平均高值CV:1.6% 结果判断方式:日间精密度CV值<1/3CV总误差日间精密度验证试验数据记录表3线性范围(Linearity range, AMR)目的:在确定某项目检测上限的同时检测其上下限是否呈线性关系,从而保证该浓度范围检测结果的准确性。


浙江省中医院徐淑贞陈明涛姚轶敏摘要为了提高医学实验室的质量和能力,规范实验室检测系统的性能验证过程,文章从制定计划,确定方案,执行方案三个方面详细的介绍了检测系统分析性能评价的程序。
医学实验室为保证检验结果的可靠有效,最大程度的得到质量和能力方面的认可,近年来各实验室着力推行检验过程的规范化和标准化,用审视的态度评价日常的操作行为,其中对检测系统的验证评价尤其重视。
检测系统的验证是指对实验室新购置的已被政府有关部门认可了其分析性能的检测系统,实验室在投入进行常规病人标本检测前,需对厂商提供的性能资料中的几个分析性能进行实验确认该检测系统是否具有预期的水平。
对检测系统性能验证的内容一般包括精密度,正确度,分析测量范围,临床可报告范围,生物参考区间。
本文就实验室如何开展验证工作做了以下几点探讨:1 制定验证计划1.1 实验室管理层应制定计划,用于定期监测并证实检测系统已适当校准处于正常功能状态。
同时还应有文件化的预防性维护计划并记录[1]。
1.2 实验室技术负责人和各专业组组长共同负责检测系统分析性能评价实验方法的设计,专业组组长负责组织检测系统的分析性能评价实验并成立工作小组。
2 制定验证方案2.1 确认检测系统:检查一个项目检测所涉及的仪器、试剂、校准品、操作程序、质量控制程序、保养计划等组组成的检测系统,若手工操作还包括具体操作人员都准备到位。
2.2 确认性能验证的内容:定量项目包含精密度,正确度,分析测量范围,临床可报告范围,生物参考区间;定性、半定量项目包含检测结果符合率,检出限。
2.3 确认验证时机和周期:实验室对新购置的检测系统在正式用于检测标本前,需要对检测系统的主要性能和指标进行验证;系统每运行12个月后,需要重新对检测系统的主要性能和指标进行验证;遇到重大投诉针对检测系统有质疑时,需要有针对性的进行验证;仪器维修后、重要零件更换后、试剂改变后等需要对系统的主要性能指标重新验证;仪器长距离搬动后,需要对检测系统的主要性能和指标进行验证,从而保证检验结果的可靠性,最大程度的满足临床要求。
血液五分类检测系统性能验证方案检验科依据CNAS-CL02:《医学实验室质量和能力认可准则》(ISO 15189:2007)对医学实验室检测系统性能评价的相关要求,对Mindray BC-6800、BECKMAN LH750、Sysmex XN-1000全自动血液检测系统进行性能评价,主要从以下几个方面进行:精确度、携带污染率、线性范围、临床可报告范围、准确性、参考范围和正确度等。
具体实施方案如下:1 目的对泉州市第一医院检验科血液组所有全自动血液检测系统性能进行评价,结果与CLIA’88规定的标准比较,判断仪器的性能是否符合要求。
若无CLIA’88规定的标准标准则与EQA比较,判断仪器的性能是否符合要求。
2 原理2.1精密度评价采用厂家提供的低、中、高三个水平的新鲜血,连续重复测定10次;批间取高值和低值两个水平的质控品,每天测定1次、连续检测20天;计算项目批内精密度和批间精密度。
并与CLIA’88规定的标准批内精密度及批间精密度进行比较,核实是否与符合要求。
2.2 携带污染率评价含有高浓度分析物的检测系统再测量含有较低浓度分析物时,对较低浓度分析物的影响。
2.3 线性范围评价参考CLSI EP6-A《定量检测系统线性评价》方案,采用未经过任何处理的病人检验标本,确定某项目检测上限的同时验证其检测上下限范围是否呈线性关系。
2.4 临床可报告范围评价根据检验项目的最大稀释度,结合分析灵敏度及线性范围上限,可以确定本实验室该检验项目的可报告范围:可报告范围下限即分析灵敏度;可报告范围上限即线性范围上限*最大稀释倍数。
2.5 准确性验证使用定值全血样本混匀后连续进行5次测定,计算其平均值与靶值相比较。
2.6参考范围验证选取20例以上体检标本,考虑性别和年龄比例,同批分别检测各项目测定,并参照NCCLS C28文件,检验正态性,计算均值、SD及结果落在正常参考范围的例数与总标本数的比例,即R值,要求95%的检测值在参考范围内为合格;r≥0.9为合格;同时根据实验数据建立实验室自己的参考范围。
测量正确度评价南通大学附属医院王惠民测量正确度(measurement trueness)简称正确度,指无穷多次重复测量所得值的平均值与一个参考值间的一致程度[1]。
正确度不是一个量,是个抽象概念,不能用数值表示,因为在实际工作中对同一被测对象不可能进行无穷次测量。
正确度与系统误差有关,与随机误差无关。
只可说正确度“好”或“差”,正确度的好差可用偏移来衡量,而偏移可用数量表示。
“测量正确度”不等同于“测量准确度”。
测量偏移(measurement bias)简称偏移,有的文献称为偏倚,指系统测量误差的估计值。
常通过将测量结果的平均值减去参考值(如有证参考物质的值)获得,偏移可为正数或负数。
可计算绝对偏移,也可计算相对偏移。
正确度是方法学评价的重要内容。
一、正确度评价的内容正确度评价实际上就是进行实验设计并计算偏移的过程。
可通过与一个参考值比较计算偏移,该参考值可来自于参考物质、室间质量评价(EQA/PT)的靶值、方法学比较试验、回收试验等。
正规的方法比较实验是将常规测量程序与参考测量程序(RMP)比较。
建立RMP对于临床实验室来说,是一件十分困难的事,因此大多数情况下不能直接与RMP比较,而只能与较好的方法或原有的方法进行比较。
CLSI EP9-A2《用患者标本进行方法比较试验及偏移评估》[2]和EP15-A2《精密度和正确度性能的用户验证》[3]都介绍了用方法比较试验进行正确度评价,其主要差别是,前者要求的实验次数较多,每天测8个标本,5天完成,共测定40份标本;后者测定20份标本,可在1天内完成。
前者对数据进行严格的统计处理,而后者的计算较为简便。
因此,EP9-A2更适用于方法学的正确度确认,而EP15-A2仅适用于方法学验证。
CLSI EP10-A3《临床实验室定量检测方法的初步评价》[4]是同时评价精密度、正确度、线性、携带污染率的方法,是一种更简易评价正确度的方法。
二、正确度的判断正确度的性能是通过偏移来进行判断的,对正确度性能进行评价也是通过实验确定偏移的大小,再根据相关原则进行判断。