配合物的结构和性质
- 格式:doc
- 大小:52.50 KB
- 文档页数:2




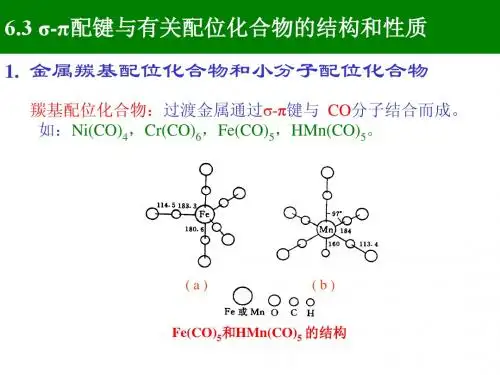
配合物的生成性质及应用配合物是由中心金属离子与配体通过共价键或均带离子键相结合而形成的化合物,具有丰富的生成性质和广泛的应用。
以下将对配合物的生成性质及应用进行详细阐述。
首先,配合物的生成性质主要包括稳定性、配位数和配体特性。
稳定性是指配合物形成后其在溶液中的稳定性,受到中心金属离子的电子轨道和配体配位能力的影响。
中心金属离子的稳定化是通过与配体形成配位键来实现的,一般来说,金属离子的空轨道与配体的空轨道之间的重叠越好,配合物的稳定性越高。
配位数是指一个中心金属离子与配体之间的配位键数量,一般为2、4、6、8等。
配体特性包括配体电荷、大小和位阻等,决定了配位键的形成能力和空间排布。
其次,配合物的生成性质与配位反应密切相关。
配位反应是指在配体作用下中心金属离子与溶液中的配体结合形成配合物的过程。
常见的配位反应包括取代反应、交换反应和加成反应。
取代反应是指一个或多个配体被其他配体取代的反应,可以通过配体之间的竞争结合来实现。
交换反应是指在溶液中不同的配合物之间发生配体的交换,可以通过添加适当的配体或改变溶液条件来实现。
加成反应是指在原有配合物基础上,进一步添加新的配体的反应,可以实现对配合物结构和性质的调控。
配合物具有广泛的应用价值。
首先,配合物在催化反应中发挥着重要的作用。
例如,过渡金属配合物可以作为催化剂催化各种有机反应,如氯化铱配合物在气相氯化甲烷反应中具有很高的活性和选择性。
其次,配合物在生物医学领域中具有重要应用。
铂配合物是世界上最重要的抗肿瘤药物之一,如顺铂和卡铂广泛应用于肿瘤化疗中。
此外,铁配合物可以用作治疗贫血的补铁剂。
再次,配合物在材料科学中有广泛的应用。
过渡金属配合物可以作为气体传感器、液晶显示材料、光学功能材料等。
最后,配合物在环境保护中也具有潜在应用。
例如,一些金属配合物可以作为吸附剂去除废水中的重金属离子,对工业废水的处理和环境保护具有重要意义。
综上所述,配合物具有丰富的生成性质和广泛的应用。





配合物知识点总结一、配合物的定义配合物是由金属离子和配体通过共价键结合而成的化合物。
金属离子在配合物中通常为正离子,配体是通过给电子对金属离子形成配位键。
配合物可以根据配体数目的不同,分为配位数配合物和低配位数配合物。
配合物具有特定的结构和性质,可以发挥重要的应用价值。
二、配合物的结构1. 配合物的中心离子配合物的中心离子通常是金属离子,其常见的价态有+1、+2、+3等。
金属离子的价态决定了配合物的性质和反应活性。
在配合物中,金属离子通常是八面体、四面体等形状的配位几何构型,取决于其配位数和电子排布。
2. 配位键配位键是配体与金属中心之间形成的化学键,通常由配体的一个或多个孤对电子与金属中心的空的d轨道形成。
配位键的强度和稳定性决定了配合物的性质和应用。
3. 配位数配位数是指一个金属离子中与配体形成共价键的个数。
配合物的配位数决定了其化学性质和反应活性。
配位数的不同可以导致配合物的结构和形态的差异,从而影响其性质和应用。
4. 配位几何构型配合物的配位几何构型是指配位体围绕金属中心排布的结构。
常见的配位几何构型有八面体、四面体、三角双锥等形状,配位几何构型决定了配合物的形态和稳定性。
三、配合物的性质1. 配合物的稳定性配合物的稳定性是指其在不同条件下的稳定程度。
配合物的稳定性受金属离子的化合价、配体的性质、配位数和配位方式等因素的影响。
稳定的配合物通常具有良好的溶解度和化学稳定性。
2. 配合物的光谱性质配合物在紫外可见光谱和红外光谱中表现出特定的吸收和发射特性,这些光谱性质可以用来确定配合物的结构和配位方式,从而揭示其化学性质和反应机理。
3. 配合物的磁性由于金属离子的d轨道电子结构的特殊性,配合物具有特定的磁性特性。
配合物可以表现出顺磁性、反磁性和铁磁性等磁性行为,这些性质对于配合物的结构和性质具有重要意义。
4. 配合物的溶解度配合物的溶解度受金属离子的价态、配体的性质和溶剂性质的影响。
溶解度的不同可以影响配合物的稳定性和应用。
高中化学配合物配合物是指由中心金属离子和周围的配体离子共同形成的一个整体结构。
配合物广泛存在于日常生活和化学实验中,具有重要的应用价值。
在高中化学课程中,我们经常会接触到配合物的概念,了解其结构、性质和应用。
一、配合物的结构1. 配合物的组成:配合物通常由一个中心金属离子和若干个配体离子组成。
中心金属离子通常是过渡金属元素,具有较多的空位和不完满的d轨道。
配体离子则是能够给出一个或多个孤对电子的分子或离子,与中心金属离子形成配位键。
2. 配位键的形成:配位键是指中心金属离子与配体离子之间的化学键。
常见的配位键包括配位共价键、配位离子键和配位金属键。
配位键的形成使得配合物呈现特定的几何构型,如八面体、四方形、三角形等。
二、配合物的性质1. 颜色:配合物的颜色常常取决于其中的中心金属离子和配体离子的种类和结构。
不同的配合物由于电子跃迁的不同而呈现出不同的颜色。
这也是我们常常用来区分不同配合物的一种方法。
2. 稳定性:配合物的稳定性取决于配体的性质、中心金属离子的能力和配位数等因素。
稳定的配合物通常具有较低的配位能和较大的配位数,能够稳定保持其结构不发生变化。
3. 溶解性:部分配合物具有较好的溶解性,可以在水或有机溶剂中形成溶液。
溶解性的大小与配合物的结构和性质有关,不同的配合物在不同溶剂中呈现出不同的溶解性。
三、配合物的应用1. 工业应用:配合物在工业中具有广泛的应用,如催化剂、染料、氧化还原剂等。
通过合理设计配合物的结构和性质,可以实现对目标反应的催化和调控,提高反应的效率和产率。
2. 医药应用:部分配合物具有生物活性,可以作为药物的主体或辅助成分。
配合物药物可以改善药物的稳定性、生物利用度和靶向性,提高药物治疗的效果和减少副作用。
3. 环境应用:某些配合物可以被应用于环境保护领域,如重金属离子的吸附和去除。
通过设计合适的配合物结构,可以实现对有害物质的高效捕获和转化,减少环境污染和资源浪费。
综上所述,配合物作为化学领域中的重要概念,具有广泛的应用前景和研究价值。
配合物的结构和性质
【学习目标】
了解配合物的结构和性质
【知识要点】
1.配离子的空间构型
配位数杂化轨道类型空间构型例子
2 sp [Ag(NH3)2]+
3 sp2[CO3]2-、[NO3]-
4 sp3[Zn(NH3)4]2+
4 (dsP2) [Ni(CN)4]2A+
6 (d2sp3) [A1F6]2-
2.顺、反异构体
化学组成相同的配合物可以有不同的结构,这就是配合物的异构现象。
主要是指化学组成相同,仅仅由于配体围绕中心离子的位置不同而产生的结构、性质不同的几何体。
最常见的有顺式、反式两种异构体。
(1)存在于含有两种或两种以上配位体的配合物(某些有机物中也存在)。
(2)顺式——指相同配体彼此位于邻位。
反式——指相同配体彼此处于对位。
(3)在配位数为、或的配合物中,不存在顺、反异构体。
因上述构型中配位位置都是彼此相邻的。
(4)顺、反异构体性质同。
3.配合物的稳定性
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。
当作为中心原子的金属离子相同时,配合物的稳定性与有关。
如CO与血红素中的Fe2+形成的配位键比O2与Fe2+形成的强。
(1)配位原子的电负性__________________________________________________
(2)配位体的碱性____________________________________________________
(3)螯合效应_________________________________________________________
4.配合物的命名
(1)配合物内界命名。
一般按如下顺序:配体个数(用一、二、三……表示)一配体名称(不同配体名称之间以中圆点“·”隔开)一“合”字一中心原子名称一中心原子的化合价(在括号中用罗马数注明)。
如:[PtCl4]四氯合铂(Ⅱ)
(2)自右向左阴离子名称在前,阳离子名称在后。
若阴离子部分是简单离子则称“某化某”,若阴离子为复杂离子则称“某酸某”。
如:
5.配合物的类型(了解)
配合物的范围极广,主要可以分为以下几类:
(1)简单配位化合物:指由单基配位体与中心离子配位而形成的配合物。
这类配合物通常配体较多,在溶液中可以逐级解离成一系列配位数不同的配离子。
(2)螯合物:具有环状结构的配合物叫螯合物或配合物。
【基础训练】
已知Pt(NH3)2Cl2有顺、反两种异构体A、B,A为棕黄色,有抗癌活性,在水中溶解度为O.2577g,B为淡黄色,无抗癌活性,在水中溶解度为O.0366g。
请指出__________是顺式异构体,__________是反式异构体。
【例题剖析】
例1.[Ni(NH3)2Cl2]可以形成A、B两种固体,A在水中溶解度较大;B在CCl4中溶解度较大。
试画出A、B分子的几何构型。
例2.CuCl2溶液有时呈黄色,有时呈黄绿色或蓝色,这是因为在CuCl2的水溶液中存在如下平衡:[Cu(H2O)4]2++4C1-[CuCl4]2-十4H2O
蓝色黄色
现欲使溶液由黄色变成黄绿色或蓝色,请写出可采用的方法:_____________;_____________________________
【练习与作业】
1.能区别[Co(NH3)4Cl2]Cl和[Co(NH3)4Cl2]NO3两种溶液的试剂是 ( ) A.AgNO3溶液 B.NaOH溶液 C.CCl4 D.浓氨水
2.在[Ag(NH3)2]+中Ag+是以____型杂化轨道与配位体形成配位键。
( ) A.sp B.sp2 C.sp3 D.以上都不是
3.已知Zn2+的4s和4p轨道可以形成sp3型杂化轨道,那么[ZnCl4]2-的空间构型为 ( ) A.直线形 B.平面正方形 C.正四面体形 D.正八面体形
4.下列物质不能溶于浓氨水的是 ( )
A.AgCl B.Cu(OH)2 C.AgOH D.Fe(OH)3
5.已知[Pd(C1)2(OH)2]有两种不同的结构,请推测[Pd(Cl)2(OH)2]的空间构型,并简述你的理由。
6.在做银镜反应试验时,需要配制银氨溶液。
请回答:银氨溶液的配制过程、实验现象、并用合理的化学方程式进行解释。
7.曾经,罗马尼亚国炼金废水泄人多瑙河,导致大量鱼类等水生物死亡,沿河居民已长期停止使用此水源,酿成世界级污染事件。
炼金废水中含有络离子[Au(CN)2]—,其电离出的CN—有毒,当与H+结合生成HCN时,其毒性更强。
回答下列问题:
(1)剧毒物HCN的结构式为______________________,其水溶液酸性很弱,可知NaCN溶液pH______7(填“>”“=”或“<”)。
(2)与弱电解质碳酸的电离方程式相似,[Au(CN)2]一也存在着两步电离,其一级电离方程式是__________________________________________。
(3)处理这种废水时,是在碱性条件下用NaClO将CN—氧化为CO32—和N2,其离子方程式为________________________________________________________________。