分析化学定量分析步骤
- 格式:ppt
- 大小:111.50 KB
- 文档页数:28

1.分析方法分类按原理分:化学分析:以物质的化学反应为基础的析方法仪器分析:以物质的物理和物理化学性质为基础分析方法光学分析方法:光谱法,非光谱法电化学分析法:伏安法,电导分析法等色谱法:液相色谱,气相色谱,毛细管电泳其他仪器方法:热分析按分析任务:定性分析,定量分析,结构分析按分析对象:无机分析,有机分析,生物分析,环境分析等按试样用量及操作规模分:常量、半微量、微量和超微量分析按待测成分含量分:常量分析(>1%), 微量分析(0.01-1%), 痕量分析(<0.01%)2.定量分析的操作步骤1) 取样2) 试样分解和分析试液的制备3) 分离及测定4) 分析结果的计算和评价3.滴定分析法对化学反应的要求➢有确定的化学计量关系,反应按一定的反应方程式进行➢反应要定量进行➢反应速度较快➢容易确定滴定终点4.滴定方式a.直接滴定法b.间接滴定法如Ca2+沉淀为CaC2O4,再用硫酸溶解,用KMnO4滴定C2O42-,间接测定Ca2+c.返滴定法如测定CaCO3,加入过量盐酸,多余盐酸用标准氢氧化钠溶液返滴d.置换滴定法络合滴定多用5.基准物质和标准溶液基准物质: 能用于直接配制和标定标准溶液的物质。
要求:试剂与化学组成一致;纯度高;稳定;摩尔质量大;滴定反应时无副反应。
标准溶液: 已知准确浓度的试剂溶液。
配制方法有直接配制和标定两种。
6.试样的分解分析方法分为干法分析(原子发射光谱的电弧激发)和湿法分析试样的分解:注意被测组分的保护常用方法:溶解法和熔融法对有机试样,灰化法和湿式消化法7.准确度和精密度准确度: 测定结果与真值接近的程度,用误差衡量。
绝对误差: 测量值与真值间的差值, 用 E 表示 E = x - x T相对误差: 绝对误差占真值的百分比,用E r 表示 E r =E /x T = x - x T /x T ×100% 精密度: 平行测定结果相互靠近的程度,用偏差衡量。

化学定量实验化学定量实验是分析化学中关键的一部分,这是因为定量实验可以准确地测量化学物质的成分、质量和相对分子量,从而了解物质的化学性质。
在本文中,我们将探讨化学定量实验的步骤,技巧和注意事项。
步骤:化学定量实验需要遵循一定的步骤来实现,这些步骤依次是:准备,操作,计算和分析。
准备阶段:准备材料和器材是十分关键的一步。
在进行化学定量实验之前应该预先准备好所有需要使用的材料和器材。
准备过程中要保持愉悦稳定的心态,以确保操作的准确性。
操作阶段:操作阶段是进行化学定量实验的核心。
在操作过程中,应该仔细地进行每个步骤,避免出现误差。
另外,应该使用最精确的材料和器材来测量化学物质的成分。
计算阶段:计算阶段是将实验结果转化为有意义的数据的核心。
在这个阶段中,应该进行仔细地计算,确保结果的准确性。
这些数据可以用于识别不同物质的属性,提高产品的质量,或了解特定化学物质的反应特性。
分析阶段:在分析阶段,实验的结果会被使用人员进行解释和分析。
这些数据可以用于识别不同物质的属性,提高产品的质量,或了解特定化学物质的反应特性。
存在误差并不奇怪,我们应该通过多次实验来进一步关注这些误差。
技巧:在进行定量实验的时候,应该遵循一些面向技巧,以确保实验的准确性。
以下是实验的技巧:1. 技术水平定量化学实验需要高度技巧性,需要使用精密仪器和设备进行操作。
必须熟练掌握这些工具的使用方法,以免错误发生。
2. 材料选择在定量化学实验中材料的纯度是一件非常重要的事情。
可能出现正负误差,而这些材料的纯度是控制误差的最重要步骤。
如果材料的纯度不足,则实验的结果会出现误差。
3. 测量恰当的量定量化学实验通常以“定量”为目标,因此必须特别注重准确测量实验中各种化学物质的量。
因此,测量的重要性是不言而喻的,误差必须最多用尽量少。
注意事项:在进行化学定量实验之前,应该预先了解基本的安全规则,以确保安全。
下面是注意事项:1. 实验室中应保持干燥和清洁实验室环境需要保持干燥和清洁,以避免干扰实验的结果。

定量分析概述第一节定量分析概论一 .定量分析过程定量分析的主要任务是测定物质中某种或某些组分的含量。
要完成一项定量分析工作,通常抱括以下几个步骤:取样→试样分解和分析试液的制备→分离和测定→分析结果的计算及评价各步骤将在以后章节中详细讨论。
二、定量分析结果的表示1. 被测组分的化学表示形式(1) 以被测组分实际存在形式表示如:测得食盐试样中Cl含量后,以 NaCl%表示分析结果。
(2) 以氧化物或元素形式表示(实际存在形式不清楚)如:硅酸盐水泥中的 Fe、Al、Ca、Mg 含量常以 Fe2O3 、Al2O3 、CaO 、MgO 的含量表示。
分析铁矿石,以 Fe%或 Fe2O3%表示。
(3) 金属材料和有机分析中,常以元素形式(如 Fe 、Zn 、N 、P 等)的含量表示。
(4) 电解质溶液的分析,以所存在的离子形式表示含量。
2. 被测组分含量的表示方法(1) 固体试样:常量组分:常以质量分数表示 :(2) 液体试样:第二节滴定分析对化学反应的要求和滴定方式一.滴定分析对化学反应的要求:化学反应很多,但是适用于滴定分析的反应必须具备:1.反应定量地完成,这是定量计算的基础。
即:反应按反应方程进行,反应完全,无副反应。
2.反应速度快。
对于慢反应能采用适当措施提高其速度。
如:△、加催化剂。
3.能用简便的方法确定终点。
若反应不能完全符合上述要求:可以采用间接滴定法。
二.滴定方式:1.直接滴定凡是被测物与滴定物间的反应符合上述条件的,即可采用直接滴定法2.返滴定法先准确地加入过量标准溶液,使与试液中的待测物质或固体试样进行反应,待反应完成后,再用另一种标准溶液滴定剩余的标准溶液。
3.置换滴定法先用适当试剂与待测组分反应,使其定量地置换为另一种物质,再用标准溶液滴定这种物质。
4.间接滴定法不能与滴定剂直接起反应的物质,有时可以通过另外的化学反应,以滴定法间接进行测定。
第三节标准溶液一标准溶液配制:1. 直接法:准确称取一定量的物质,定量溶解,然后算出该溶液的准确浓度。

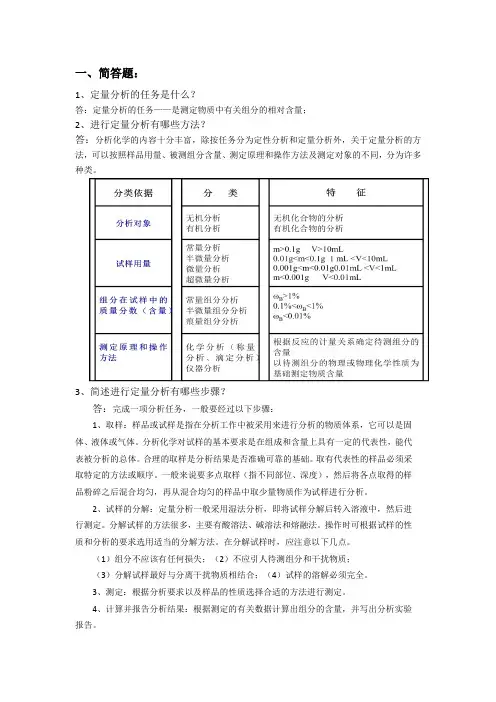
一、简答题:
1、定量分析的任务是什么?
答:定量分析的任务——是测定物质中有关组分的相对含量;
2、进行定量分析有哪些方法?
答:分析化学的内容十分丰富,除按任务分为定性分析和定量分析外,关于定量分析的方法,可以按照样品用量、被测组分含量、测定原理和操作方法及测定对象的不同,分为许多种类。
3、简述进行定量分析有哪些步骤?
答:完成一项分析任务,一般要经过以下步骤:
1、取样:样品或试样是指在分析工作中被采用来进行分析的物质体系,它可以是固体、液体或气体。
分析化学对试样的基本要求是在组成和含量上具有一定的代表性,能代表被分析的总体。
合理的取样是分析结果是否准确可靠的基础。
取有代表性的样品必须采取特定的方法或顺序。
一般来说要多点取样(指不同部位、深度),然后将各点取得的样品粉碎之后混合均匀,再从混合均匀的样品中取少量物质作为试样进行分析。
2、试样的分解:定量分析一般采用湿法分析,即将试样分解后转入溶液中,然后进行测定。
分解试样的方法很多,主要有酸溶法、碱溶法和熔融法。
操作时可根据试样的性质和分析的要求选用适当的分解方法。
在分解试样时,应注意以下几点。
(1)组分不应该有任何损失;(2)不应引人待测组分和干扰物质;
(3)分解试样最好与分离干扰物质相结合;(4)试样的溶解必须完全。
3、测定:根据分析要求以及样品的性质选择合适的方法进行测定。
4、计算并报告分析结果:根据测定的有关数据计算出组分的含量,并写出分析实验报告。

第二章定量分析的一般步骤一、分析试样的采集与制备1.试样的采集与制备:是指从大批物料中采取少量的样本作为原始试样,然后再制备成供分析用的最终式样。
采样的基本原则:均匀、合理、具有代表性试样的形态:气体、液体、固体2.取样方法:气体样品:集气法(eg.工厂废气中有毒气体的分析)、富集法(eg.大气污染物的测定、室内甲醛的含量测定)固体样品:抽样样品法(“四角+中央”)、圆锥四分法液体样品:混合均匀后按照上中下分层取样二、试样的分解(预处理)1.分解试样的原则:①式样分解必须完全,处理后的溶液中不得残留原试样的细屑或粉末②式样分解过程中待测组分不应挥发③不应引入待测组分和干扰物质2.分解方法:溶解法、熔融法、消解法(1)溶解法:水:例(NH4)2SO4中含氮量的测定酸:HCl、H2SO4、HNO3、HF等及混合酸分解金属、合金、矿石等碱:例:NaOH溶解铝合金分析Fe、Mn、Ni含量有机溶剂:相似相溶原理(2)熔融法:酸溶:K2S2O7、KHSO4溶解氧化物矿石碱溶:Na2CO3、NaOH、Na2O2溶解酸性矿物质(3) 消解法——测定有机物中的无机元素湿法消解:通常用硝酸和硫酸混合物与试样一起置于克氏烧瓶中,一定温度下分解,属于氧化分解法常用试剂:HNO3、H2SO4、HClO4、H2O2和KMnO4等。
干法灰化:待测物质加热或燃烧后灰化、分解,余留残渣用适当的溶剂溶解。
适用范围:有机物和生物试样中金属元素、硫、卤素等无机元素。
常用方法:坩埚灰化法、氧瓶燃烧法和低温灰化法。
三、常用的分离、富集方法1. 分离:让试样中的各组分互相分开的过程(纯化)分离的作用:提高方法的选择性、提高方法的灵敏度、准确度分离方法:沉淀分离、萃取分离、挥发分离、色谱分离2. 富集:待测组分含量低于测定方法的检测限时,在分离时将其浓缩使其能被测定富集方法:萃取富集、吸附富集、共沉淀富集四、测定方法的选择分析对象(样品性质、组分含量、干扰情况)→分析方法(准确度、灵敏度、选择性、适用范围)→用户(用户对分析结果的要求和对分析费用的承受度)→成本(时间、人力、设备、消耗品)五、分析结果的计算与评价1. 分析结果的计算及评价的目的:判断分析结果的准确度、灵敏度、选择性等是否达到要求2. 含量计算方法:根据分析过程中有关反应的化学计量关系及分析测量所得数据进行计算3. 测定结果及误差分布情况的分析:可采取统计学方法进行评价,如平均值、相对标准偏差、置信度、显著性检查等。

分析化学中的定量分析方法一、简介分析化学是研究物质组成、性质与用途之间关系的一门科学。
其中,定量分析是分析化学的重要分支,旨在确定物质中某种(或多种)成分的含量,它涵盖了许多精确测量技术和方法。
本文将对分析化学中的定量分析方法进行分析和探讨。
二、体积分析法体积分析法是常用的定量分析方法之一,利用溶液间体积反应滴定的定量法称为滴定分析。
滴定分析常用于酸碱度测定、含氧量测定等。
其基本原理是根据滴定剂与反应物滴定滴定终点变化的指示现象来确定滴定剂浓度和待测物质含量。
三、重量分析法重量分析法是通过称量待测物质或生成物质的质量来确定物质的含量。
常见的重量分析方法包括常规重量法、硬水滴定法、沉淀法等。
这些方法在定量分析中起着非常重要的作用,常应用于溶解度测定、物质纯度检验等。
四、光谱分析法光谱分析法是利用物质与特定波长范围内的辐射相互作用,通过分析辐射的吸收、发射或散射来定量分析物质。
常见的光谱分析方法有紫外可见分光光度法、原子吸收光谱法、红外光谱法等。
这些方法具有高分辨率、高准确性和快速分析的优点,被广泛应用于医药、环境、食品等领域。
五、电化学分析法电化学分析法是通过测量物质在电解质溶液中的电流、电势、导体电导率等物理化学量来定量分析物质的一种方法。
常见的电化学分析方法有电位滴定法、电导滴定法、极谱法等。
这些方法在分析化学中的金属离子、无机物以及某些有机物的测定中具有广泛的应用。
六、色谱分析法色谱分析法是基于物质在某种固定相或液相中分离的原理,通过物质在固定相上的各种作用力的差异,利用色谱柱将物质分离,并通过检测器进行检测和定量分析。
常见的色谱分析方法有气相色谱法、液相色谱法、离子色谱法等。
色谱分析法广泛应用于食品、药物、环境等领域。
七、质谱分析法质谱分析法是利用质谱仪测量样品中离子相对质量与相对丰度的比例,通过检测质谱图谱来定量分析物质。
常见的质谱分析方法有质谱仪法、飞行时间质谱法、电子轰击质谱法等。
质谱分析法具有高分辨率、高灵敏度和能量准确性高的特点,在有机物质和生物大分子的定量分析中具有重要应用。




高一化学实验中的定量分析方法在高中化学实验中,定量分析是一个非常重要的实验技能。
它通过使用一系列的实验方法和技术,来确定物质中特定化学物质的准确数量。
本文将介绍高一化学实验中常用的定量分析方法。
一、酸碱滴定法酸碱滴定法是一种常用的定量分析方法,适用于测定酸、碱和中性物质的含量。
它基于化学反应的等量原理,通过滴加酸碱溶液来确定溶液中酸碱物质的浓度。
在实验中,通常使用酸碱指示剂来指示滴定终点。
二、氧化还原滴定法氧化还原滴定法是一种利用氧化还原反应进行定量分析的方法。
通过滴加氧化剂或还原剂来确定被测物质的含量。
这种方法常用于测定含有还原性或氧化性物质的溶液中的化学物质。
三、沉淀滴定法沉淀滴定法是一种基于沉淀反应的定量分析方法。
它通过滴加沉淀剂到待测溶液中,观察结果是否产生沉淀来判断反应的终点和计算待测物质的含量。
沉淀滴定法通常用于测定溶液中特定离子的浓度,如硫酸根离子、氯离子等。
四、比色法比色法是一种常用的定量分析方法,通过测量溶液中某些物质的吸光度,来确定它们的浓度。
实验中,使用比色皿或分光光度计来测定溶液的吸光度,并将吸光度值与标准曲线进行比较,以确定待测物质的浓度。
五、电化学分析法电化学分析法是利用电化学方法进行定量分析的方法。
它基于电流和电势的测量,通过测量电流或电势的变化来确定被测物质的浓度。
电化学分析法常用于测定金属离子、氧化还原剂、化学反应速率等。
六、原子吸收光谱法原子吸收光谱法是一种利用原子吸收光谱仪测定元素含量的方法。
它基于原子吸收物质对特定波长的光的吸收,通过测量吸收光谱的强度来确定元素的浓度。
原子吸收光谱法广泛用于分析土壤、水质和化学样品中的金属元素。
七、质谱分析法质谱分析法是一种通过质谱仪测定物质分子结构和组成的定量分析方法。
质谱分析法通过将样品分子离子化,然后通过质谱仪进行质量分析,从而确定样品中各个组分的定量。
总结:本文介绍了高一化学实验中常用的定量分析方法,包括酸碱滴定法、氧化还原滴定法、沉淀滴定法、比色法、电化学分析法、原子吸收光谱法和质谱分析法。